结合CRISPR/Cas12b 与LAMP 技术的乳粉中克罗诺杆菌属的检测
2024-01-16张懿翔张清平刘洋
张懿翔,张清平,刘洋
(上海市质量监督检验技术研究院国家市场监管重点实验室(乳及乳制品检测与监控技术) 上海 200233)
0 引 言
克罗诺杆菌为革兰氏阴性菌,是一种普遍存在于自然中的条件致病菌,环境耐受性强,在婴幼儿配方乳粉中存在克罗诺杆菌属高污染风险[1-5]。6 个月以下的婴幼儿易感染,可引发坏死性小肠结肠炎、菌血症和新生儿脑膜炎等疾病,死亡率高达40%~80%[6-8]。目前检测克罗诺杆菌属的主要方法为传统培养方法,整个检测过程需要4~7 d,而且灵敏度低,对疑似菌株无法第一时间区分,在快速检测中应用受限。因此,为了有效地监测乳粉安全,开发快速且灵敏的克罗诺杆菌属检测方法具有重要的现实意义。
环介导等温扩增法——LAMP(loop-mediated isothermal amplification),通过设计4~6 条特异性引物,利用Bst DNA 聚合酶,可在等温条件下高效扩增目标片段,并且对仪器的要求低,具有高效简便、灵敏度高、反应快速等优点[9-11]。但存在引物设计复杂,存在多条引物相互作用以及气溶胶造成的假阳性问题。
CRISPR(Clustered regularly interspaced short palindromic repeats)检测技术是利用Cas 蛋白反式切割活性,通过向导RNA 引导与靶标结合并切割探针发出荧光,实现快速灵敏检测[12-19]。近年来,CRISPR 技术在分子检测、病原菌检测、植物育种、病毒检测等生物技术领域均有应用[20-27]。CRISPR 反应受限于Cas 酶活和底物浓度[18]。
本研究基于CRISPR-Cas12b 蛋白,属于第2 类CRISPR/Cas 系统中的Ⅴ型,具有反式切割特性,靶向的模板为DNA,并反式切割单链ssDNA[28-29]。将LAMP 扩增方法与Cas 蛋白检测相结合,首先利用LAMP 进行核酸扩增,在向导RNA 引导下,Cas12b 产生对ssDNA 切割进行检测,在提高灵敏度的同时,也提高了特异性,结合了2 种方法的优点,可以对婴幼儿配方乳粉以及相关生产环节中的克罗诺杆菌属进行快速检测。
1 材料与方法
1.1 材料
1.1.1 菌株
选择由上海海关动植物与食品检验检疫技术中心提供的8 株克罗诺杆菌属标准菌株和33 株实验室分离菌株,以及30 株购自中国工业微生物菌种保藏管理中心的非克罗诺杆菌属菌株,用于特异性检测。
1.1.2 培养基与试剂
缓冲蛋白胨水(BPW)、营养肉汤、营养琼脂、平板计数琼脂及阪崎肠杆菌显色培养基,北京陆桥技术有限公司;NEBuffer 3.1(10×)、Warm Start LAMP Kit,NEB;RNA 酶抑制剂,Takara;UltraPureTM无核酸酶水,Thermo Fisher;Cas12b 蛋白,吐露港生物;细菌DNA提取试剂盒DP302-02,天根生化科技(北京)有限公司。所有LAMP 引物以及RNA 引物由南京金斯瑞生物科技有限公司合成。
1.2 仪器与设备
荧光定量PCR 仪(Applied Biosystems ABI7500,ABI7300),超微量紫外可见分光光度计(DeNovix DS-11),美国 DeNovix 公司;Vortex Genie2 漩涡振荡器,德国Heidolph 公司;台式高速冷冻离心机(Eppendorf,5430R),德国Eppendorf 公司;移液器(2、10、100、1000 μL)(Eppendorf Research Plus),德国Eppendorf 公司;Bio 391 超净工作台,法国Erlab 公司;Milli-Q 超纯水机,德国Merck 公司;生物安全柜,新加坡ESCO 公司。
1.3 实验方法
1.3.1 引物设计
使用Prokka 工具 (Seemann, 2014) 对Cronobacter sakazakiiATCC 29544 的基因组进行注释,寻找基因内部的候选保守序列。针对克罗诺杆菌属特异性关键基因序列利用引物设计软件Primer Explorer version 5.0以及Prime Express 分别设计LAMP 引物序列和向导RNA 靶向序列,经过特异性及灵敏度测试,挑选效率最高和特异性最好的组合,序列如表1 所示。CRISPR反应的报告探针为12 个随机序列的单链DNA 序列。
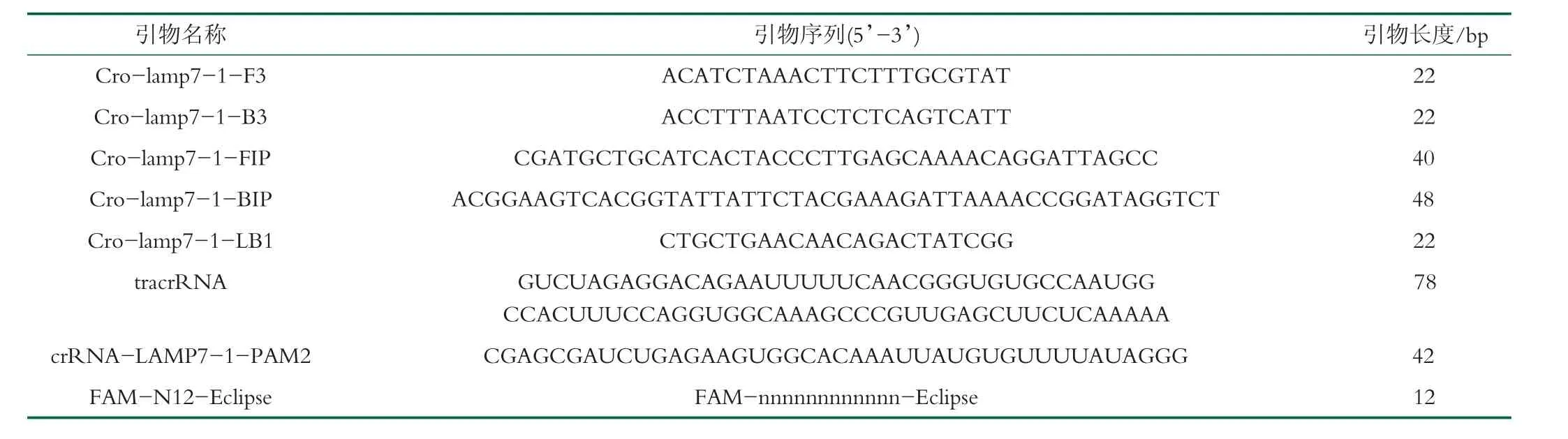
表1 引物与探针
1.3.2 DNA 提取方法
实验菌株:将菌株接种于营养肉汤中复苏,36 ℃培养24 h,取2 mL 培养液,加入无菌离心管中,13 000 r/min,离心5 min,除去上清,取沉淀。然后根据试剂盒说明书进行提取。
实验样品:取乳粉样品100 g 加入到900 mL 的BPW 中,混匀,36 ℃培养12 h。取2 mL 的样品培养液加入无菌离心管中,3 000 r/min 离心10 min 去除上层脂肪层,然后13 400 r/min 离心10 min,取沉淀,根据试剂盒说明书进行提取[30]。
1.3.3 反应体系及条件优化
LAMP 反应体系:先将引物用无核酸酶水稀释至100 μmol/L,之后按如下比例配制(以100 μL 体系为例)FIP、BIP 16 μL,F3、B3 2 μL,LB1 4 μL,无核酸酶水补充至100 μL。反应体系包括10 μL 2×WarmStart LAMP mix,LAMP primer mix (10 μmol/L)2 μL,DNA 模板(约50 ng/μL)1 μL,用超纯水补足总体积为20 μL。LAMP 反应条件:65 ℃反应30 min,90 ℃反应2 min 灭活;根据扩增效果选择最适宜的时间。
CRISPR 反应体系:10×NEBuffer 3.1 2 μL,Cas12b(5 μmol/L)1 μL,crRNA(10 μmol/L),tracrRNA(10 μmol/L)和探针(10 μmol/L)各1 μL,RNA 酶抑制剂(40 U/μL)0.25 μL,待测DNA 模板2 μL,用无核酸酶水补足总体积至20 μL。ABI 7500 荧光PCR仪48 ℃,每1 min 检测一次FAM 荧光,持续15 min。
1.3.4 特异性检测
将收集到的41 株阳性菌株和30 株非克罗诺杆菌属阴性菌株,根据1.3.2 提取DNA。利用LAMP 对菌株DNA 进行扩增,再使用CRISPR 反应检测。
1.3.5 灵敏度试验
对核酸浓度为1×105、1×104、1×103、1×102、10、1、1×10-1pg/μL 的克罗诺杆菌属(ATCC 25944)核酸样品进行检测。克罗诺杆菌属纯菌液(102~107CFU/mL),取2 mL 菌液提取DNA 进行检测,获得纯菌液检出限。
1.3.6 人工污染样品的制备
选择乳粉作为添加基质,称取100 g 加入900 mL BPW 缓冲蛋白胨水,均质混匀。分别加入浓度为<10,1×102,1×103,1×104CFU/mL 克罗诺杆菌属(ATCC 25944)菌悬液各1 mL。人工染菌后的BPW 增菌液36 ℃培养12 h,取各样品匀液2 mL 提取核酸,进行检测。
1.3.7 模拟生产环境样品检测
模拟生产环境样品,在生产企业停产期间使用无菌棉签对生产过程中各个环节进行环境取样,17 个地点、52 份模拟环境样品。阳性对照使用棉签涂抹阳性菌株(克罗诺杆菌属(ATCC 25944))人工污染的平板,采样的棉签放入BPW 中经过12 h 36 ℃增菌,然后提取核酸并检测,并同时依照GB 4789.40—2016 进行验证。
1.3.8 市售样品检测
为了考察实际样品中的实验数据,采购市售不同厂家及日常检测的婴幼儿配方奶粉共计51 例。用本研究建立的方法对此51 份不同品牌的婴幼儿配方乳粉进行检测。根据1.3.2 方法提取样品核酸进行检测。并用国标方法GB 4789.40—2016 进行验证。
2 结果与分析
2.1 LAMP 反应条件
对LAMP 时间进行优化结果如图1 所示,可以看到LAMP 反应在10 min 左右开始有扩增信号,40 min之后会有一部分非特异性扩增,故第一步扩增时间选定为30 min。
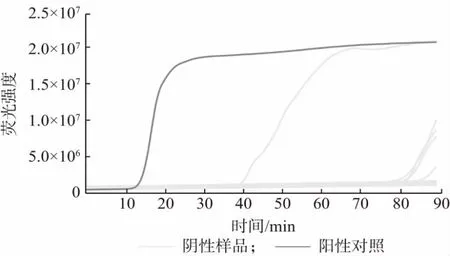
图1 LAMP 反应时间
2.2 特异性试验结果
检测结果如图2~3 所示,所有克罗诺杆菌属阳性菌株均有明显的扩增信号,而其他常见阴性菌株的均没有明显扩增信号,通过荧光信号的差异可以判定检测结果。表明所设计的引物探针及向导RNA 靶向序列具有良好的特异性。
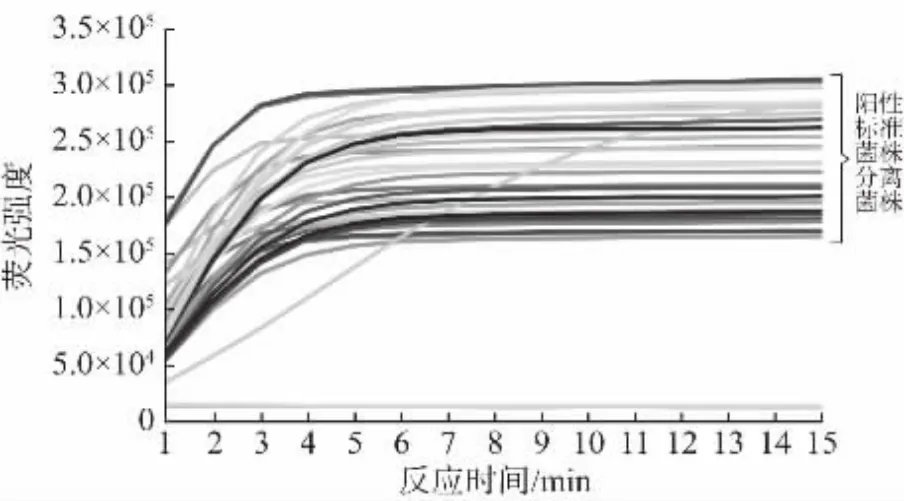
图2 克罗诺杆菌属阳性菌株CRISPR 检测结果
2.3 灵敏度检测
核酸水平检出限结果如图4 所示,本方法可以检测到核酸水平100 ng/μL~0.1 pg/μL 的样品,而单纯LAMP 反应如图5 所示只能检测到1 pg/μL,通过CRISPR 切割能获得更高的灵敏度。纯菌液检测结果如图6 所示,本方法可以检测到1×102CFU/mL 的纯菌液,1×102~1×107CFU/mL 的菌液均有明显荧光信号,可以稳定检测到1×102CFU/mL 的纯菌液。
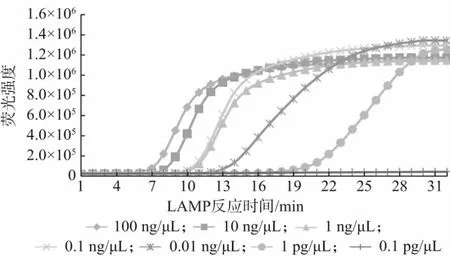
图5 单纯LAMP 检测结果

图6 纯菌液样品CRISPR 检测结果
2.4 人工污染样品的检测
如图7 所示,4 个不同污染水平的乳粉样品均有明显扩增荧光信号,证明该方法可以检测克罗诺杆菌属初始含量为10 CFU/100 g 及以下的乳粉样品。
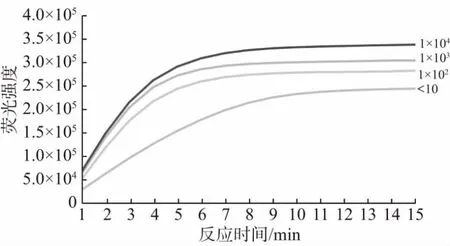
图7 CRISPR 方法对人工污染样品的检测结果
2.5 模拟生产环境样品检测
对模拟生产环境样品检测,17 个地点、52 份模拟环境样品,分别在2 个模拟污染地点的3 批次环节样品中检出阪崎克罗诺杆菌,与GB 4789.40—2016 方法的检测结果一致,另有4 批次环节样品在传统分离方法中,阪崎肠杆菌显色平板上出现了典型的疑似菌落,而本研究建立的CRISPR 方法检测结果为阴性(未检出),后续的生化鉴定结果均为非克罗诺杆菌属。进一步证明了该方法检测的特异性较好,完全可以用于克罗诺杆菌属的现场检测。
2.6 市售样品检测
本次所收集的51 批次奶粉,有4 批次为进口奶粉,其余均为国内生产的婴幼儿配方乳粉,其产地来源于15 个省或直辖市(黑龙江、吉林、辽宁、内蒙古、陕西、宁夏、新疆、河北、山东、天津、江西、湖北、湖南、浙江、上海)。使用本研究方法进行检测,51 份样品均未检出克罗诺杆菌属,同时使用GB 4789.40—2016 进行检测,也均未检出克罗诺杆菌属,检测结果一致。但是本研究的CRISPR 方法能够大大缩短实验时间,并且能排除非克罗诺杆菌属对实验结果的干扰。
3 结 论
克罗诺杆菌属是一种分布广泛的食源性致病菌,在婴幼儿配方乳粉的各个生产环节中都存在污染风险,目前食品中克罗诺杆菌属的检测方法主要有常规培养法、荧光PCR 法等检测方法[31-36]。传统检测方法,整个检测过程至少需要4~7 d,而且灵敏度低,对于疑似菌株无法第一时间区分。
本研究结合 LAMP 恒温扩增和 CRISPRCas12b 技术,建立了一种能够快速检测乳粉中克罗诺杆菌属的新方法。所建立的检测方法具有快速、灵敏、高特异、简便的特性,能够实现现场的快速检测,方法检出限为<10 CFU/100 g。市售样品检验结果与预期结果相符,并且利用建立的方法对婴儿配方食品企业生产环节中的设备、环境和过程产品进行采样,检测结果与国标结果一致,并且大大缩短实验时间,排除疑似菌株的干扰。因此,本方法能够对乳粉的生产过程进行克罗诺杆菌的全流程筛选检查,实现企业和检测机构快检的目的。LAMP 技术与CRISPR 检测技术相结合在提高灵敏度的同时,也提高了特异性,仪器要求也不高,满足了乳粉生产企业日常监管与体系检查的需要,节约了企业检测成本与时间,能够更有效地监测乳粉安全问题。在今后的研究中可将不同的Cas 蛋白运用于乳品领域的CRISPR 检测,做到一步法定量检测、DNA 和RNA 相同步骤的快速分子检测,进一步将该技术在食品安全领域进行创新性研究及应用。
