润楠叶片多糖提取工艺、结构表征与生物活性研究
2024-01-16梁思琪祁小艳肖强
梁思琪,祁小艳,肖强
(湖北民族大学 林学园艺学院,湖北 恩施 445000)
润楠[Machilus nanmu(Oliv.) Hemsley]为樟科(Lauraceae)润楠属植物,广泛分布于亚洲东南部和东部的热带、亚热带地区,资源十分丰富。润楠植物中富含多种活性代谢产物[1-2],在皮肤炎症、足肿、腹泻等医疗方面颇有效果。湖北民族大学植物园内种植许多润楠,润楠的管理过程中有大量的叶片缺乏利用,应对其进行开发,提高其综合效益。经前期研究发现,润楠叶片中多糖含量较高,而植物多糖具有免疫调节[3-4]、抗肿瘤[5-6]、抗衰老[7-9]、降血糖[10]以及抗凝血[11]等功效。目前关于润楠叶片多糖的研究还未见报道,其结构如何、在抗氧化、抗肿瘤活性方面是否同其它植物多糖一样发挥作用?为此,本研究以润楠叶片为材料,采用超声辅助复合酶法提取多糖,以得率为指标,探究pH、超声温度、超声功率、超声时间对多糖提取率的影响;并采用正交试验设计[12]确定最佳工艺参数。进一步,利用红外光谱法分析其官能团,扫描电镜观察其表观形貌,液相色谱法测定其单糖组成[13-15];最后采用体外抗氧化实验和细胞实验考查润楠叶片多糖的生物活性[16-17]。通过以上研究,探究润楠叶片多糖的功能并为其综合利用提供科学依据。
1 材料与仪器
1.1 实验材料与试剂
润楠叶片,采摘于湖北民族大学植物园,经湖北民族大学林学园艺学院易咏梅教授鉴定;健康、无病虫害的叶片用清水冲洗干净,50℃热泵式烘箱中烘干、粉碎后过40目筛,得润楠叶片粉末。
果胶酶(酶活力 ≥ 500 000 U/g,福州飞净生物科技有限公司);纤维素酶(酶活力 ≥ 400 000 U/g,福州飞净生物科技有限公司);无水乙醇(武汉市中天化工有限责任公司);D-无水葡萄糖(生工生物工程股份有限公司);苯酚(阿拉丁试剂有限公司);浓硫酸(武汉市中天化工有限责任公司);柠檬酸(国药集团化学试剂有限公司),磷酸氢二钠(国药集团化学试剂有限公司);溴化钾(国药集团化学试剂有限公司);三氯甲烷(天津市福晨化学试剂厂);1-苯基-3甲基-5-吡唑啉酮(PMP,阿拉丁);乙腈(色谱纯,DIKMA);乙酸铵(阿拉丁);D-葡萄糖,D-甘露糖,L-鼠李糖,D-半乳糖,D-阿拉伯糖,L-岩藻糖,D-葡萄糖醛酸,D-半乳糖醛酸均为标准品(纯度 ≥ 98%,上海源叶生物科技有限公司);DPPH(阿拉丁);焦性没食子酸(天津市博迪化工有限公司);Tris-HCl(阿拉丁);L-抗坏血酸(Vc,国药集团化学试剂有限公司);HCCLM(人肝癌细胞);A549(人肺癌细胞);胎牛血清(E510002-0100生工生物);RPMI培养基(E600028-0500生工生物);PBS(AG29714106 cytiva公司);DMEM培养基(AG29714106 cytiva公司);1640培养基(AG29714106 cytiva公司);青霉素链霉素溶液(源叶生物);CCK-8试剂盒(100T,大连美仑公司)。
1.2 仪器设备
流水式高速中药粉碎机(LG-20,瑞安市百信制药机械有限公司);循环式水式多用真空泵(SHBIII,郑州长城科工贸有限公司);数显恒温水浴锅(HH-2,上海力辰邦西仪器科技有限公司);高速大容量冷冻离心机(H2050R,湖南湘仪实验室仪器开发有限公司);超声波细胞破碎仪(950E,宁波新芝生物科技股份有限公司);双光束紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);电子天平(ALB-124,赛多利斯科学仪器(北京)有限公司); Nicolet iS50 FT-IR红外光谱仪;JSM-6510LV扫描电镜;HPLC高效液相色谱仪(Thermo公司);洁净工作台(JJ-CJ-1FD,苏州市金净净化设备科技有限公司);多功能酶标仪(Thermo公司);二氧化碳细胞培养箱(Thermo公司);荧光倒置显微镜(Olympus)。
2 实验方法
2.1 多糖的提取
称取一定质量润楠叶片粉末于烧杯中,加入2%复合酶(纤维素酶 ∶ 果胶酶 = 1 ∶ 1),按照料液比1 ∶ 20(g/mL)添加不同pH的磷酸氢二钠-柠檬酸缓冲溶液,置于已设定好温度、时间、功率的超声细胞破碎仪中进行提取,超声结束后,立刻抽滤,向收集的滤液中加入无水乙醇使其达80%浓度(v/v),于4℃冰箱中醇沉12 h,醇沉结束后于8 000 r/min、4℃条件下离心10 min,除去上清液,向沉淀加入蒸馏水复溶,冷冻干燥后得润楠叶片多糖粉末。取一定质量的润楠叶片多糖粉末,参照覃钱等[18]方法用苯酚-硫酸比色法测定多糖含量。
多糖得率=C×V×N/m×10-6×100%
式中C为待测液的质量浓度,μg/mL;V为待测液的体积,mL;N为稀释倍数;m为样品质量,g。
2.2 单因素试验
以0.5 g润楠叶片粉末为提取对象,对体系pH、超声温度、超声功率、超声时间4个因素进行单因素试验,讨论提取因素对润楠叶片多糖得率的影响。体系pH为3、4、5*、6、7,超声温度为30、40*、50、60、70℃,超声功率为100、150、200*、250、300 W,超声时间为5、10*、15、20、25 min(*代表在做某一单因素实验中,其它因素的取值)。
2.3 正交试验
在单因素试验的基础上,以体系pH(A)、超声温度(B)、超声功率(C)和超声时间(D)为自变量,以多糖得率(R)为因变量。确定润楠叶片多糖提取的最佳参数。

表1 正交试验因素水平表Tab.1 Factor level table of orthogonal experiment
2.4 结构分析
2.4.1 红外光谱
润楠叶片多糖粉末与溴化钾按照1 ∶ 100(mg)研磨混匀,利用傅里叶变换红外光谱仪,在400 ~4 000 cm-1波长下进行扫描分析。
2.4.2 扫描电镜
取微量润楠叶片多糖粉末黏在带有导电胶带的处理片上,经喷金处理后,利用扫描电镜扫描分析,观察润楠叶片多糖的微观形貌。
2.4.3 单糖组成
样品水解及样品和标准品的衍生参考林晓燕[19]方法。
色谱条件:色谱柱(Diamonsil Plus,5 μm,C18-B,250 mm × 4.6 mm);流动相A:乙腈,流动相B:50 mmol/L乙酸铵溶液,梯度洗脱程序:0 ~ 60 min,85% ~ 75% A,15% ~ 25% B,在线脱气,流速1.0 mL/min,柱箱温度30℃,检测波长250 nm,进样量10 μL。
2.5 抗氧化活性研究
2.5.1 DPPH自由基清除效果的测定
参照胡玲华等[20]方法略作修改:将润楠叶片多糖粉末配制成不同浓度溶液,各取2 mL置于试管中,加入0.4 mmol/L DPPH无水乙醇溶液2 mL,摇匀,室温条件下置于黑暗处放置30 min。在波长517 nm处分别测定吸光度Ai,另分别测定参比溶液吸光度Ab和空白溶液吸光度A0。以同浓度的Vc溶液做阳性对照,清除率计算公式为:
2.5.2 羟基自由基清除效果的测定
参照胡玲华等[20]方法略作修改:将润楠叶片多糖粉末配制成不同浓度溶液,各取1 mL置于试管中,然后加入6 mmol/L FeSO4溶液1 mL,再加入6 mmol/L H2O2溶液1 mL,振荡均匀,最后加入6 mmol/L水杨酸-乙醇溶液1 mL,摇匀,静置37℃水浴锅中反应30 min。在波长510 nm处分别测定其吸光度Ai;另用蒸馏水代替过氧化氢溶液重复上述试验,测得参比吸光度Ab;另用蒸馏水代替样品溶液重复上述试验,测得空白吸光度A0。以同浓度的Vc溶液做阳性对照,清除率计算公式为:
2.6 抗肿瘤活性研究
2.6.1 肿瘤细胞培养
将购买的HCCLM(人肝癌细胞)、A549(人肺癌细胞)进行复苏,复苏完成后分别将其转移至装有DEME、RPMI-1640培养基的T25瓶中,放入37℃含有5% CO2的培养箱中培养。当细胞培养到密度为70% ~ 80%时,用于后续实验。
2.6.2 CCK-8法检测润楠叶片多糖细胞活力
参照程婷婷等[21]方法略作修改:在96孔培养板中,分别接种对数生长期的HCCLM、A549细胞,每孔0.1 mL(约1 × 104个细胞),培养24 h后,倒掉细胞培养液,用PBS缓冲溶液冲洗后,分别加入0.1 mL不同浓度的多糖提取溶液,每浓度平行6孔,培养24 h后,倒掉多糖提取液,加入0.1 mL的CCK-8,置于37℃,5% CO2及饱和湿度的培养箱培养0.5 h后,以450 nm为检验波长,用MK3型酶标仪测定吸光度。以细胞的存活率和药物的不同浓度作图,计算细胞存活率。
2.7 数据处理
所有数据均设3组平行,利用软件SPSS 23进行数据分析,Origin 2021进行绘图。
3 结果与分析
3.1 单因素实验
体系pH:当pH为5时,润楠叶片多糖得率最高,当pH过高或过低时,使得纤维素酶和果胶酶处于不适pH下,影响活性基团的解离,酶促反应降低,导致得率下降;故选取最佳体系pH为5。
超声温度:随着温度的不断提高,润楠叶片多糖的得率逐渐增加,在60℃时达到最大值,60℃后,随着温度继续增高,得率反而下降。这是因为一方面加热可以促进酶活性,增大反应速度;另一方面当温度过高,可能分解其有效成分,影响多糖得率;所以选择60℃作为最佳超声温度。
提取功率:当功率从100 W上升时,润楠叶片多糖得率也在不断增加,在250 W时达到最大,此后,随着功率的增加,得率反而下降,这可能是由于一定程度的超声波对植物细胞有破碎作用,有利于提取物的释放,但随着超声波功率不断增大,对细胞的破碎程度增大,溶解杂质增多,有效成分溶解量减少,得率呈下降趋势;所以选择200 W作为最佳超声功率。
超声时间:当超声时间过短时,一方面超声波的气穴效应和热效应没有充分发挥,另一方面酶与底物反应不充分,从而导致得率偏低;当超声时间大于15 min时,随着超声时间延长,会导致多糖降解,使得润楠叶片多糖得率下降;故选取最佳超声时间为15 min。
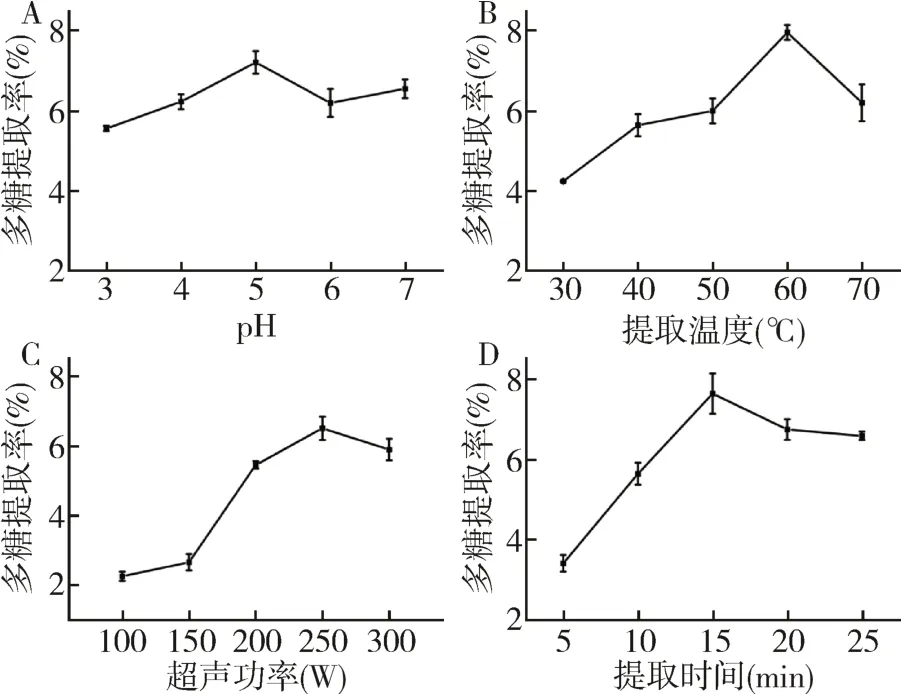
图1 各因素对润楠叶片多糖提取率的影响Fig.1 Effects of various factors on polysaccharide yield from leaves of M.nanmu
3.2 正交试验
根据3.1中单因素试验结果,设计四因素三水平L9(34)正交试验优化提取润楠叶片多糖的工艺条件。结果见表2。各因素影响多糖提取率顺序为D(超声时间) > B(超声温度) > C(超声功率) > A(体系pH),由各因素水平结果分析可知,最佳提取参数组合为A2B1C2D3,即体系pH = 5、超声温度50℃、超声功率250 W、超声时间20 min。对多糖最佳提取工艺进行验证:多糖优化工艺的提取率平均值为7.23%,RSD小于3.57%,表明润楠叶片多糖的优化提取工艺稳定可行。
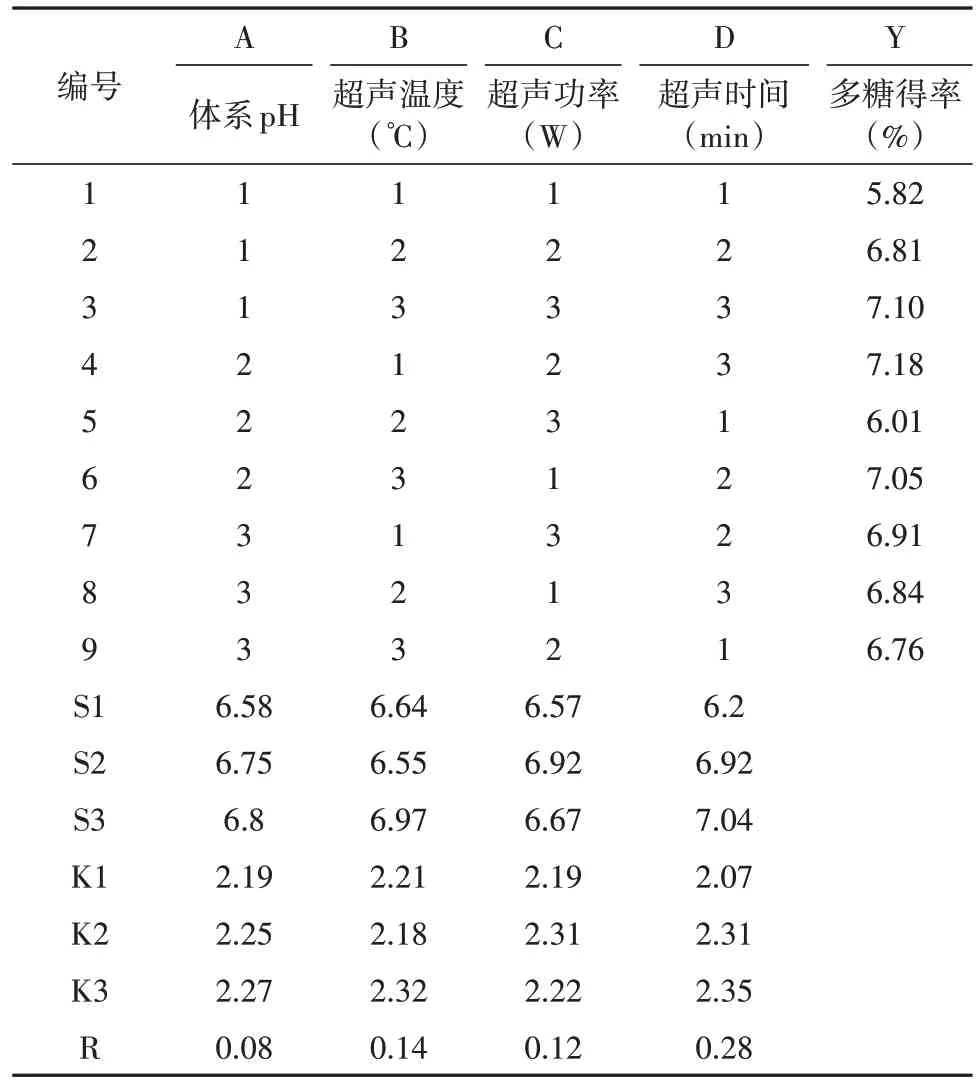
表2 正交试验设计与结果Tab.2 Experimental design and results of orthogonal tests
3.3 润楠叶片多糖的结构表征
3.3.1 红外光谱分析
润楠叶片多糖在3 420 cm-1处的吸收谱带宽而强,为O-H伸缩振动和N-H伸缩振动叠加,主要贡献物为蛋白质和核酸;在1 649 cm-1的特征峰COO-的非对称伸缩振动;1 411 cm-1为C-H键的变角振动吸收峰;1 200 ~ 900 cm-1范围多为多糖吸收区(图2)。
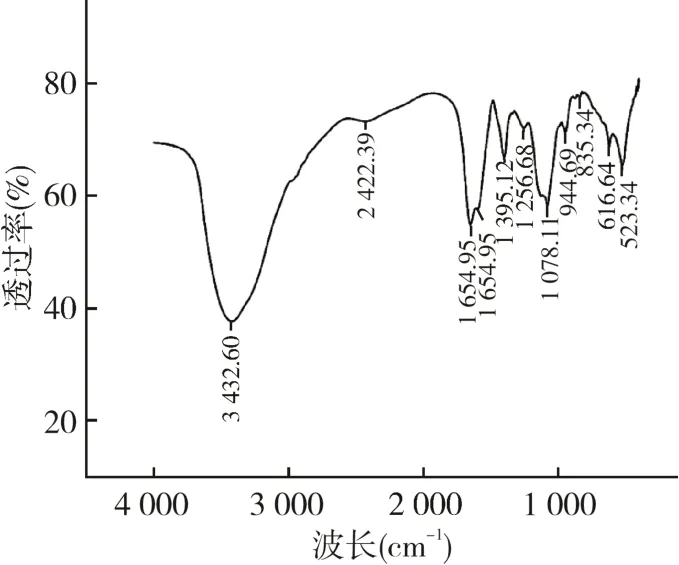
图2 润楠叶片多糖的红外光谱图Fig.2 Infrared spectra of polysaccharides from leaves of M.nanmu
3.3.2 扫描电镜分析
通过扫描电镜对润楠叶片多糖进行形态和结构观察(见图3)。在500倍镜头下可见润楠叶片多糖呈不规则的块状形态,棱角分明且存在一些微小的空隙,随着放大倍数的增大,在800和2 000倍的镜头下,可以看到其表面光滑、立体结构出现疏松,这可能与经过酶解处理后引起润楠叶片多糖结构发生改变有关。

图3 润楠叶片多糖的扫描电镜图Fig.3 Scanning electron microscopy of polysaccharides from leaves of M.nanmu
3.3.3 单糖组成分析
通过对单糖标准品衍生化后HPLC图谱(图4)保留时间综合分析可知:16.050 min为甘露糖,19.817 min为鼠李糖,22.353 min为葡萄糖醛酸,24.343 min为半乳糖醛酸,27.837 min为葡萄糖,30.200 min为半乳糖,31.647 min为阿拉伯糖,34.080 min为岩藻糖。

图4 混合单糖标准品色谱图Fig.4 Color spectrum of mixed monosaccharide standard
润楠叶片多糖水解产物经PMP衍生化的HPLC色谱图见图5,几种单糖的分离效果好,经过和标准单糖的保留时间比对,可以知道润楠多糖的单糖主要包括D-甘露糖,D-半乳糖醛酸,D-葡萄糖,和L-阿拉伯糖,其摩尔比为Man ∶ GalA ∶ Glc ∶ Ara =2.87 ∶ 0.45 ∶ 0.94 ∶ 3.09。

图5 润楠叶片多糖液相色谱图Fig.5 Liquid chromatogram of polysaccharide from leaves of M.nanmu
3.4 润楠叶片多糖抗氧化活性
3.4.1 DPPH自由基清除能力
当多糖浓度在1 ~ 5 mg/mL时,润楠叶片多糖各浓度对DPPH自由基的清除率随浓度升高而增大,表现出明显的量效依赖线性关系,当浓度为5 mg/mL时,润楠叶片多糖对DPPH自由基的最大清除率为68.34%,其清除率可达Vc的71.89%,表明润楠叶片多糖对DPPH自由基有一定的清除作用(图6)。

图6 润楠叶片多糖对DPPH自由基的清除作用Fig.6 Scavenging effect of polysaccharides from leaves of M.nanmu on DPPH free radical
3.4.2 羟基自由基清除能力
不同浓度的润楠叶片多糖对羟基自由基均具有较好的清除能力,在0.2、0.4、0.6 mg/mL时,润楠叶片多糖对羟基自由基的清除率为70.47%、72.81%、78.51%,均高于Vc。显示润楠叶片多糖对羟基自由基具有清除作用(图7)。

图7 润楠叶片多糖对羟基自由基的清除作用Fig.7 Scavenging effect of polysaccharides from leaves of M.nanmu on hydroxyl radical
3.5 润楠叶片多糖抗肿瘤活性
当多糖浓度在1.25 ~ 10 mg/mL时,润楠叶片多糖对HCCLM、A549细胞没有显著抑制作用。在多糖浓度为20 mg/mL时,对HCCLM、A549细胞抑制作用效果显著,几乎无细胞存活;该结果表明高浓度的润楠叶片多糖具有一定的抗肿瘤活性(图8, 9)。

图8 润楠叶片多糖对HCCLM细胞活力的影响Fig.8 Effect of polysaccharides from leaves of M.nanmu on cell viability

图9 润楠叶片多糖对A549细胞活力的影响Fig.9 Effect of polysaccharides from leaves of M.nanmu on cell viability
4 讨论与结论
目前多糖提取方式主要有热水浸提法、超声法、酶解法及超声辅助酶法等[22],其含量一般采用苯酚-硫酸法测定。对于富含果胶类粘性物质的润楠叶片,若仍采用热水浸提法再通过苯酚-硫酸法测定其多糖含量,往往会使测定的多糖含量偏高。为此,该文采用纤维素酶和果胶酶复合对润楠叶片多糖进行超声酶解,在单因素基础上进行正交试验设计,得出润楠叶片多糖的最佳提取工艺:体系pH = 5、超声温度50℃、超声功率250 W、超声时间20 min。在此工艺条件下,多糖得率为7.18%。豆佳媛等[23]通过正交试验优化超声辅助提取银杏叶多糖,在最佳条件下,银杏叶多糖提取率为4.60%,显示了超声法提取植物叶片多糖的的良好效率;该文通过超声辅助复合酶方式,提高了润楠叶片多糖得率。润楠叶片多糖红外光谱图主要以蛋白质、核酸和糖类等吸收带组成,并显示多糖的典型特征吸收峰。润楠叶片多糖扫描电镜图呈现出分裂的块状结构,可能是酶解引起多糖聚集体结构发生改变,分裂成不规则的块状或小颗粒碎片等[24]。机体代谢过程中会产生具有破坏性作用的自由基,清除机体内过量自由基,有助于维持机体氧化应激水平和代谢的平衡有序。润楠叶片多糖在羟基自由基清除方面效果显著,并且在0.2、0.4、0.6 mg/mL时,清除率均高于Vc,说明其具有良好的抗氧化活性,可为今后润楠叶片多糖的研究提供实验依据;润楠叶片多糖在低浓度时对HCCLM、A549细胞抑制作用不显著,在高浓度20 mg/mL时才表现出对HCCLM、A549细胞的显著抑制效果,表明其具有一定的抗肿瘤活性。润楠叶片多糖具有一定的生物活性,可能与酶解破坏叶片细胞壁结构使得多糖充分溶出,有一定关系。魏晴等[25]采用超声波辅助法提取大果木姜子多糖,体外抗氧化实验表明其具有一定的抗氧化能力。也有文献显示多糖的生物活性与多糖的纯度及其单糖组成和含量有关[26-27]。该文对润楠叶片多糖的提取工艺、结构表征和生物活性进行了初步探究,可为进一步开发润楠叶片的利用价值提供理论参考和数据支撑。有关润楠叶片多糖纯化后结构是否发生改变、生物活性是否提高有待于后续研究。
