基于网络药理学探讨长春新碱治疗乳腺癌的作用机制
2024-01-16刘远亭韩淑萍杨证玉何俊超张燕琴
刘远亭,韩淑萍,刘 沙,杨证玉,何俊超,张燕琴*
(1.成都医学院 药学院,四川 成都 610500;2.中国人民解放军空军第986医院,陕西 西安 710054)
目前,乳腺癌不仅是最常见的恶性肿瘤之一,也是引起女性死亡的第二大癌症[1-2],严重威胁女性的身心健康,给家庭和社会带来沉重的经济负担。据我国流行病学资料显示:我国的女性恶性肿瘤中,乳腺癌早期患者的生存率显著高于晚期患者[3],乳腺癌早期症状不明显,确诊后多数患者已处于疾病晚期[3-4]。因此治疗乳腺癌的核心是早诊断和早治疗。研究表明从双子叶纲、龙胆目、夹竹桃科长春花中提取的双吲哚型生物碱──长春新碱[5](图1),为应用最广的天然植物抗癌药物,具有治疗乳腺癌、恶性淋巴瘤和小细胞肺癌等疾病的作用[6]。乳腺癌发病机制繁琐且复杂。本研究以乳腺癌为研究对象,基于网络药理学方法,选用生物信息学结合蛋白互作网络拓扑分析手段,预测长春新碱治疗乳腺癌的关键作用靶点,研究其可能的作用机制,为长春新碱治疗乳腺癌提供理论基础。研究流程见图2。
图1 长春新碱结构

图2 长春新碱治疗乳腺癌作用机制的研究流程
1 仪器与材料
1.1 仪器
电泳仪(美国BIO RAD);凝胶成像仪(美国BIO RAD);酶标仪(中国成都锦世昌祥科技有限公司);生物安全柜(美国Thermo Fisher Scientific);细胞培养箱(美国Thermo Fisher Scientific);台式冷冻离心机(德国Eppendorf);移液器(德国Eppendorf)。
1.2 细胞和试药
MCF-7乳腺癌细胞(中国科学院上海细胞库);长春新碱(成都艺萌科技有限公司)。
1.3 软件
Image JV1.8.0(正式版)软件;Grapd Prism 8.3。
2 方法
2.1 长春新碱相应靶点基因的收集与整理
查询药物长春新碱英文名称,登录pubchem服务器(https://pubchem.ncbi.nlm.nih.gov/),查询并下载药物的2D分子结构式(图1),并储存为“.sdf”格式,然后将sdf文件上传至SwissTargetPrediction数据库(http://swisstargetprediction.ch/)进行分子与靶蛋白对接。利用uniport数据库(http://www.lilab-ecust.cn/pharmmapper/)将uniport ID转化成Gene symbol,收集并整理长春新碱所有的靶点基因,删除重复值。上传靶点基因于STRING 11.0网站,将系统参数设置为最低相互作用评分>0.4[7],去除无关联靶点且选择物种为人,获得蛋白-蛋白相互作用网络(PPI)图,并导出靶点蛋白互作关系表。
2.2 长春新碱-蛋白靶点互作网络图的绘制
利用网络图像化软件Cytoscape 3.7.2绘制长春新碱-蛋白靶点互作网络图[8]。其中长春新碱与靶蛋白用“节点”表示,而长春新碱与靶点之间的关系、靶点与靶点之间的关系用“边”表示。
2.3 乳腺癌已知靶点的检索及疾病蛋白PPI的绘制
本研究对乳腺癌靶点的检索采用的是疾病数据库──OMIM数据库,查询到疾病乳腺癌的准确英文名称为“Breast Carcinoma”,并将其作为关键词进行检索,以获得疾病靶点,去重后保留剩余靶点。将靶点蛋白上传于STRING 11.0网站[7],设置最低相互作用评分>0.4,去除无关联靶点且选择物种为人,得到PPI图,导出靶点蛋白互作关系表。
2.4 药物-疾病蛋白互作网络图的绘制和药物-疾病关键靶点筛选
药物-疾病蛋白互作网络图的绘制主要采用Cytoscape软件中的BisoGenet插件,将1.1项下获得的长春新碱作用靶点和1.3项下获得的乳腺癌已知靶点在BisoGenet插件中分别绘制出各自的PPI图,并合并二者PPI图,获得长春新碱-乳腺癌的交集网络。利用网络拓扑分析插件CytoNCA筛选出长春新碱-乳腺癌交集网络中网络靶标(Degree)大于中位数2倍的节点[9],得到交集网络中的关键节点,再通过筛选以下几个指标如中介中心性(Betweenness),接近中心性(Closeness),特征向量(Eigenvector),网络(Network)及局部边连通性(Local average connectivity,LAC),最终得到其关键基因[10]。获得的关键基因可能解释长春新碱治疗乳腺癌的直接或间接作用机制。
2.5 关键基因靶点网络的构建
利用STRING 11.0网络平台,将2.4项下筛选的关键靶点蛋白进行PPI图的构建,设置最低相互作用评分>0.4,去除无关联靶点且选择物种为人,得到靶点蛋白互作关系,运用 Cytoscape 3.7.2 软件进行绘图和分析,网络靶标(Degree)大小可通过设置节点的颜色和大小来反映,连接评分(Combine score)的大小可通过设置边的颜色和大小来反映,获得最终的PPI图,合理布局并调整获得的PPI图像。
2.6 功能富集分析和通路富集分析
利用软件Cytoscape中的ClueGO分析插件[11],将2.4项下筛选的关键靶点蛋白分别进行功能富集及通路富集分析,并根据其重要程度绘制出占比饼状图和簇状条形图;其中富集分析的结果可通过节点的形式在ClueGO插件中展现,充分发挥其图像化功能。同时采用同一种颜色的节点来表示同一类型的功能蛋白,而基因功能的显著性通过节点大小来体现,若该基因功能上的节点越大,表明基因功能的显著性越高,重要性也越强。
2.7 细胞培养及Western blot分析
冻存的MCF-7细胞37 ℃水浴解冻。细胞1000 r/min离心5 min后培养于含10 %小牛血清和1 %双抗的高糖培养基中,并置于37 ℃、5 % CO2培养箱中培养,每2 d换液一次,细胞密度达80 %左右开展实验。采用不同浓度(50,100,200 nmol/L)的长春新碱处理细胞[12],给药1 d后提取细胞蛋白,常规SDS-聚丙烯酰胺凝胶电泳、转膜,一抗4 ℃过夜,二抗室温孵育2 h后使用凝胶成像仪检测灰度值,并利用Image JV1.8.0(正式版)软件统计分析长春新碱对核仁磷酸蛋白1(nucleophosmin-1,NPM1),DHX9,真核翻译延伸因子 1(EEF1A)及HSP90表达的影响。
2.8 统计分析
用Grapd Prism 8.3软件统计数据并做柱状图。组间比较采用单因素方差分析。P<0.05表明具有统计学意义。
3 结果
3.1 长春新碱的靶点
通过SwissTargetPrediction数据库获得107个与长春新碱相关的预测靶点,见图3,其中G蛋白偶联受体(Family A G protein-coupled receptor)、蛋白酶(protease)、细胞色素P450(Cytochrome P450)等占比较大。
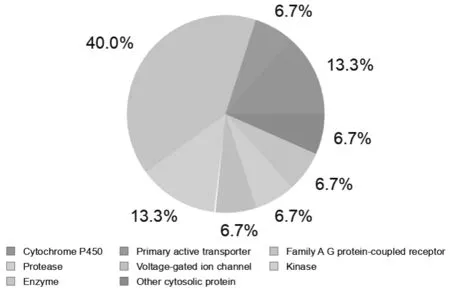
图3 目标蛋白概率图
3.2 长春新碱-蛋白靶点-蛋白靶点互作网络图的绘制和分析
结果见图4。由图4可见,互作网络图共存在108个节点和801个关系。通过对应关系的数目和复杂程度,体现了长春新碱具有多靶点属性,且蛋白靶点之间相关性较高。
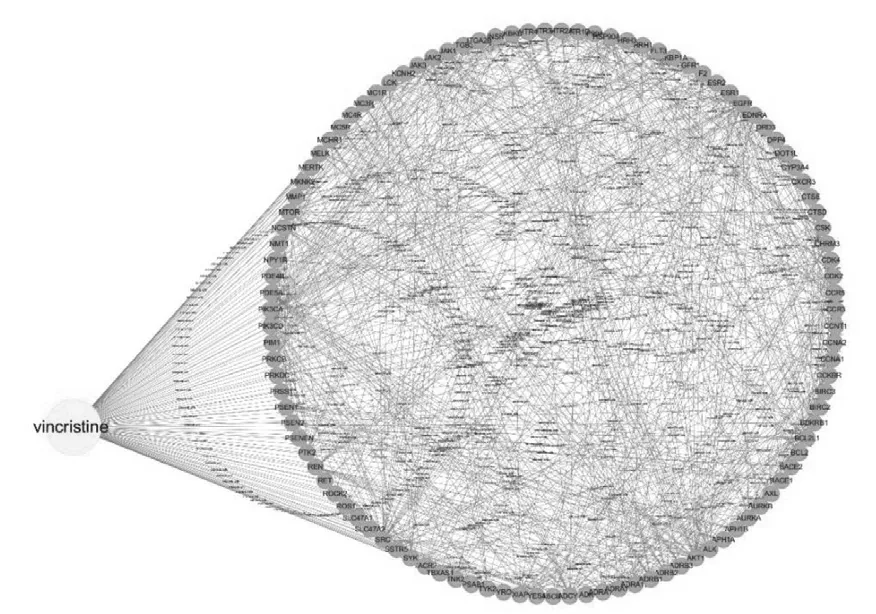
图4 长春新碱-蛋白靶点互作网络图
3.3 乳腺癌相关基因分析和检索
结果见图5。由如图5可见,使用疾病基因数据库──OMIM最终得到506个相关靶点,表明疾病的靶点蛋白之间具有高度相关性。

图5 乳腺癌的靶点蛋白互作关系网络图
3.4 药物-疾病蛋白互作网络图的绘制及关键靶点的筛选
3.4.1 长春新碱治疗乳腺癌的蛋白互作网络图 长春新碱的靶点蛋白互作网络中有4067个靶点与长春新碱存在直接或间接作用,靶点与靶点之间存在115 447种联系。乳腺癌的靶点蛋白互作网络图表明有5619个靶点与乳腺癌存在直接或间接作用,靶点与靶点的相互关系达141 283种。重合二者以上的网络图取交集网络,获得药物-疾病蛋白互作网络图6。如图6所示,共得到3274个节点和86 930种关系。

图6 长春新碱-乳腺癌蛋白靶点互作交集网络图
3.4.2 长春新碱-乳腺癌关键靶点的筛选 结果见图7。由图7可见,采用Cytoscape中的分析插件CytoNCA筛选出Degree大于中位数2倍的节点,即Degree>66,获得814个节点和34 869条边的黄色图,再通过筛选以下几个指标大于中位数的节点,即Betweenness>345.76,Closeness>0.518,Degree>107,Eigenvector>0.023,Network>20.158,LAC>18.497,获得262个节点和10 088条边的红色图,再继续筛选大于中位数的节点,即Betweenness>989.16,Closeness>0.541,Degree>174,Eigenvector>0.047,Network>29.726,LAC>39.159,获得70个节点和1246条边的最终关键靶点互作图。
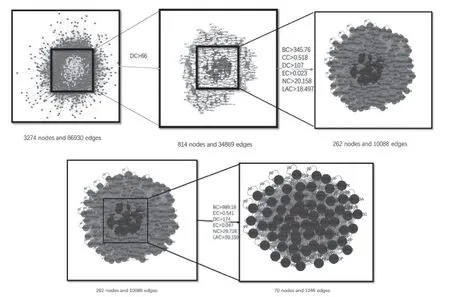
图7 关键靶点筛选图
3.5 长春新碱-乳腺癌关键蛋白互作网络图的绘制与分析
将以上筛选的70个关键基因导入STRING 11.0网络平台,分析后获得关键基因互作网络图,见图8。如图8所示,关键蛋白利用节点表示,蛋白之间的关联采用边表示,其靶点蛋白Degree的值利用节点大小表示,节点越大表明该靶点蛋白的Degree值越大,体现该节点在网络中的重要性越高。靶点蛋白之间的连接评分(combine score)值大小用边的粗细反映,边越粗表明靶点蛋白之间combine score值越大,蛋白间的直接相关性也越强。该网络图共表达网络节点数70个,表明有70个关键靶点蛋白,靶点蛋白之间的相互联系达525种,且关键靶蛋白之间有强烈的相关性。关键靶点基因及蛋白见表1。
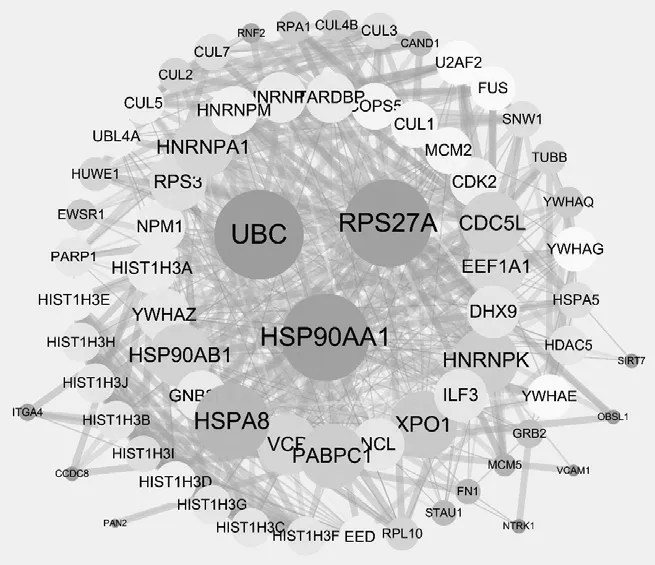
图8 关键基因互作网络图
3.6 药物-疾病关键靶点富集分析
3.6.1 功能富集分析 对以上70个靶点蛋白进行功能富集分析,结果见图9、图10。由图9、图10可见,生物过程中富集较为集中的为:白介素7(IL-7)介导的信号通路、mRNA稳定性的调控、蛋白质-DNA复合物、蛋白质定位于线粒体的正向调控等;分子功能富集较为集中的为:泛素蛋白连接酶、细胞对淀粉样蛋白的反应等,而对于细胞组分无关键特征功能。
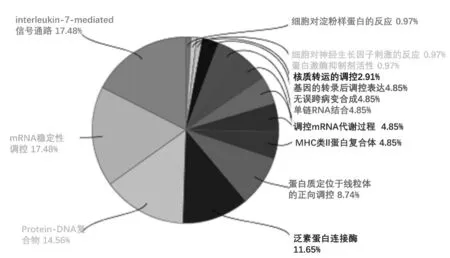
图9 GO富集分析图
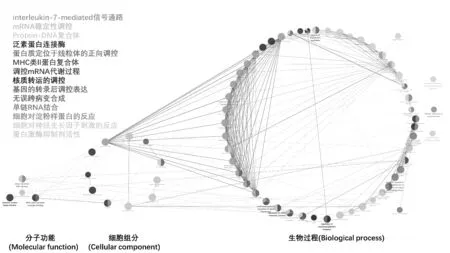
图10 Cluego-GO富集网络图
3.6.2 通路富集分析 利用Cytoscape中的ClueGO 插件将70个关键靶点进行通路富集分析。其中P<0.05的生物通路共有13条,通路富集分析的结果在ClueGO插件中以节点的形式展现,节点大小显示信号通路的显著性,节点越大,该通路的重要性越高,见图11、图12。由图11、图12可见,长春新碱治疗乳腺癌的机制主要与癌症转录失调,细胞周期,抗原处理和递呈,军团菌病,泛素介导的蛋白水解作用,剪切体,DNA复制等信号通路有关,表明长春新碱具有作用途径广的特点。

图11 KEGG富集分析图
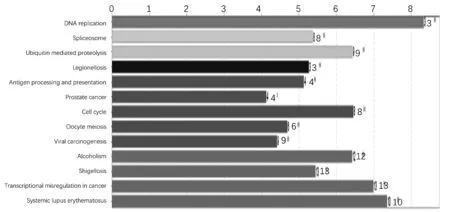
图12 ClueGO-KEGG富集簇状图
3.7 长春新碱下调NPM1,DHX9,EEF1A及HSP90蛋白表达
结果见图13。由图13 可见,与正常组比较,用200 nmol/L浓度的长春新碱处理细胞后,NMP1,DHX9,EEF1A及HSP90蛋白表达均下调(P<0.05),100 nmol/L浓度长春新碱处理组仅NMP1及DHX9蛋白表达下调(P<0.05),50 nmol/L长春新碱处理细胞后NMP1,DHX9,EEF1A及HSP90蛋白表达无明显变化(P>0.05)。
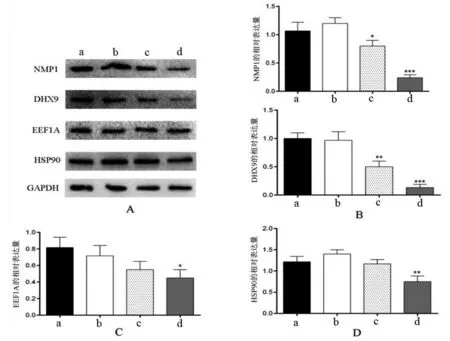
图13 长春新碱对乳腺癌细胞MCF-7中NPM1,DHX9,EEF1A及HSP90蛋白表达的影响
4 讨论
长春新碱通过干扰细胞微管蛋白代谢达到抗肿瘤作用。研究显示,乳腺癌的增殖分化过程与多种因素相关,包括基因突变、基因表达及蛋白丰度的变化[12-14]。乳腺癌发病机制繁琐且复杂,对其系统性的分析不足。长春新碱虽已报道可用于乳腺癌的治疗,但针对长春新碱治疗乳腺癌的具体靶点研究较少。因此本研究以长春新碱和乳腺癌为研究对象,基于网络药理学方法,预测长春新碱治疗乳腺癌的关键作用靶点。
首先针对长春新碱绘制长春新碱-蛋白靶点的互作网络图及蛋白与蛋白之间的互作网络图,共获得108个相关靶点与801个互作关系。以上结果表明,长春新碱具有多靶点效应且靶点之间存在协同互作关系,对于乳腺癌的病理进程可能发挥着不同作用,合并网络图后证明长春新碱确实具有治疗乳腺癌的潜力。
其次从功能富集结果分析可知,IL-7在结果中占比较高。IL-7主要由树突状细胞、小肠上皮细胞、巨噬细胞、胸腺细胞和皮肤角化细胞等分泌[15-18],参与机体多种生理及病理反应,维持着机体正常的免疫功能。IL-7可引起恶性肿瘤的发生和增殖,通过wortmannin敏感径路引起乳腺癌细胞的生长繁殖[19]。故通过调控IL-7介导的信号通路可抑制乳腺癌的生命活动。mRNA也在结果中占据较高比例,可通过调控乳腺癌细胞的mRNA转录,转运及翻译等过程,参与到肿瘤的病理进程中,从而影响乳腺癌细胞中的蛋白质合成[20]。组织相容性复合物II(major histocompatibility complex class II,MHC II)类分子的主要作用是协调免疫细胞间的关系,长春新碱可调控细胞内的MHC II类分子,从而调节机体免疫功能以增强对乳腺癌的免疫效应[21]。
且从通路富集结果分析可知,首先影响乳腺癌生命活动的信号通路为细胞转录调控失调通路,此过程导致细胞转录发生时间无法控制,引起癌细胞的基因表达发生异常。长春新碱主要通过作用在转录失调的靶点,以缓解异常基因的表达,从而影响乳腺癌异常的生命活动[22]。其次是癌细胞细胞周期的失控,细胞增殖失控是恶性肿瘤最重要的特征之一[23],维持细胞周期的正常次序及内环境的稳定可防止恶性肿瘤形成[24]。再者乳腺癌易发生肺、骨和脑转移[25-26],且恶性肿瘤更易借助淋巴系统发生转移[27],故可通过增强抗原递呈细胞的调控来加快乳腺癌细胞的灭活。泛素化介导的蛋白质降解对癌细胞的生长进程调控也具有重要影响,泛素介导蛋白质降解中的去泛素化生理过程,对癌症治疗有一定积极作用[28-29]。去泛素化是通过多步反应后将泛素小分子从目的蛋白上剥离,可通过去泛素化来抑制降解目标蛋白质,从而影响乳腺癌的发生和进展[30]。剪切体虽不会翻译出任何蛋白,但其特异性表达的可变剪接产物,可通过参与乳腺癌的发生、激活侵袭和转移等生理进程,对乳腺癌的发生和发展产生积极作用[31-32]。
长春新碱也具有通过调控DNA复制来影响乳腺癌细胞增殖和分化的作用。为进一步探讨长春新碱治疗乳腺癌的作用机制,采用不同浓度的长春新碱处理MCF-7后,检测MCF-7中NPM1,DHX9,EEF1A及HSP90蛋白表达,均下调。NPM是一类穿梭于核仁、核质和胞质的细胞磷酸化蛋白,参与核糖体的合成、染色体的复制及细胞内信号转导等,与细胞的生长、增殖密切相关,且与乳腺癌的发生有重要关系[33]。DHX9参与了多个细胞进程,调节细胞不同阶段的基因表达,提高DNA复制的保真性和效率,以此维持基因的稳定[34-35],因此DHX9蛋白功能异常可能导致疾病、肿瘤的发生。乳腺癌1号基因 (breast cancer 1,BRCA1)可抑制乳腺癌的发生,研究发现DHX9可与BRCA1结合,当DHX9过表达时,内源性BRCA1的正常功能被抑制,从而导致乳腺癌的发生[36],相同的,DHX9也能与乳腺癌缺失基因1(deleted in breast cancer-1,DBC1)相结合,该基因可调节细胞周期,与DHX9结合后,表达降低[37],促进肿瘤发生。EEF1A与翻译机制密切相关,且在乳腺癌等多种肿瘤中显著上调,并促进肿瘤细胞的增殖、迁移和侵袭[38-39]。HSP90参与癌症信号的传导,且具有抑制细胞凋亡、调控细胞分裂和促进血管生成等作用,在肿瘤的发生发展中起着重要作用[40]。研究发现,对比健康人群,乳腺癌患者血浆中的HSP-90α高表达[41]。实验结果显示,长春新碱处理MCF-7后NPM1,DHX9,EEF1A及HSP90蛋白表达显著下调,提示长春新碱可能通过调节这几个蛋白质的表达产生对乳腺癌的抑制生长或促进凋亡作用。
综上,乳腺癌细胞的代谢方式和途径存在相互作用和相互联系,长春新碱可通过影响乳腺癌细胞的生物过程,包括IL-7介导的信号通路、mRNA稳定性、蛋白质-DNA复合体等,也能作用于分子功能如蛋白质泛素化、细胞对淀粉样蛋白的反应等,且通过对癌症转录失调,细胞周期,抗原处理和递呈,军团菌病,泛素介导蛋白水解,剪切体,DNA复制等相关通路的调控影响癌细胞生命活动。故此在治疗乳腺癌上应针对疾病病因、机体内环境、代谢方式等,进行多方位、多靶点、多通路干预。采用网络药理学方法并结合生物信息学技术,为后续进一步的机制探讨奠定了重要的理论基础,使实验研究更加具备合理性。
