流池法测定缬沙坦片溶出度的方法学研究
2024-01-16甘加明严全鸿
甘加明,黄 丹,严全鸿
(广东省药品检验所,国家药品监督管理局药品快速检验技术重点实验室,广东 广州 510663)
缬沙坦(valsartan,VAL),化学名称为N-戊酰基-N-[[2’-(1H-四氮唑-5-基)联苯-4-基]甲基]-L-缬氨酸,属于第二代血管紧张素II受体抑制剂抗高血压类药物,它选择性地作用于1型受体,阻断血管紧张素II与1型受体的结合,从而抑制血管收缩和醛固酮的释放,产生降压作用。有文献报道[1-3],缬沙坦能有效治疗轻、中度原发性高血压,并能改善患者的胰岛素抵抗,并且不作用于血管紧张素转换酶(ACE)、肾素和其他受体,不抑制与血压调节和钠平衡有关的离子通道,不良反应少。缬沙坦属于BCS II类(低溶解高渗透)药物[4],在水中几乎不溶,为pH依赖型药物,随pH值上升,溶解度增加[5]。药物自身溶解度和药物从制剂内释放的速率决定了药物的溶出度,直接影响制剂的质量和疗效[6-7]。体外溶出试验是评价口服固体制剂内在质量的一种重要手段,也是口服固体制剂开发和质量控制中的重要方法。《中国药典》2020年版四部通则新增流池法(flow-through cell method,FTC)[8]作为溶出度与释放度测定的第六法。FTC不仅适用于片剂和胶囊剂等传统口服固体制剂的溶出度测定,还可用于粉末、栓剂、颗粒剂、混悬剂、微球等剂型及药物洗脱支架的溶出度测定。流池法可避免已有溶出度测定方法因吸附平衡导致的溶出困难及机械搅拌的弊端,尤其适用于难溶性药物的溶出研究,能更好地模拟体内生理环境,更具有区分力[9]。
《中国药典》2020年版中缬沙坦片质量标准经修订后的公示稿[10]、美国药典43版、日本药局方2018版和英国药典2022版缬沙坦片的溶出度检查均采用第二法(桨法),转速为每分钟50转,以pH 6.8磷酸盐缓冲液为溶出介质,在该溶出条件下15 min内缬沙坦片即达到全溶出。该溶出方法既不能精确地控制药物释放速率,也无法起到控制产品质量的作用。本文建立了一种具有合适区分力的体外溶出方法,该方法对缬沙坦片的处方优化和质量评价具有重要参考价值。
1 仪器与试药
1.1 仪器
SOTAX CE7 Offline流通池溶出度仪,包括SOTAX CE7主机、CY7-50活塞泵(瑞士Sotax公司);SHIMADZU高效液相色谱仪(紫外检测器,日本岛津公司);SOTAX AT 7X溶出度仪(瑞士Sotax公司);Mettler XS205电子分析天平(美国Mettler Toledo公司);Sartorius PB-10 pH计(德国Sartorius公司)。
1.2 试药
缬沙坦片(规格:80 mg;来源:A公司,批号:12100;B公司,批号:20200502);缬沙坦对照品(中国食品药品检定研究院,批号:100651-202006,含量: 99.0 %);盐酸,磷酸二氢钾,冰醋酸,氢氧化钠,乙酸钠均为分析纯,乙腈为色谱纯。
2 方法与结果
2.1 色谱条件
色谱柱:SHISEIDO SPOLAR C18柱(150 mm×4.6 mm,5 μm),以乙腈-水-冰醋酸(500:500:1)为流动相,检测波长为230 nm,柱温为30 ℃,流速为1.0 ml/min,进样量为10 μl。
2.2 方法学验证
2.2.1 溶液制备
2.2.1.1 对照品溶液 取缬沙坦对照品约10 mg,精密称定,置入50 ml量瓶,加pH 6.8磷酸盐缓冲液溶解并稀释至刻度,摇匀,精密量取4 ml,置入10 ml量瓶,用pH 6.8磷酸盐缓冲液稀释至刻度,即得。
2.2.1.2 供试品溶液 取供试品粉末适量(相当于缬沙坦约10 mg),精密称定,置入25 ml量瓶并加入pH 6.8磷酸盐缓冲液10 ml,超声使溶解,并稀释至刻度,摇匀,滤过;精密量取续滤液2 ml,置入10 ml量瓶,加pH 6.8磷酸盐缓冲液稀释至刻度,摇匀,即得。
2.2.1.3 空白辅料溶液 按处方取不含缬沙坦的空白辅料约10 mg,置25 ml量瓶中,加pH 6.8磷酸盐缓冲液10 ml超声,稀释至刻度,摇匀,精密量取续滤液2 ml,置10 ml量瓶中,加pH 6.8磷酸盐缓冲液稀释至刻度,摇匀,即得。
2.2.2 专属性试验 分别取空白辅料溶液、供试品溶液和对照品溶液,按2.1项下色谱条件注入高效液相色谱仪,记录色谱图,结果见图1。结果显示,空白辅料和溶出介质均不干扰缬沙坦的含量测定。
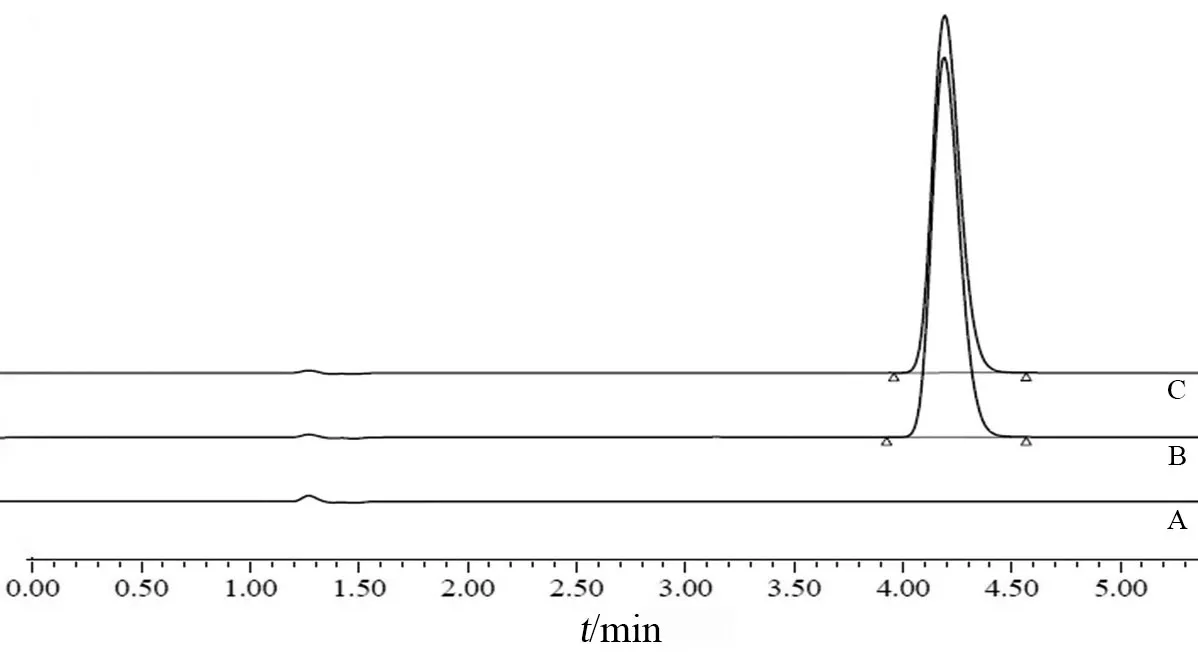
图1 专属性试验HPLC图谱
2.2.3 线性试验 取缬沙坦对照品约31.47 mg,精密称定,置入20 ml量瓶,加pH 6.8磷酸盐缓冲液5 ml,超声溶解并稀释至刻度,摇匀,作为对照品贮备液。分别取对照品贮备液适量,用pH 6.8磷酸盐缓冲液定量稀释制成约含缬沙坦0.8,3.9,7.8,15.7,62.9,125.9,629.4,786.7,1258.9 μg/ml的系列溶液,按 2.1项下色谱条件进样分析,记录色谱图。以峰面积(Y)对浓度(X,μg/ml)进行线性回归,结果表明缬沙坦在0.8~1258.9 μg/ml浓度范围内线性关系良好(r=0.999),线性回归方程为Y=16 454X+87 154。
2.2.4 加样回收试验 取处方量空白辅料9份,共分为3组,分别置25 ml量瓶中,每组分别加入缬沙坦对照品8,10,12 mg,加pH 6.8磷酸盐缓冲液溶解并稀释刻度,摇匀,滤过,精密量取2 ml,置10 ml量瓶中,用pH 6.8磷酸盐缓冲液稀释至刻度,摇匀,分别作为低、中、高浓度溶液。取低、中、高浓度溶液按 2.1项下色谱条件进样分析,记录色谱图。结果表明高、中、低3个浓度平均回收率为100.8 %(n=9),RSD=0.8 %,表明方法的准确度良好。
2.2.5 重复性试验 取样品(B 公司,批号:20200502)6份,按2.2.1.2项下方法制备供试品溶液,按2.1项下色谱条件进样分析,平均含量为99.4 %,RSD=0.6 %(n=6),表明方法重复性符合要求。
2.2.6 精密度试验 取对照品溶液,连续进样6次,缬沙坦峰面积RSD=0.1 %(n=6),表明仪器精密度良好。
2.2.7 稳定性试验 将供试品溶液于进样器内室温下放置,分别于0,2,4,6,8,10,12 h,按 2.1项下色谱条件进样分析,记录色谱图,缬沙坦峰面积RSD为0.1 % ,结果表明供试品溶液在12 h内稳定。
综上,拟定分析方法满足定量分析要求。
2.3 滤膜吸附试验
取供试品(B公司,批号:20200502),按2.2.1.2项下方法制备供试品溶液,5000 r/min离心5 min,取上清,按2.1项下色谱条件注入液相色谱仪,记录峰面积;另取供试品(B公司,批号:20200502),按2.2.1.2项下方法制备供试品溶液,先后经0.27 μm Whatman GF/D、0.7 μm GF/F玻璃纤维滤膜滤过,取续滤液,按2.1项下色谱条件注入液相色谱仪,记录峰面积。结果表明两种方式处理的供试品溶液色谱图中缬沙坦峰面积无显著差异,表明滤膜无吸附。结果见表1。
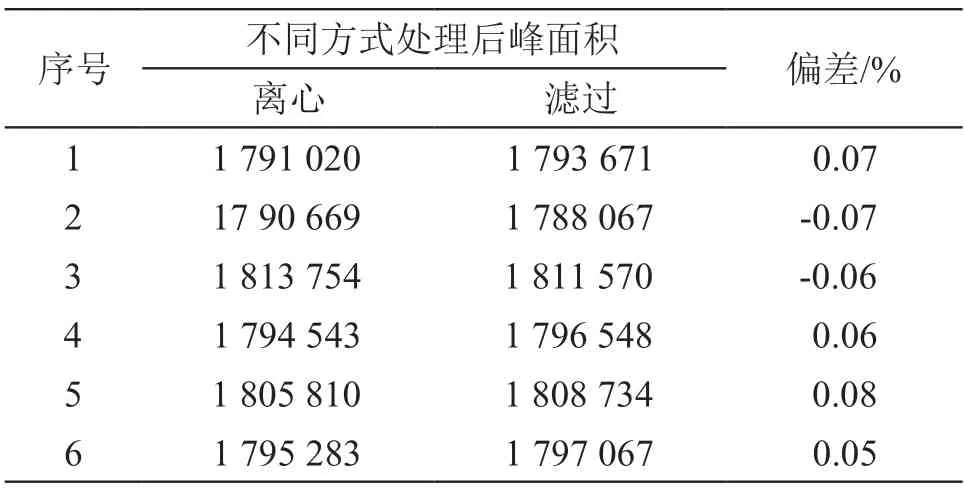
表1 滤膜吸附考察结果
2.4 溶出介质的选择
2.4.1 溶出介质的制备 pH 1.2盐酸溶液:取盐酸7.65 ml,加水稀释至1000 ml,摇匀,即得;pH 4.5醋酸钠缓冲液:取醋酸钠2.99 g与2 mol/L醋酸溶液14.0 ml,加水稀释至1000 ml,摇匀,即得;pH 6.8磷酸盐缓冲液:取0.2 mol/L磷酸二氢钾溶液250 ml与0.2 mol/L氢氧化钠溶液混合后,加水稀释1000 ml,摇匀,即得;水:纯化水。
2.4.2 溶出度测定 采用流池法开放系统,将缬沙坦片置于锥形部装满1 mm玻璃珠的直径22.6 mm流通池内,分别采用pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH6.8磷酸盐缓冲液、水为溶出介质,温度为 37±0.5 ℃,流速为4 ml/min,收集0~5、5~10、10~15、15~20、20~30、30~45、45~60、60~90 min时间段的溶出液(溶出液已在线通过0.7 μm、0.27 μm的玻璃纤维滤膜),取溶出液,按2.1项下色谱条件进行测定,按外标法以峰面积计算各时间点的累积溶出量,结果见图2。由图2可知,上述4种溶出介质中,缬沙坦片的溶出行为差异较大,溶出量随溶出介质pH值的升高而增加,为典型的pH依赖型药物;缬沙坦片在以pH 1.2盐酸溶液为溶出介质时90 min内的累积溶出量仅为2.6 %,溶出程度和溶出速率均最小,以水和pH 4.5醋酸盐缓冲液为溶出介质时,90 min内的累积溶出量分别为24.8 %,43.3 %,均未达溶出平台且累积溶出量均小于85 %,溶出程度和溶出速率均较小,而以pH 6.8磷酸盐缓冲液为溶出介质时,45 min时达到溶出平台且累积溶出量为97.9 %,随着溶出时间的延长,溶出速率先不断增大,后缓慢减小,溶出曲线无拐点。结合各国药典中缬沙坦片溶出度检查项均选用pH 6.8磷酸盐缓冲液为溶出介质,故本文选择pH 6.8磷酸盐缓冲液为溶出介质。
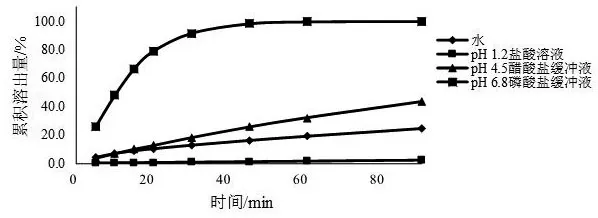
图2 不同溶出介质的溶出曲线(流速为4 ml/min)
2.5 流池法测定溶出度的影响因素
2.5.1 溶出介质的流速 一般情况下,溶出介质的流速对于药物的溶出速率的影响是比较明显的。《中国药典》2020年版四部0931溶出度与释放度测定法中流池法的标准流速为4,8,16 ml/min[8],本文以pH 6.8磷酸盐缓冲液为溶出介质,分别考察3种标准流速对缬沙坦片溶出曲线的影响。结果见图3。由图3可见,随着流速的提高,溶出速率也会随之提高,达到溶出平台时间减少,其中溶出介质流速为4 ml/min时溶出速率最低,达到溶出平台时间最长,溶出介质流速为16 ml/min时较流速为8 ml/min溶出速率略微提高。本文选取溶出介质的流速为4 ml/min进行实验。
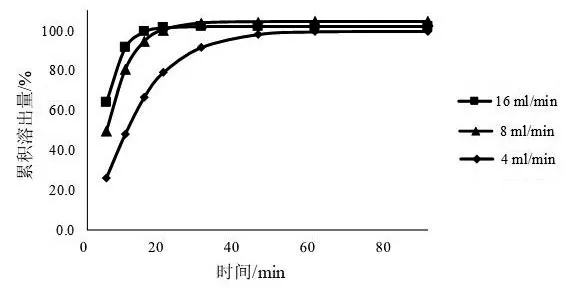
图3 不同流速下的溶出曲线(溶出介质为pH 6.8磷酸盐缓冲液)
2.5.2 流通池内径的影响 标准流通池的内径一般为12 mm和22.6 mm,在流池法试验中小规格制剂采用小型流通池可提高低浓度取样分析的灵敏度,且崩解后的颗粒会均匀地分布在表面[11]。本研究选用了两种内径的流通池,以pH 6.8缓冲液为溶出介质,流速为4 ml/min进行实验,以全面分析缬沙坦片的溶出情况,结果见图4。图4结果显示,在内径12 mm的流通池内,缬沙坦片的溶出速率较快,故本文采用内径为22.6 mm流通池进行后续研究。
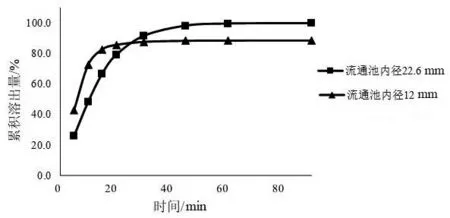
图4 不同内径的流通池溶出曲线
2.6 溶出度测定
分别采用新建立的流池法与《中国药典》2020年版缬沙坦片质量标准中溶出度检查法[12](桨法,转速50 r/min,溶出介质为pH 6.8磷酸盐缓冲液1000 ml,取样时间点为5,10,15,20,30,45,60 min)对两家公司的缬沙坦片的溶出度进行测定,计算累积溶出度,结果见表2。结果表明,缬沙坦片在桨法和流池法中溶出曲线有明显差异,桨法装置下,累积溶出量在15 min内均达85 %以上,且处于溶出平台;流池法测定的溶出曲线缓慢上升,且溶出曲线无拐点和突释,在45 min后处于溶出平台,累积溶出量达85 %以上。

表2 两家公司的缬沙坦片累积溶出量(桨法和流池法)
2.7 溶出曲线比较
2.7.1 非模型依赖的相似因子法比较 根据《普通口服固体制剂溶出曲线测定与比较指导原则》[13],当受试制剂与参比制剂在15 min内的累积溶出量不低于85 %,可认为两者溶出行为相似,故采用桨法测定A、B两家公司的缬沙坦片的溶出曲线相似;采用非模型依赖相似因子法对A、B两家公司的流池法测得得缬沙坦溶出曲线进行相似性评价,其相似因子f2值为69(选取前5个时间点的累积溶出量计算),非模型依赖相似因子f2值高于50 时,可认为两条曲线具有相似性,故两家公司的缬沙坦片溶出曲线相似。
2.7.2 模型依赖的参数比较 采用DDsolver软件中的零级、一级、Higuchi、Weibull和Peppas-Sahlin模型对数据进行拟合,结果零级、Higuchi和Peppas-Sahlin模型拟合效果不佳(r<0.99),Weibull和一级模型拟合效果较好,且 Weibull模型(r>0.998)拟合效果优于一级模型(r>0.991),故选定Weibull模型对流池法测定的溶出曲线数据进行拟合,得到特征溶出参数T50和Td(药物溶出50 %和63.2 %所需时间),结果见表3。采用SPSS17.0软件分别对两公司样品的T50和Td进行t检验,结果显示,两样品的溶出参数差异有统计学意义(P<0.05)。

表3 Weibull拟合特征溶出参数
3 讨论
3.1 检测方法的选择
国内外现行药典均使用UV法测定缬沙坦片的溶出度,且各国药典仅测定30 min时的溶出度,溶出液浓度范围变化小,而采用流池法测定缬沙坦片溶出度,其溶出液浓度变化范围大。故本文拟参考《中国药典》2020年缬沙坦片含量测定项下的色谱条件,根据实际测定情况,建立了缬沙坦片溶出度测定的HPLC法,该方法经方法验证,各项结果均满足要求。本方法操作简便,可用于缬沙坦片溶出度的测定。
3.2 溶出介质的选择
根据《普通口服固体制剂溶出曲线测定与比较指导原则》推荐的各种不同pH溶出介质,结合国内外现行药典选用的溶出介质,本文选用pH 6.8磷酸盐缓冲液作为溶出介质,与各国药典一致。
3.3 溶出介质流动方式
流池法的样品池中可加入玻璃珠,一般认为不加玻璃珠为湍流,加入玻璃珠为层流[14-16]。谢莉等[17]的研究指出仅以玻璃珠的加入与否来断定流体为层流或湍流是不全面的,但加入玻璃珠可降低流体的可变性。本文采用加入玻璃珠方式。
3.4 金属片夹(V字型)
一般情况下,样品自由放置或使用金属片夹(V字型)固定在玻璃床上部的一定位置上[18]。本文采用将样品自由放置在玻璃珠上。
4 小结
本文通过流池法测定缬沙坦片溶出曲线,分别采用非模型依赖的相似因子(f2)法和Weibull模型评价体外溶出曲线。缬沙坦片在溶出初始阶段溶出速率较快,即溶出量随时间快速增加,随后溶出速率逐渐减慢,并逐渐进入全溶阶段。流池法能提供较为温和的溶出环境,有助于药物研发阶段中的处方筛选、工艺优化和质量控制;能更好地模拟体内坏境,有助于评估药物的体内溶出和释放特性。
