麦角硫因抑制紫外辐射诱发自由基的试验研究
2024-01-16王丽丽康传利廉少杰陈建英
孙 赫,王丽丽,康传利,廉少杰,陈建英
(1.山东省药学科学院 山东省皮肤与黏膜给药工程技术研究中心,山东 济南 250101;2.山东省药学科学院 新型缓控释制剂与药物靶向递送系统山东省工程研究中心,山东 济南 250101;3.国家药监局药物制剂技术研究与评价重点实验室,山东 济南 250101;4.山东百阜福瑞达制药有限公司,山东 济宁 273100;5.山东福瑞达医药集团有限公司 山东省黏膜与皮肤给药技术重点实验室,山东 济南 250101)
1909年Charles Tanret从麦角菌(Claviceps purpurea)中分离出含硫晶体化合物,并命名为麦角硫因(ergothioneine,EGT)。EGT作为一种天然手性氨基酸衍生物,存在硫醇和硫酮两种互变异构形式,在人体内主要以硫酮形式存在[1]。与烷基硫醇谷胱甘肽(RSH)不同,这种咪唑硫酮结构在溶液中不会自氧化,也不会在铁盐和氢过氧化物存在下诱导芬顿反应[2]。研究表明EGT可抑制脂质过氧化损伤[3],清除羟自由基(·OH)[4]、超氧化物和单线态氧(1O2)等多种活性氧(ROS)物质,是优异的皮肤光敏保护剂[5-7]。人体内的EGT并不是由人体本身合成,而是由放线菌、分枝杆菌等微生物合成后,通过植物吸收和食物链传递至人体内积累而存在的。
皮肤衰老是机体衰老最直接的表现,除自然衰老等内部因素外,引起皮肤衰老的还有诸如自然环境、外伤、接触某些化学物质等外界因素,其中最重要的是日晒,即光老化。阳光中的紫外辐射照射到人体表皮细胞后可产生1O2、·OH等有害物质,诱发DNA、蛋白质和细胞组织的损伤,并表现为皮肤的衰老和损伤。本文通过紫外线照射光敏剂罗丹明B(RhB)溶液诱发包括1O2在内的自由基体系(下文简称UV-RhB体系)[8-10],模拟紫外线照射人体皮肤产生ROS的情况,研究EGT在此体系下的抗氧化性能及其稳定性,以期为EGT应用于抗衰护肤品的开发提供理论依据。
1 仪器与试药
1.1 仪器
Infinite M200PRO 酶标仪(Tecan);MS204TS/02 电子天平(Mettler Toledo);SCIENTZ 03-II 紫外交联仪(新芝生物科技股份有限公司)。
1.2 试药
EGT(化妆品级,批号:220308,山东百阜福瑞达制药有限公司);维生素C(药用级,东北制药集团股份有限公司);罗丹明B及其他试剂均为分析纯。
2 方法
2.1 UV-RhB体系中EGT和VC抗氧化性能的测定
以pH 7.2的磷酸盐缓冲液(PBS,取2.2 g Na2HPO4,0.3 g NaH2PO4和8.5 g NaCl,加水溶解至1000 ml)为溶剂,分别配制0.001 %罗丹明B溶液(RhB)、0~1.00 mg/ml的EGT溶液及维生素C(VC)溶液。按表1配制测定溶液体系I、II,置紫外光(波长254 nm,光强度5 mW/cm2)下照射。分别于0,1 h时,采用酶标仪,测定555 nm波长处吸收值(A0和A1),每个样品平行3份,计算0 h和1 h吸光度变化量的平均值(ΔA),以ΔA空白为基线,按下式计算体系中活性物质的抗氧化性能(F)。
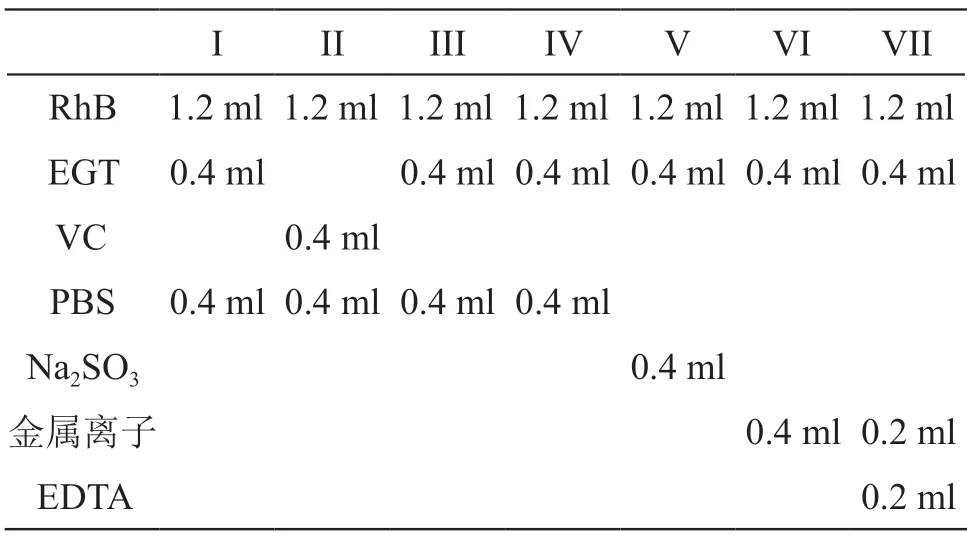
表1 抗氧化作用测定溶液体系
式中,ΔA空白:空白对照溶液的吸收值的变化量(A0空白-A1空白);ΔA样品:样品溶液的吸收值的变化量(A0样品-A1样品)。
2.2 离子强度对EGT抗氧化性能的影响
按表1配制测定溶液体系III,EGT溶液浓度为0.25 mg/ml,以EGT浓度为0的体系作为空白对照,分别加入NaCl浓度分别为0 %,0.40 %,0.85 %,1.30 %,1.75 %的PBS。按2.1项下方法平行测定3份,取其平均值,计算不同离子强度体系的ΔA和F值。
2.3 pH值对EGT抗氧化性能的影响
按表1配制测定溶液体系IV,EGT溶液浓度为0.25 mg/ml,以EGT浓度为0的体系作为空白对照,用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液分别调节PBS缓冲液pH值为3.0,5.0,7.2,9.0,11.0。按2.1项下方法平行测定3份,取其平均值,计算不同pH体系的ΔA和F值。
2.4 还原剂对EGT抗氧化性能的影响
按表1配制测定溶液体系V,EGT溶液浓度为0.25 mg/ml,并以EGT浓度为0的体系作为空白对照,Na2SO3溶液以PBS缓冲液为溶剂,浓度分别为0 %,0.02 %,0.05 %,0.10 %,0.25 %,0.50 %。按2.1项下方法平行测定3份,取其平均值,计算不同还原剂浓度体系的ΔA和F值。
2.5 金属离子对EGT抗氧化性能的影响
按表1配制测定溶液体系VI,其中溶剂为生理盐水,EGT溶液浓度为0.25 mg/ml,并以EGT浓度为0的体系作为空白对照。分别加入0.05 mol/L的K+、Mg2+、Zn2+、Cu2+、Fe3+生理盐水溶液。按2.1项下方法平行测定3份,取其平均值,计算不同金属离子体系的ΔA和F值。
2.6 EDTA对EGT抗氧化性能的影响
按表1配制测定溶液体系VII,其中溶剂为生理盐水,EGT溶液浓度为0.25 mg/ml,并以EGT浓度为0的体系作为空白对照。分别加入0.10 mol/L的Fe3+溶液和0 %,0.02 %,0.04 %,0.10 %,0.20 %的EDTA溶液。按2.1项下方法平行测定3份,取其平均值,计算不同EDTA浓度体系的ΔA和F值。
3 结果与分析
3.1 EGT和VC的抗氧化量效关系
不同浓度EGT和VC的抗氧化性能见图1。由图1可见,0~1 mg/ml范围内,EGT和VC的F值随浓度的升高而增大,且相同浓度下EGT的F值一直高于VC,表明EGT和VC抗氧化作用具有较好的量效关系,同时在此体系下EGT的抗氧化性能优于VC。
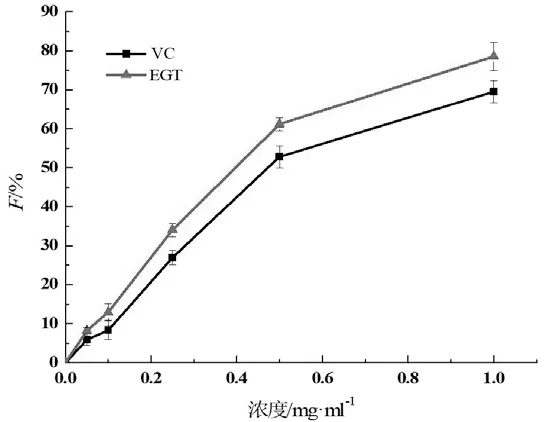
图1 不同浓度EGT和VC的抗氧化性能
3.2 离子强度对EGT抗氧化性能的影响
离子强度对EGT抗氧化性能的影响见图2。由图2可见,NaCl浓度在0 %~0.85 %范围内,EGT的F值较为稳定,当NaCl浓度高于0.85 %时,F值急剧下降,表明此时EGT抗氧化性能受到体系内高离子强度的抑制而显著降低。
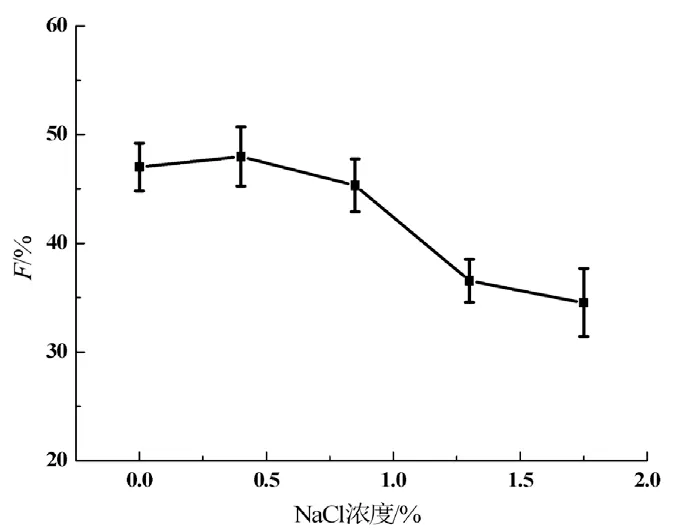
图2 离子强度对EGT抗氧化性能的影响
3.3 pH值对EGT抗氧化性能的影响
pH值对EGT抗氧化性能的影响见图3。由图3可见,在pH 5~9范围内EGT的F值变化相对较小,表明EGT抗氧化活性在pH 5~9范围内较为稳定。
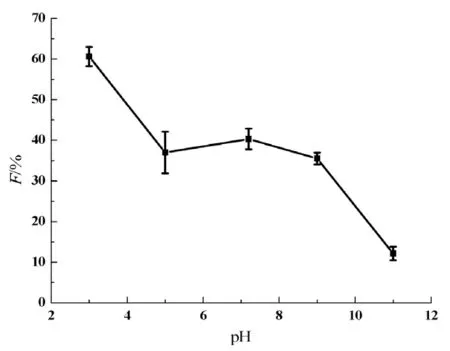
图3 pH值对EGT抗氧化能力的影响
3.4 还原剂对EGT抗氧化性能的影响
还原剂亚硫酸钠对EGT抗氧化性能的影响见图4。由图4可见,随着亚硫酸钠浓度的增大,F值呈下降趋势,表明在此体系中加入亚硫酸钠可抑制EGT的抗氧化活性。亚硫酸钠浓度大于0.1 %时,F值趋于稳定,表明其抑制作用趋于平缓。
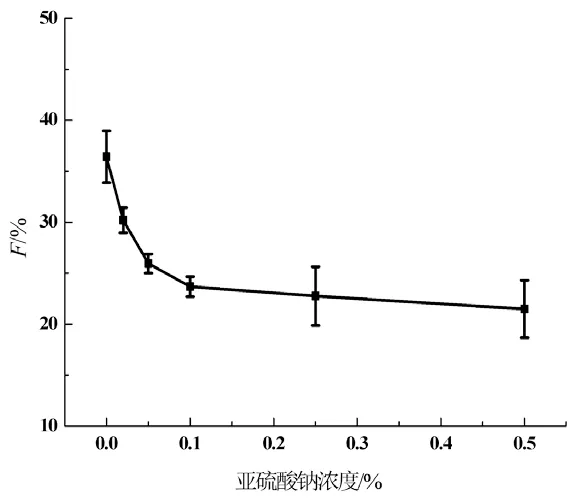
图4 亚硫酸钠对EGT抗氧化性能的影响
3.5 金属离子对EGT抗氧化性能的影响
不同金属离子对UV-RhB体系的影响见图5A。结果显示,与Na+体系相比,K+、Mg2+、Zn2+体系中ΔA空白变化较小,表明加入这3种离子对体系内RhB的降解速率影响较小;Cu2+对RhB的降解速率有较明显的抑制,而加入Fe3+后,体系中RhB降解速率显著提高,分析原因为Fe3+在水中形成Fe(OH)2+,经光照射生成Fe2+和羟自由基[11-13],增大了体系内自由基的浓度,进一步加剧了RhB的降解。

图5 不同金属离子对UV-RhB体系及EGT抗氧化性能的影响
不同金属离子对EGT抗氧化性能的影响见图5B。结果显示,与Na+体系相比,Zn2+对EGT抗氧化性能没有明显影响,K+、Mg2+对EGT的抗氧化作用有一定程度的抑制,Cu2+在抑制RhB降解的同时对EGT的抗氧化性能也有较为明显的抑制作用。而在体系中加入Fe3+,RhB降解速率提高的同时,EGT的抗氧化性能也得到了明显的提升,这也表明EGT可有效抑制Fe3+诱发的氧化应激反应。
3.6 EDTA对EGT抗氧化性能的影响
EDTA对EGT抗氧化性能的影响见图6。由图6可见,在添加Fe3+的体系中,EGT抗氧化性能随EDTA的浓度增加而减小,分析原因为EDTA与Fe3+形成金属络合物后降低了体系内Fe3+的浓度,削弱了Fe3+对UV-RhB体系和EGT抗氧化性能的影响。
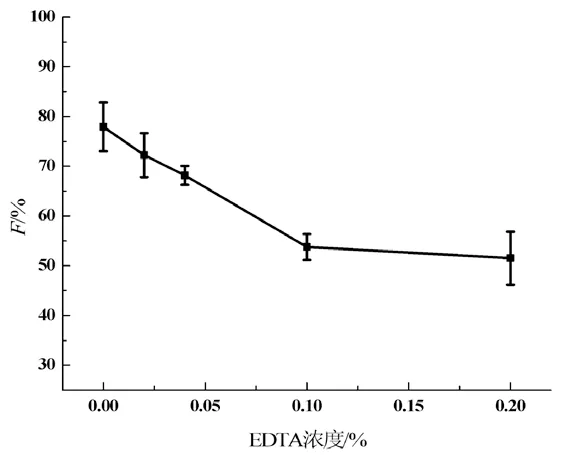
图6 EDTA对EGT抗氧化性能的影响
4 结论
光老化、氧化自由基和皮肤糖化被认为是皮肤衰老的直接原因。其中,紫外照射皮肤后能产生1O2、脂质自由基、脂质过氧化物(LPO)等物质,降低皮肤细胞抗氧化防御能力,导致胶原蛋白酶和弹性蛋白酶的释放,并破坏两种蛋白质和结缔组织,造成皮肤衰老、损伤等多种问题。本文通过建立紫外辐射光敏剂诱发自由基体系,测定抗氧化活性物质的抗氧化性能。在此体系下EGT表现出优异的抗氧化性能,且在低离子强度和pH 5~9范围内具有良好的稳定性。
