基于证据推理思维培养的高中化学一体化实验改进
——以氮氧化物的转化为例
2024-01-15杜鹏程赵丽娜
杜鹏程 赵丽娜
吉林师范大学化学学院(136000)
1 问题的提出
化学是一门以实验为基础的科学,化学实验是连接学生对于化学方程式等符号表征与宏观现象的桥梁,对培养学生的核心素养至关重要。《普通高中化学课程标准(2017年版2020年修订)》指出,学生应能根据各类物质及其反应的不同特征寻找充分的证据,并能解释证据与结论之间的关系,并且将证据推理作为思维核心。然而,在实验教学过程中,教师仅“演示”实验现象,缺少引导学生探究实验现象与证据之间的关系,不利于学生证据推理思维的发展。以氮及其氧化物为例,在人教版高中化学必修2中,氮氧化物的制备和性质检验实验缺少完整的通路且可视化程度不高。教材实验缺少从一氧化氮制备到二氧化氮溶于水生成硝酸的完整转化过程。在其他学者的改进中,如姚亮发等老师的铜与稀硝酸反应实验的新设计[1]、陈方等老师的NOx溶于水实验装置的实验改进[2]虽各有所长,但还是存在实验现象单一,缺少完整的产物检验流程等缺陷。因此,本文从证据推理以及实验现象可视化角度设计改进。
2 实验改进目的
本文通过改进NO制取与NO2性质检验实验装置,整合稀硝酸与铜、一氧化氮与氧气,二氧化氮与水、硝酸与甲基橙多个反应,实现一体化,基于证据推理推进实验教学,有利于学生深入理解氮氧化物的转化,培养学生的证据推理思维。该实验易于演示,使用“U型管”装置使实验现象多变且趣味性强。
证据推理中证据的呈现与三重表征相结合,分为宏观证据、微观证据、符号证据[3]。课标中将证据推理的水平分为4个维度。经分析,本实验能够培养学生的证据推理思维的水平1,即“宏观”证据。学生能从物质及其变化的事实中提取证据,对化学问题提出假设,并依据证据证明或证伪假设。在本实验过程中,教师引导学生预测现象,并通过实验现象的变化激发学生的证据意识,引导学生探究产生现象的原因,并解释证据和结论之间的关系。例如,无色气体、红棕色气体、U型形管水柱高度变化、甲基橙指示剂变色等客观事实。在这个基础上,学生能充分地了解氮氧化物的性质以及转化过程。
3 实验部分
3.1 实验药品和器材
实验药品:铜片、稀硝酸(3 mol/L)、甲基橙、氢氧化钠溶液、高锰酸钾溶液。
实验器材:具支试管、橡胶管、集气瓶、玻璃管、U型形管、烧杯、玻璃两通活塞(可用弹簧夹代替)。
3.2 实验原理
本实验通过铜片与稀硝酸生成一氧化氮。生成的一氧化氮与具支试管以及集气瓶中的氧气反应,生成红棕色的二氧化氮气体。由于二氧化氮易溶于水生成硝酸,二氧化氮溶于水后U型形管内压力改变,左右两侧产生高度差,生成的硝酸能使U型形管内甲基橙变红。
3.3 实验装置
实验装置如图1所示(省略夹持装置)。
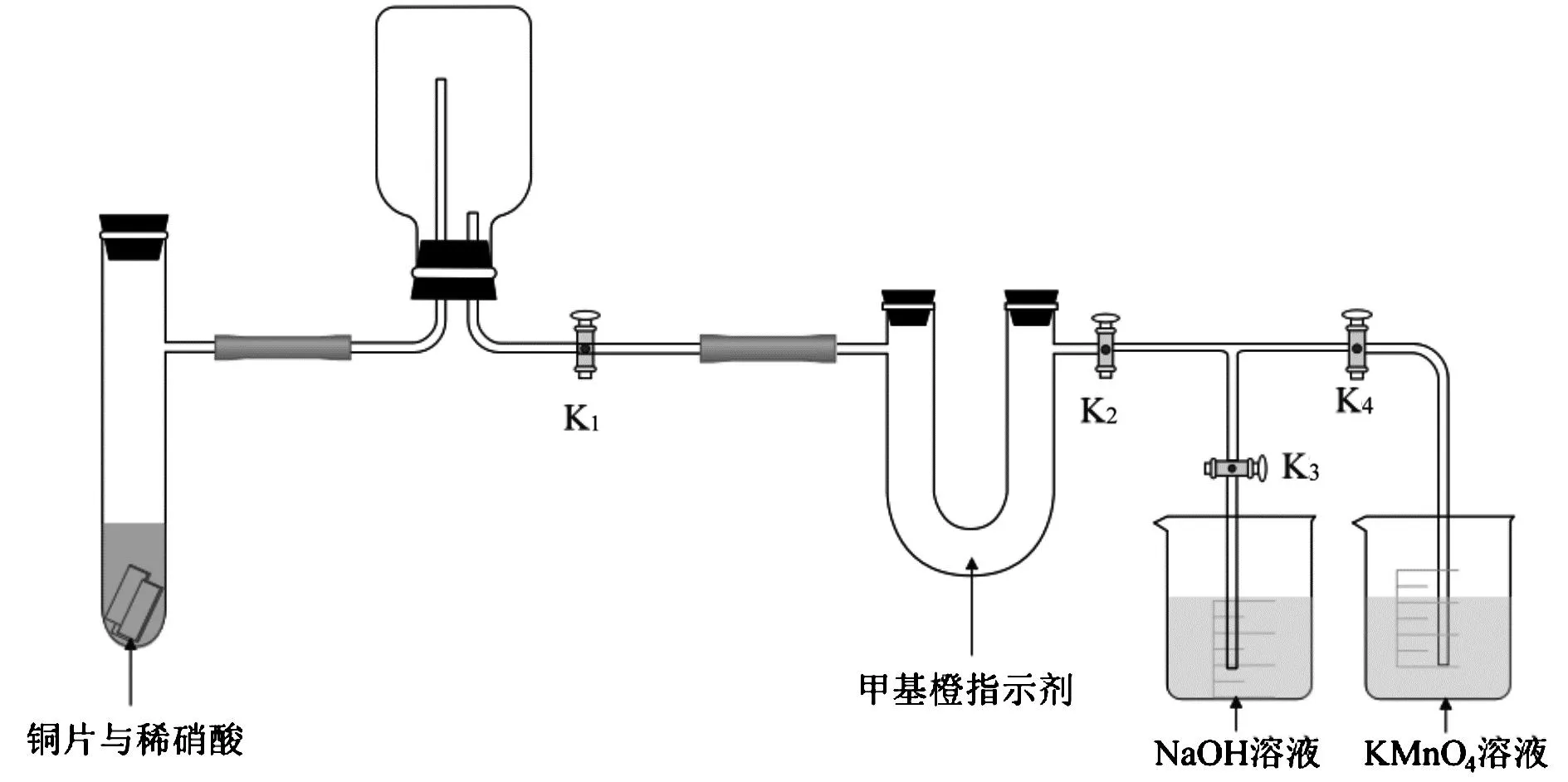
图1 NO制取与NO2性质检验一体化实验装置
3.4 实验步骤
连接好装置,检查气密性后填入药品。关闭K1,打开K2,此时U型形管两侧水柱平行,如图2所示。
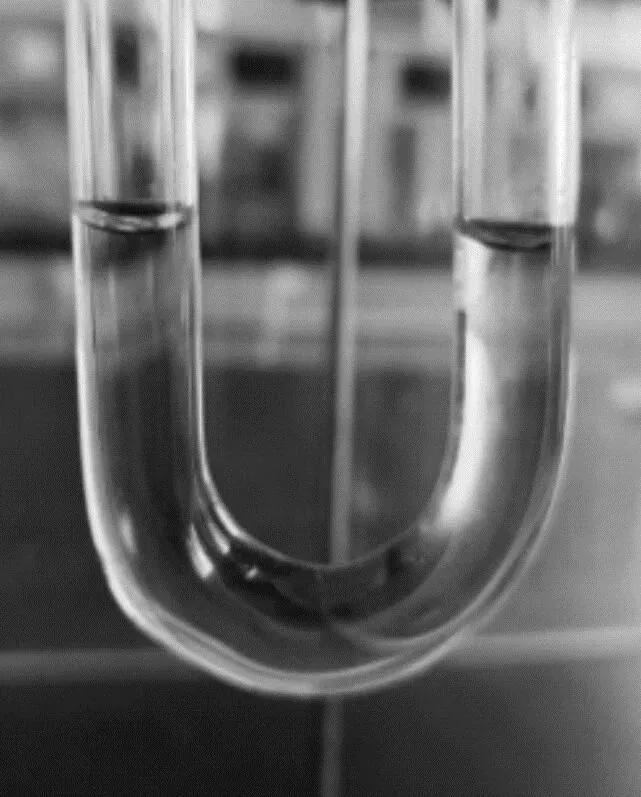
图2 U型形管甲基橙高度
3.4.1 NO的制备
稀硝酸与铜片反应一段时间后,铜片表面开始有无色气泡生成,该无色气泡为一氧化氮,如图3所示。此时打开K1,U型形管左右出现高度差,甲基橙指示剂未变色,如图4所示,出现高度差后关闭K1。本部分实验推理过程如下。

图3 铜片表面生成NO

图4 U型形管甲基橙
实验预测:首先,教师引导学生从物质组成和氧化还原反应的角度预测铜片和硝酸反应的产物。其次,打开K1后,观察U型形管的高度差会有什么变化,以及为什么会出现这样的变化。
实验观察1:铜片表面产生无色气体。打开K1后,U型形管的高度差从两端高度相平变成了左低右高。
事实证据1:铜片与稀硝酸反应产生NO气体。生成的NO与空气中O2发生反应,生成NO2。NO2易溶于水。
分析推理1:根据U型形管液柱变化原因推测,NO没有与O2转化为NO2。
实验观察2:教师引导学生观察集气瓶内和甲基橙颜色变化,发现集气瓶内没有生成红棕色的气体,甲基橙颜色没有发生变化。
事实证据2:NO2为红棕色气体;NO2溶于水生成的硝酸使甲基橙变红。
得出结论:具支试管中铜片与稀硝酸发生反应,生成NO气体导致U型形管左侧气压增大。此时NO没有转化为NO2。
3.4.2 NO转化为NO2
反应一段时间后,铜片表面出现的气泡增多,具支试管中现红棕色气体,试管中溶液变蓝,如图5所示。一段时间后集气瓶中出现大量红棕色气体,如图6所示。

图5 具支试管中NO转化为NO2

图6 集气瓶中收集到大量NO2
本部分的实验现象明显且颜色丰富,将学生的注意力吸引在气体和溶液颜色的变化上,实验推理过程如下。
实验预测:结合本部分实验现象,上一部分的实验推理是否正确。应该怎样检验无色气体NO。
实验观察1:具支试管、集气瓶中出现红棕色气体;具支试管中溶液颜色由无色变为蓝色。
事实证据1:铜与稀硝酸反应方程式为8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O。Cu(NO3)2溶液为蓝色。一氧化氮与氧气反应方程式为2NO+O2=2NO2。
分析推理1:根据颜色变化推断先有无色气体NO生成,NO与O2反应生成红棕色气体NO2。
得出结论:上一部分实验推理正确,检验NO气体的方法是观察无色气体变为红棕色。
3.4.3 NO2转化HNO3
随着反应的进行,集气瓶中红棕色气体不断增多。当连接集气瓶与U型形管的玻璃管中出现红棕色气体时,打开K1。打开K1后,U型形管左右两侧高度差进一步增大,如图7所示。

图7 U型形管甲基橙高度
一段时间后,U型形管左右甲基橙指示剂高度差逐渐减少。最终,左侧高度大于右侧,且左侧甲基橙指示剂由黄色逐渐变为红色,如图8所示。

图8 U型形管甲基橙高度及颜色变化
本部分实验现象与学生预测的实验现象不同,教师引导学生观察具支试管内的气体颜色变化,基于以上证据进一步探究现象成因。实验推理过程如下。
实验预测:打开K1后,观察U型形管的高度差会有什么变化。产生变化的原因是什么?
实验观察1:打开K1后,U型形管的高度差进一步增大。一段时间后,高度差又逐渐降低,左侧的甲基橙变红且颜色逐渐加深。
事实证据1:NO2密度大于空气密度;NO2溶于水生成HNO3导致U型形管左侧气压降低,发生倒吸。
分析推理1:根据U型形管液柱变化原因推测NO2与水反应生成HNO3速度较慢。
实验观察2:具支试管中的红棕色消失,溶液蓝色加深,铜片表面仍产生无色气泡,如图9所示。

图9 具支试管中红棕色气体消失
分析推理2:具支试管中的全部氧气与生成的NO反应生成NO2进入集气瓶中。集气瓶中仍有空气存在,所以打开K1后,集气瓶中压力大于U型形管右侧压力。NO2扩散速度小于其他气体,高度差进一步加大。
事实证据2:3NO2+H2O=2HNO3+NO;硝酸可使甲基橙变红;4NO+3O2+2H2O=4HNO3。
分析推理3:NO2在溶于水的过程中会产生NO。NO与U型形管内氧气反应生成NO2,最终转化为硝酸,加快U型形管左侧压力的降低速度。
得出结论:上述推理正确。
3.4.4 尾气处理
(1)NO2尾气处理。NO2具有毒性,要防止扩散到空气中。所以处理NO2方法为一直打开K1,利用压力将集气瓶内NO2和U型形管内液体挤入装有氢氧化钠的烧杯中,氢氧化钠中和HNO3后,甲基橙恢复黄色。
(2)NO尾气处理。NO不与NaOH反应,故通过氧化还原反应将其氧化处理。所以当红棕色气体排出后关闭K2,将玻璃管接入到盛有高锰酸钾的烧杯中后再打开K2将NO转化为硝酸盐。
4 实验创新点
(1)本实验基于课本实验进行改进,优化实验装置,操作简单,现象多变,易于学生观察。
(2)本装置整合氮氧化物的转化,反应连续进行,实验装置内气体颜色的变化、U型形管内液柱的高度差和甲基橙的变色有效地调动学生学习的积极性,激发学生实验兴趣,引导学生根据实验现象和所学知识进行证据推理得出原因,发展学生的核心素养。
(3)整个实验装置制备尾气处理一体化,无有毒气体排放,符合绿色化学的理念。
5 实验注意事项
(1)本实验装置使用的是玻璃两通活塞,活塞可用弹簧夹代替,为保证气密性应该使用凡士林涂在装置接口处。
(2)药品装入后要塞紧具支试管上的橡胶塞,否则试管内压力增大会将橡胶塞弹出,导致NO2扩散到空气中。
(3)K1打开后要根据U型形管内液柱变化迅速关闭,时间过长会将U型形管内甲基橙挤入装有氢氧化钠的烧杯中。
