基于科学探究思维发展的配合物教学实践
——以“配位键和配合物”为例
2024-01-15韩建丰高凌蕊
韩建丰 高凌蕊
北京市广渠门中学(100062) 北京市首都师范大学第二附属中学(100037)
1 教学主题及思路
1.1 以实验探究为教学抓手
Sidgwick和Pauling共同提出配位共价键模型,形成了以中心离子(原子)提供轨道而配位体提供孤电子对为核心的配合物价键理论[1],在此之后,化学家对配合物的探索从未止步。配位化合物是一类有特征化学结构的化合物,该部分教学内容丰富,难点颇多,如中心离子杂化、强弱配体、同分异构体、晶体场理论等,但高中化学课程安排1~2课时很难触及高位理论。因配合物的组成复杂、应用广泛且在现代化学的各个领域都有涉及,我国高中阶段化学课程非常重视其为学生发展科学探究思维的价值,将“配位键和配合物”放置于“物质结构与性质”模块进行学习。
实验教学中应对课本探究实验素材进行整合与拓展,将知识的发现和研究融入科学探究实验中,减少“视频播实验”“黑板画实验”“耳朵听实验”“考前背实验”,着力于发展学生科学探究思维,结合配合物核心概念开发实验探究情境,让学生感受“提出问题→作出猜想→设计方案→得出结论→反思评价”的科学研究过程,引导学生多问自己“怎样做”“为何这样做”“还可如何做”,切实提升学生学习效率,提升化学学科核心素养。
1.2 将知识能力和方法融入实验探究过程
高中化学课程目标之一是学生能形成“结构决定性质,性质决定应用”的观念,能根据物质的微观结构预测物质在特定条件下可能具有的性质和发生的变化,并能解释其原因。化学学科核心素养的发展依托于真实问题情境,体验探究实验过程是学生形成必备知识、关键能力和正确价值观的重要途径。
化学学科核心素养中的“科学探究与创新意识”着重在实践中激发学生深度学习,以“溶液中铜离子”显蓝色的质疑探究→“浓氯化铜溶液显绿色”的对比探究→“铜氨离子”发现探究→“四水合铜离子与四氨合铜离子稳定性”分析探究→“CO中毒”原理分析等层层推进的探究实验和科学严谨的推理论证,助力学生掌握配位键和配合物核心概念,建构配合物结构与性质的关联认知,实现宏微结合和定性定量结合的系统化知识结构[2]。
1.3 学习目标
①能从中心离子(原子)与配体的空间排布及其相互作用(配位键)角度对生产、生活、科学研究中的配合物应用案例进行分析和解释,认识配合物对社会发展和科技进步的巨大作用,形成社会责任感;②能用结构决定性质、化学平衡等重要化学观念多角度认识化学反应,预测配合物可能发生的化学变化,发展对化学学科本质的认识,具有证据推理与模型认知的科学思维;③能发现和提出具有探究价值的问题,能依据探究目的设计并优化实验方案,较好地完成实验操作并推理得出实验结论,形成独立思考、敢于质疑和勇于创新的科学精神。
1.4 教学结构
“配位键和配合物”一课时细化为5个环节,教学结构图见图1。
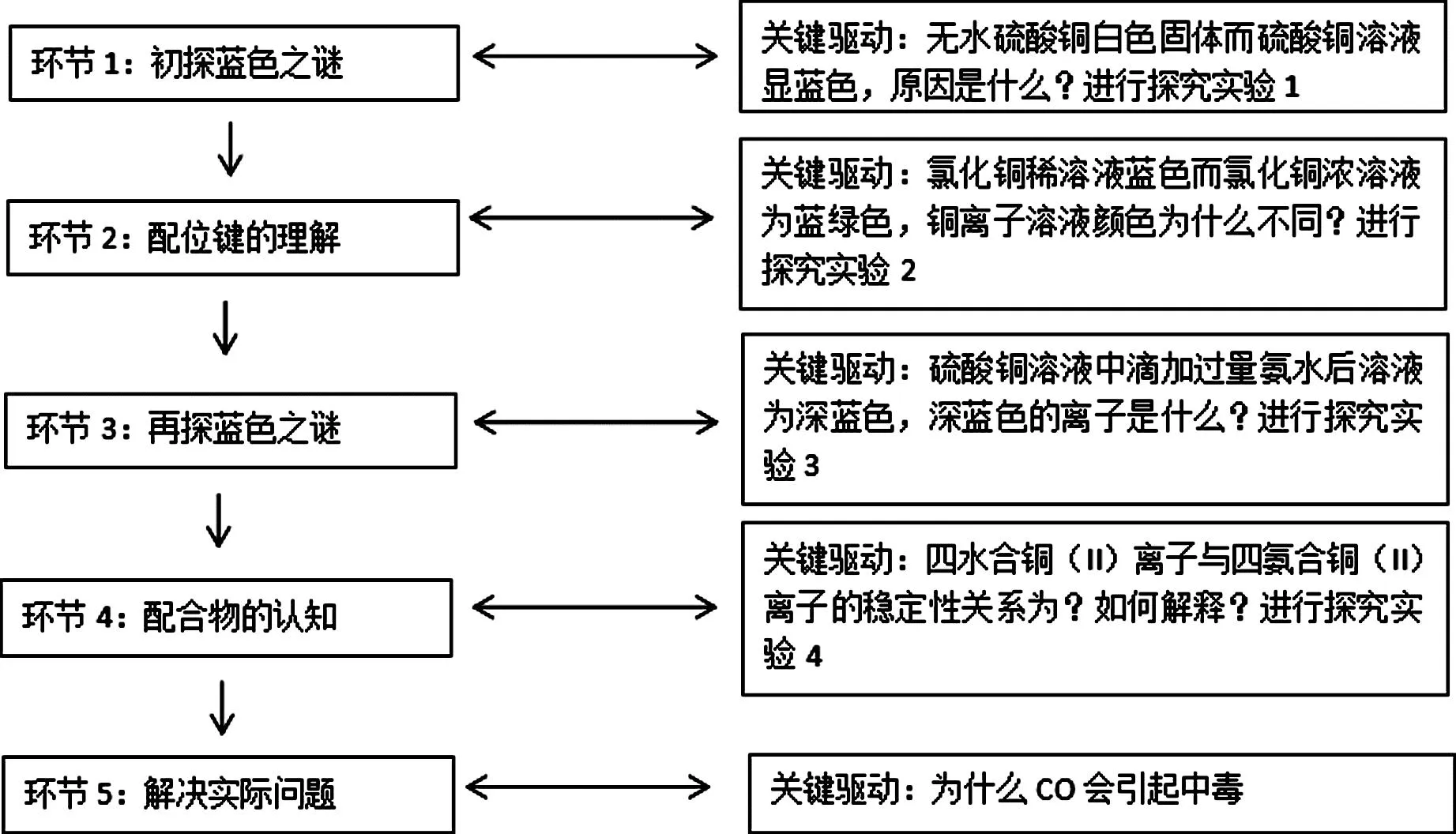
图1 教学结构图
1.5 教学预备
教师准备:依据教学需要,预设学生可能得出的实验设计,提前准备好探究实验需要用到的化学药品与器材,见表1。

表1 探究实验所需药品及器材
学生准备:4人一组。设置组长1人,负责组织实验探究活动;发言人1人,负责本组实验现象及结论的汇报总结;设计师1人,负责本组实验设计规划;实践者1人,负责组内探究实验分工安排与过程中的协调。
信息化设备准备:每组1台iPad(具备查询资料与制作海报能力)。
2 教学实录
2.1 初探蓝色之谜
教师:请回忆硫酸铜溶液和硫酸铜固体的颜色。
学生:在高一阶段学习硫及其化合物浓硫酸时完成了“铜和浓硫酸反应”实验,观察到产生白色固体,预测为无水硫酸铜,检验方法为将反应后混合体系缓慢加入装有水的烧杯中并不断搅拌,现象为白色固体溶解,溶液变为蓝色。
探究1:硫酸铜溶液是同学们非常熟悉的物质,它呈现漂亮的天蓝色,可是无水硫酸铜固体又为白色。
学生:小组内依据教师提供的药品设计探究实验思路。提出假设:铜离子显色或硫酸根显色。
明确思路:结合控制变量和空白对照实验思想,确定实验流程后开展班级内汇报交流。
教师:组织交流,归纳整理出合理实验设计,确定探究实验1最终方案,见图2。

图2 探究实验1设计
学生实践1:完成探究并依据实验证据推理得到初步实验结论。实验汇报整合:试管1和2对比,试管1溶液为无色、试管2溶液为蓝色,排除硫酸根使溶液变蓝的可能;试管2和3对比,发现试管2和3溶液均为蓝色,说明铜离子是硫酸铜溶液显蓝色的原因。但留有疑问,试管4溶液为绿色,说明氯离子参与了颜色的呈现。
学生:提出疑问:固体中的铜离子不会显蓝色,而溶液中的铜离子会显蓝色,说明铜离子和水分子一定有相互作用,到底是什么呢?
2.2 配位键的理解
教师:请推测铜离子和水分子如何成键。这种键是一种“特殊”的共价键,可以结合共价键概念进行思考。
学生:共价键的本质是共用电子对作用力,其中“共用电子对是关键”,由此可推测水分子单独提供自己的孤电子对作为“共用电子对”填入铜离子的空轨道中。
教师:这种“电子对给予(配体)→电子对接受(中心离子或原子)”的特殊共价键即为共价键,我们得到的蓝色溶液即为铜离子和水分子形成的配合物:硫酸四水合铜(II)。
探究2:在探究1的试管4中我们观察到了“绿色”,说明溶液中不只为四水合铜(II)配离子。请设计实验证明还有其他配离子的存在,并解释溶液显绿色的原因。
学生:氯离子可以确定参与了新的配合物的生成,怎么证明呢?因铜离子为中心离子,氯离子为配体,那需要关注氯离子浓度,增加新配合物的量。
教师:各小组汇报,整理提出的可能性假设和初步方案,和学生共同确定探究实验2设计,见图3。

图3 探究实验2设计
学生实践2:完成实验后记录实验现象,得出初步实验结论。试管1和2对比,试管2中氯化铜浓度升高,绿色逐渐变黄,说明新配合物与铜离子或氯离子浓度升高有关。试管3和4对比,试管3溶液由绿色转向蓝色,试管4溶液颜色由绿色转向黄色,说明蓝色的四水合铜(II)离子仍旧存在,且能够随着氯离子浓度升高生成了新配离子,配体为氯离子。
教师:配合物的形成中同样存在化学平衡。颜色转化是否存在配合物的转化呢?试着用平衡原理解释颜色的转化。
学生:小组讨论探究2实验结果,见图4。绿色是蓝色和黄色的混合色,氯离子浓度降低,平衡逆向移动,反之平衡正向移动。

图4 探究2实验结果
学生:提出疑问,结合化学平衡原理分析实验结果,发现四氯合铜(II)配离子稳定性强于四水合铜(II)配离子,配合物的稳定性又是由什么决定的呢?如何预测与分析呢?
2.3 再探蓝色之谜
教师:配合物稳定性可以从配位键的形成入手,配原子的孤电子对更易给出的更易形成稳定配合物。
探究3:请结合“物质结构与性质”模块相关知识预测、设计、解释四氨合铜(II)离子稳定性强于四水合铜(II)离子。
学生:分析实验目的可知,需要设计实验使四水合铜(II)离子通过化学反应转化为四氨合铜(II)离子,根据提供的药品可以设计向硫酸铜溶液中加入氨水观察实验现象获取证据。
学生实践3:小组协作完成实验,解释探究3实验现象产生的原因,结果见图5。

图5 探究3实验结果
由实验现象分析,四水合铜离子的稳定性小于氢氧化铜,氢氧化铜稳定性小于四氨合铜离子。原理解释:电负性O大于N,故给出电子对能力O小于N,形成配位键的强度O小于N,四氨合铜离子稳定性强于四水合铜离子。
学生:从以上实验中知道了配离子稳定性有差别,但整个配离子稳定性普遍较好。溶液中除配离子肯定还存在其他离子,整体形成了配合物。配合物有什么性质呢?
2.4 配合物的认知
教师:配合物从结构上可以分为内界和外界,内界的中心离子与配体以配位键连接,因配离子稳定性较高很难发生反应,而外界离子是能够电离的。
探究4:向探究3中得到的深蓝色溶液加入95 %乙醇,会有什么现象?我们得到了什么物质,请设计实验证明。
学生:依据物质性质进行预测:乙醇因存在—C2H5为诱导效应推电子基团,导致O—H键的极性减小,乙醇分子极性小于水分子。加入乙醇后溶液体系的极性降低,溶解在水中的物质溶解度下降会析出晶体,故推测晶体为 [Cu(NH3)4](OH)2或[Cu(NH3)4]SO4。要证明是哪一种物质,可借助硫酸根的检验方法。证明氨气作为配体是否通过配位键与铜离子稳定配合,可借助氨气的检验方法。
教师:归纳各小组实验思路,组织学生开展探究。
学生实践4:将95%乙醇加入到含有四氨合铜配离子溶液中,析出蓝色沉淀。过滤,取少量深蓝色晶体于试管中,加水溶解溶液为深蓝色,先加入盐酸酸化再加入氯化钡溶液,产生白色沉淀。从而确定深蓝色晶体是[Cu(NH3)4]SO4,且能够电离出硫酸根离子。同时另取少量深蓝色晶体,加水溶解后加热,在试管口处放置湿润的红色石蕊试纸,不变蓝,证明氨气和铜离子配合较好,配离子整体比较稳定。
教师:配合物分为内界和外界,配合物电离时生成配离子和外界离子。配离子中含有提供空轨道的中心离子、提供孤电子对的配体,两者通过配位键结合较为稳定。
教师:探究4实验结果见图6。

图6 探究4实验结果
学生:通过探究学习了解到配位键和配合物的相关知识,感觉很有趣。配合物知识在化工生产和生活中有哪些实际应用呢?
2.5 解决实际问题
教师:配合物应用广泛,在生命体中也有很多应用实例。例如,我们在初三化学中学习过CO中毒的相关知识,请小组协作制作一张相关海报。
学生:课内查询资料,结合血红蛋白输送氧气确定血红素与氧气也是配合物。再结合探究3的结论发现一氧化碳做配体时碳原子电负性小,比氧原子更易给出孤电子对。因而CO浓度达到一定阈值时会替代氧气与血红素中心的Fe2+结合,导致中毒。
学生:小组内利用iPad制作海报说明CO中毒原理,班级内展示交流。学生汇报要素见图7。
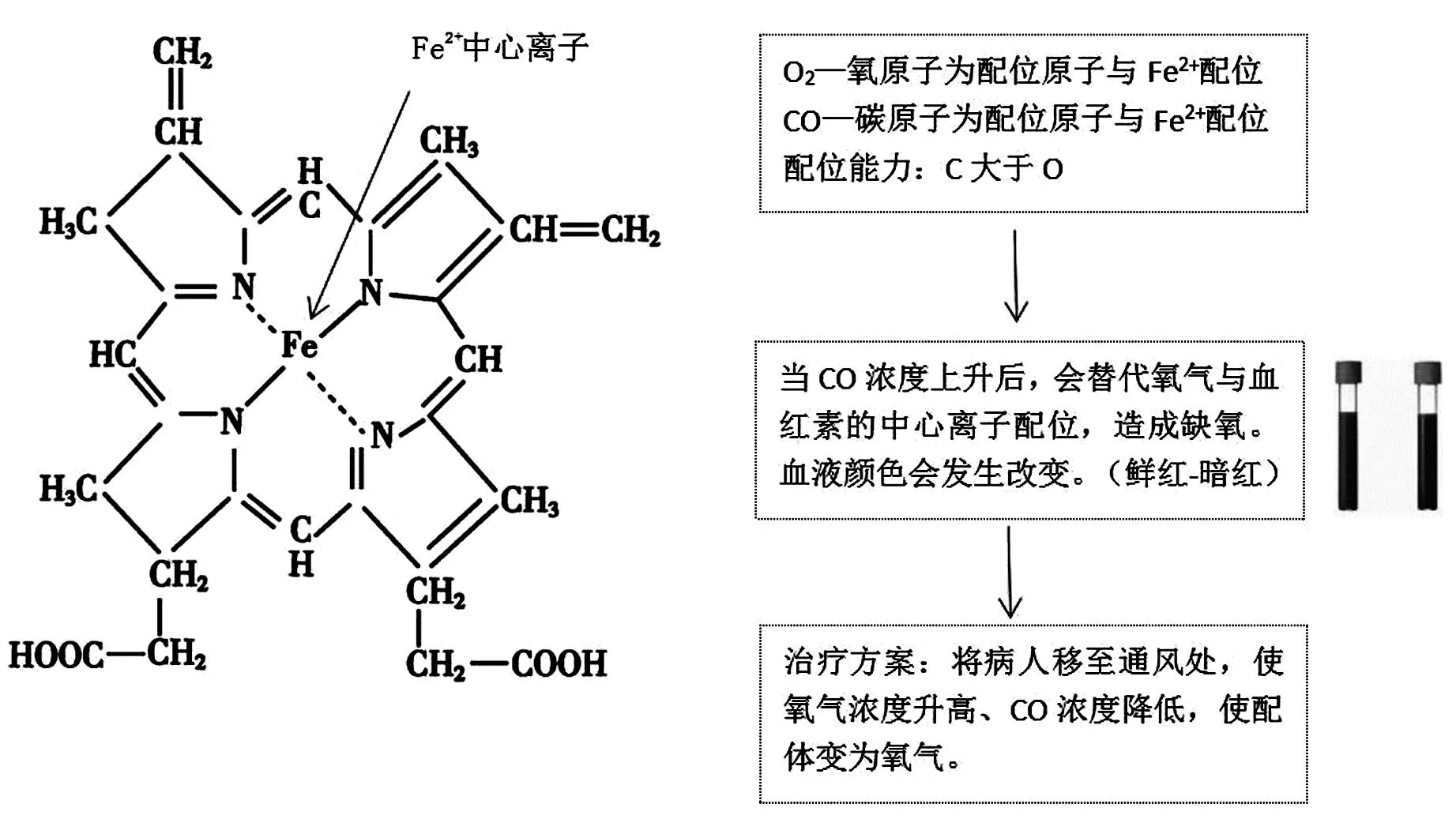
图7 学生汇报要素
教师:至此,我们在探究中完成了配位键和配合物关键问题的学习,希望同学们逐步提升科学探究能力,在未来的学习中提出更多的问题,并去研究、解决它们,为个人成长和科技、社会的发展贡献力量。有关配合物的高位理论知识还有很多,感兴趣的同学可以继续开展学习与研究。
3 反思提升
3.1 延续科学发展典范,让科学探究推动深度学习
化学史乃至科学史上有很多以科学探究为动力的科学发展范例,例如“原子结构”模型,探究实验如“阴极射线”“α粒子散射实验”“原子光谱”等大力推动了科学发展。可见化学作为一门实验为基础的自然科学,科学探究是必不可少的化学研究思路与方法。“配位键和配合物”的教学中以探究实验设置驱动问题,创设学生易于入手的熟悉情境,引导学生在探究中发现问题、提出问题,教师适时提出相应概念回应学生的质疑、困惑,帮助学生深度学习。
3.2 培养学生主体意识,让学生在探究中学以致用
高中阶段化学学科的科学探究主要为对化学物质组成、性质及化学变化的探究。新理念教学中学生是课堂主体,同样应是科学探究的主体,应该让学生从目的、设计、实践、反思、改进等全流程中发现探究实验的真谛,激发主动性和创新意识,形成科学实验严谨的品格,发展智力、培养能力。以课堂和实验“主人”的心态逐步掌握“去伪存真、由此及彼、由表及里、迁移运用”的科学方法,通过宏观现象认识到微观世界的本质,形成结构决定性质的化学观念,培养科学态度与科学思维并乐于参与科学研究和社会建设,达到“学以致用”的效果。
3.3 创设真实问题情意发展科学探究思维与创新意识
教师应充分重视探究实验的价值,帮助学生沁润在具有探究实验情境的化学课堂,以自主、深入的探究行为发展学生必备知识、关键能力和正确价值观。新时代教育呼唤创新型人才,创新型人才具有“灵活、开放、好奇”的个性,具有精力充沛、坚持不懈、注意力集中、想象力丰富以及富于冒险精神等特征[3]。实验教学是国家课程方案和课程标准规定的重要教学内容,是培养创新人才的重要途径[4]。基础教育阶段主张更加关注学生的学习过程、学习经验以及学习效果,有效激发学生创新意识与发展潜能。而创设真实的问题情境引导学生质疑并提出问题的探究实验学习过程,契合对学生批判性思维的科学态度、探究思维、核心素养的培养要求。
