硫化氢吸收塔的碱液复配和运行参数优化
2024-01-15朱福苗赵兴欣龙绛雪王利勇
朱福苗,赵兴欣,龙绛雪,王利勇
(厦门理工学院环境科学与工程学院, 福建 厦门 361024)
H2S 是一种无机酸性化合物,广泛存在于自然界及多种人类生产过程中[1-2]。H2S 属于恶臭污染物,有臭鸡蛋味,会破坏人体呼吸系统粘膜,损害大脑神经,甚至致人死亡[3-4];它在空气中会溶于水产生酸雨,污染河流和土地,破坏建筑物结构[5]。因此,研究如何有效地去除硫化氢气体具有重要意义[6]。目前,硫化氢的处理方法主要有吸附法、催化氧化法、生物法和化学法。吸附法使用特定的吸附剂(如活性炭、氧化铁等)吸附H2S,适用于中低浓度H2S 废气处理,如垃圾处理厂、食品加工厂等;其优点是操作简单,但吸附剂的再生和废液处理会产生二次污染、且对高湿度废气的处理效果较差[7-8]。催化氧化法是通过引入氧气和特定催化剂(金属有机框架材料、金属氧化物等)进行氧化反应,将H2S 氧化为硫酸盐,适用于中高浓度H2S 废气处理,如炼油厂、石化厂等;其优点是废气净化效果好,反应速度快,但催化剂的选择和再生比较困难,操作成本较高[8-11]。生物法是利用特定微生物将H2S 转化为硫酸盐,适用于低浓度的H2S 废气处理,例如污水处理厂、垃圾填埋场气体及农业废弃物等;生物法处理的优点是操作简单、能耗低且不会产生二次污染物,但当H2S废气浓度较高时大部分硫杆菌会被毒死,处理效果较差,且对温度、pH 值等环境条件较为敏感、需要较长的启动时间[12-13]。化学吸收法采用吸收剂(如碱性氧化物、碱性溶液等)与H2S 发生反应并转化为硫化物来去除H2S,适用于高浓度H2S 废气处理,如化工厂、炼油厂和钢铁厂等[14-15];其优点是能够高效去除H2S,但吸收剂耗用量较大,需要处理吸收剂的再生和废液处理,操作成本较高。
NaOH 碱液吸收塔喷淋[16-17]是去除H2S 常用的化学吸收法, H2S 气体可以快速和塔顶喷淋的NaOH溶液发生中和反应,去除效率高[18-19]。但NaOH属于强碱,碱液的 pH值过高会对管道设备有腐蚀性,同时对设备操作人员来说存在安全隐患[20]。为防止严重腐蚀造成气体泄漏,需定期用弱酸溶液养护碱液吸收塔和管道,增加了工艺成本[21]。Na2CO3是一种弱碱盐,在水中溶解后水解产生OH-,使该溶液呈碱性[22],纯Na2CO3溶液虽然也能去除H2S,但存在二次逸出的问题[23]。但相比于NaOH 溶液,Na2CO3溶液成本低[19],Na2CO3电离生成NaHCO3可以有效缓冲系统pH值,所以在NaOH溶液中加入Na2CO3不仅可以降低碱液的pH 值,也可以降低NaOH 的用量,且比纯NaOH 溶液的腐蚀性弱,会对设备的腐蚀起到一定的缓冲作用,延缓设备的衰老和损坏,增长使用寿命。另外,有关碱液吸收塔去除H2S的具体工艺条件的研究较少,对碱液的pH值和吸收塔气液比等条件缺乏精准控制[24]。因此,本文采用自搭建的碱液吸收塔对人工配制的H2S进行吸收。以硫化氢去除率为指标,采用单一变量原则,首先通过单因素实验对碱液吸收塔的运行参数(气液比、pH 值和冲淋液温度)进行优化,然后在NaOH 溶液中加入Na2CO3溶液进行碱液复配,考察Na2CO3对pH 值的调节作用,来确定碱液的最佳复配体积比,为实际生产应用中碱液吸收塔的运行提供参考条件。
1 实验设计
1.1 反应机理
H2S气体进入碱液吸收塔后, 在塔内与填料区表面的含有氢氧化钠和碳酸钠等溶剂充分接触,发生中和反应(H2S + 2 NaOH → 2 H2O + Na2S,Na2CO3+ H2S → NaHS + NaHCO3,HS-+ OH-→ S2-+H2O)。
1.2 实验设备和材料
实验药品:Na2S,分析纯,阿拉丁生化科技(上海)股份有限公司;浓硫酸,分析纯,国药集团化学试剂有限公司;氢氧化钠,分析纯,国药集团化学试剂有限公司;碳酸钠,分析纯,国药集团化学试剂有限公司。
实验器械:复合型性气体检测计,MS400S 型,基恩思精密仪器设备有限公司;气体流量泵,VUY6002A 型,成都海霖科技有限公司;液体流量泵,DIPump550-B403型,卡默尔流体科技(上海)有限公司;PHS-25 型pH 计,上海仪电科学股份有限公司;采气袋,50L,宁波鸿谱实验科技有限公司;水浴锅,DF-101S型,上海力辰邦西仪器科技有限公司;玻璃转子气体流量计,LZB-6WB型,中国常州双环热工仪表有限公司。
1.3 原料气的制备
采用硫化钠与稀硫酸反应制取硫化氢气体,该反应的化学方程式为:Na2S + 2H2SO4= Na2SO4+ 2H2S↑。
取0.39 g 硫化钠和12 mL 0.5 mol·L-1的稀硫酸(纯水稀释),在启普发生器中发生反应。用注射器将稀硫酸向硫化钠中缓慢滴加,轻轻晃动反应器使反应更加充分。制备出的H2S用集气袋收集,后续实验可稀释(利用空气进行稀释)至所需浓度备用。
1.4 实验装置与流程
1.4.1 实验装置
实验装置如图 1 所示。碱液吸收塔为有机玻璃材质,由H2S 进气部分、填料区和碱液喷淋部分3 部分组成。H2S 气体由储气箱经气泵从塔底进气口抽入碱液吸收塔,与填料区(聚乙烯空心球,密度为0.91~0.97 g·cm-³) 表面的NaOH 或Na2CO3碱液发生反应而被去除,未脱除的H2S 气体由碱液吸收塔顶端排出到NaOH尾气吸收液中。碱液由液体泵从碱液储罐泵入到喷淋装置,在碱液吸收塔顶端由上而下进行喷淋,从下端回流到碱液储罐中。
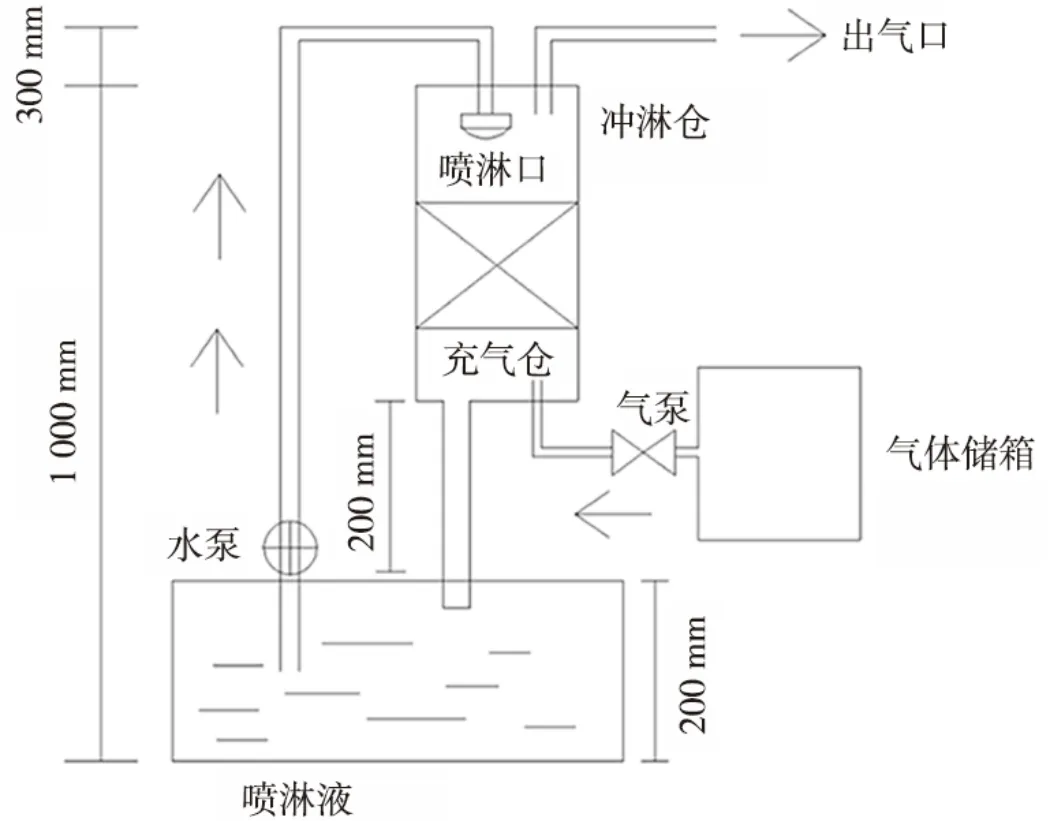
图 1 碱液吸收塔模型Fig.1 Alkali absorption tower model
实验装置的基本参数如表1所示。

表 1 实验装置的基本参数Table 1 Basic parameters of experimental device
1.4.2 实验条件的设定
本实验操作在通风橱下进行。首先进行气体流量泵和液体流量泵的调试,通过改变进气流速控制气液比。控制进气流速为3 L·min-1,冲淋速率为50 mL·min-1(即气液比为60∶1),H2S 进气浓度为20 mg·m-³,碱液喷淋温度控制在25℃,设定运行时间为3 min。采用便携式复合型性气体检测计对碱液吸收塔顶端排出的H2S 气体浓度进行检测。采用单一变量的原则,分析纯NaOH 和纯Na2CO3两种溶液在不同气液比、不同pH值以及不同冲淋液温度下对H2S的去除率。硫化氢去除率计算式为
最后分析纯NaOH 和纯Na2CO3两种溶液以及两者体积比为4∶1 和3∶2 的复配碱液对H2S 的去除率,考察Na2CO3对pH 值的调节作用,得出适宜复配比和碱液吸收塔最佳运行参数。所有实验都重复两次进行,对得到的实验数据取平均值,数据用Excel统计。
2 实验结果与分析
2.1 不同pH值对硫化氢的去除效果
根据1.4.2设定的实验条件,其他条件保持不变,设定pH 值为单一变量,分别为12.0、 11.5、 11.0、 10.5、 10.0、 9.5、9.0。当pH 值大于12 时,两种溶液对H2S的去除率都达到了100%,不便于得到影响碱液处理因子的有效数据。据上测定两种溶液对H2S 的去除率,结果如图2 所示。由图 2 可以看出,随着pH 值的下降,两者对H2S 的去除效率也逐渐降低,同比条件下,纯NaOH 溶液比纯Na2CO3溶液的去除率高,主要是因为氢氧化钠为强碱,与H2S的反应更迅速。在pH 值为 9.5 ~ 12 时,纯NaOH溶液比纯Na2CO3溶液去除率高9.35%左右;当pH 值为9.0 时,纯NaOH 溶液比纯Na2CO3溶液去除率高2.6%,此时两者的去除率在40 %左右,处理效果差。纯NaOH溶液和纯Na2CO3溶液pH 值在11 及以上时,去除率在75 %以上,低于此值建议补充碱液。 后续实验在pH值为11的条件下进行。

图 2 不同pH值的NaOH和Na2CO3对H2S的去除率Fig.2 Removal rate of H2S by NaOH and Na2CO3 with different pH value
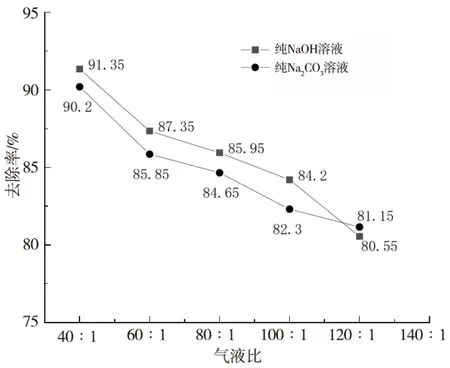
图3 不同气液比下NaOH和Na2CO3对H2S的去除效果Fig.3 H2S removal effect of NaOH and Na2CO3 with different gas-liquid ratio
2.2 不同气液比下对硫化氢的去除效果
根据1.4.2设定的实验条件,设不同气液比为单一变量,分别为40∶1、60∶1、80∶1、100∶1、120∶1,通过改变进气流速改变气液比,对应的进气流速分别为2、3、4、5、6(L·min-1)。测定pH 值为11 的两种溶液对H2S的去除率,实验结果如图 3所示。
由图 3 可以看出,在同等条件下,通过改变H2S气体的进气流速,气液比值从40逐渐增加至120 时两者对H2S 的去除效率从90%逐渐下至80%。当气体的进气流速较缓慢时,气体在碱液吸收塔内有充分的时间进行反应,故去除率高;随着进气流速的逐渐增大,气体与吸收剂接触时间逐渐减少,导致去除率下降。但两种溶液的去除率相差不到2%,这说明碳酸钠溶液对硫化氢有很好的去除效果。随着气液比值从100 增加到120,两者的差距逐渐缩小,甚至纯Na2CO3溶液的去除率略高于纯NaOH 溶液,氢氧化钠作为强碱完全电离的优势逐渐下降。综合考虑,气液比值建议为60~120,此时溶液去除率在80%以上。
2.3 不同冲淋液温度对硫化氢的去除效果
根据1.4.2 设定的实验条件,设定不同的冲淋液温度(5,15,25,35,45℃)为单一变量,测定纯NaOH 和纯Na2CO3两种溶液(pH 值为 11)对H2S的去除效果,实验结果如图4所示。
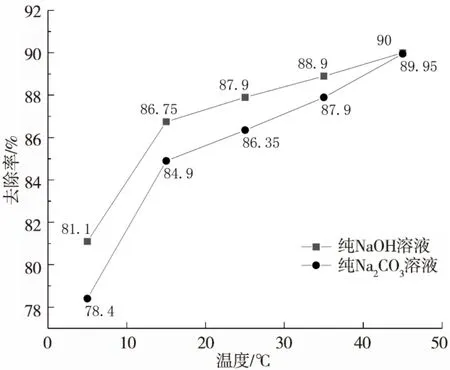
图4 不同温度下NaOH和Na2CO3对H2S的去除效果Fig.4 H2S removal effect of NaOH and Na2CO3 at different temperatures
由图 4 可以看出,温度升高,两者对H2S 的去除率都有升高,分析原因是由于分子间的运动更加活跃,与H2S的反应更加完全。但两者去除率不存在显著差异,纯NaOH 溶液相对较纯Na2CO3溶液低0.05%~2.7%,且随着处理温度的增高,两种的处理效果逐渐接近。其中在冬季较低气温下(5℃),两者的去除率分别为81.0%和78.4%,比夏季(35℃)低7.7%~9.5%,夏季的去除效果比冬季好。建议冬季处理时适当提高碱液浓度,相对夏季的pH 值提高0.5,以保障处理效果。
2.4 在不同复配比下两种碱液对硫化氢的去除效果
由上述实验结果可知,碱液吸收塔在运行参数气液比为60∶1、pH 值为11、温度为35 ℃下的去除率最高。从经济性出发,实验选用纯NaOH 溶液与成本更低的纯Na2CO3溶液复配来降低碱液pH 值、节约碱液成本。复配比根据两种溶液对H2S 的去除率确定。由于纯NaOH 溶液的去除率高于纯Na2CO3溶液,所以选定复配碱液中纯NaOH 溶液比例高于纯Na2CO3溶液,两者体积比分别为4∶1和3∶2进行实验。在优化的运行参数下,测定10 min 内纯NaOH 溶液和纯Na2CO3溶液以及两者体积比为4∶1 和3∶2 的复配碱液对H2S 的去除效果,以确定两种碱液的最佳复配体积比。实验结果如图5所示。
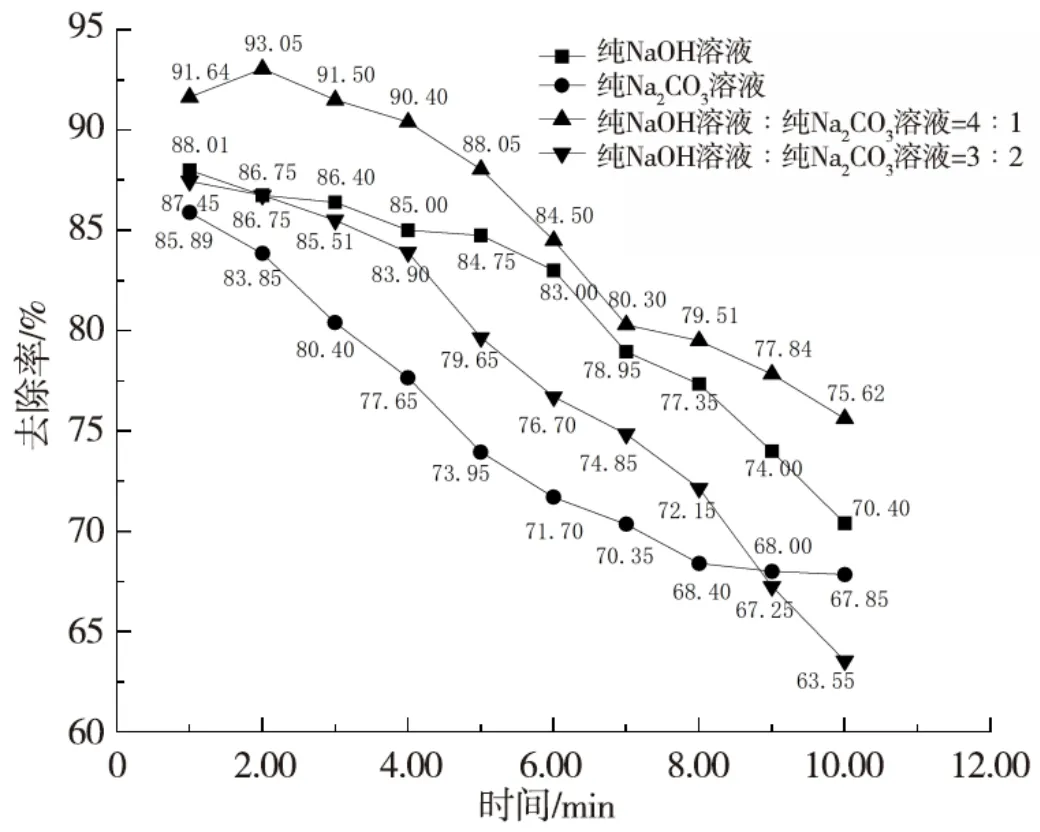
图5 不同复配体积比下碱液对H2S的去除效果Fig.5 The removal effect of alkaline solution on H2S under different complex volume ratios
由图5 可见,4种溶液随着吸附时间的增加,碱液在逐渐消耗,4 种溶液对H2S 的去除率都逐渐减小,但在10 min 内对H2S 对去除率均大于60%;复配碱液去除率均高于纯Na2CO3溶液去除率,这与复配碱液中NaOH 的贡献有关。其中,复配体积比为4∶1 的碱液比纯NaOH溶液的去除率高3.82%,较复配体积比3∶2碱液去除率高9.08%,比纯Na2CO3溶液去除率高11.16 %。主要是因为Na2CO3在混合碱液中可调节pH 值,当氢氧化钠溶液和碳酸钠溶液混合时,在反应前阶段氢氧化钠溶液中的OH-会抑制CO32-的水解,但随着反应的不断进行,混合溶液中已电离的OH-浓度不断减少,水解反应逐级发生(一级水解:CO32-+H2O=OH-+HCO3-;二级水解:HCO3-+H2O=H2CO3+OH-),会不断生成OH-,去除H2S 气体,从而提高去除率。综上,复配体积比为4∶1 的碱液去除效果最佳。
3 结论
本文采用自搭建的碱液吸收塔对H2S进行吸收。以硫化氢去除率为指标,先通过单因素实验优化碱液吸收塔的运行参数(气液比、pH 值和冲淋液温度),再对NaOH、Na2CO3溶液进行复配,根据两种碱液在不同复配比下对硫化氢的去除效果来确定其最佳复配体积比。结果表明:1)碱液pH 越高,两种碱液对H2S的去除率就越高;在pH值为 9.5 ~ 12.0区间,NaOH 溶液的去除率比Na2CO3溶液的去除率高8.25%左右,两种溶液pH 值在11及以上时的去除率均在75%以上。2)气液比在40~120时,去除率均大于80%。Na2CO3溶液对H2S有良好的去除效果,与NaOH溶液只有2%左右的差距。随着冲淋液温度的增高,两种碱液对H2S的去除率提高。建议在冬季工况中适当提高0.5个pH值,以保证去除率。3)NaOH 溶液和Na2CO3溶液碱液最佳复配比为4∶1。与NaOH 溶液和Na2CO3溶液体积比为4∶1和3∶2时复配碱液在10 min内对H2S的去除率均大于60%。其中,在4∶1的复配碱液比下,碱液对H2S的去除率,分别比纯NaOH溶液、纯Na2CO3溶液高3.82%和11.16 %左右。
