丹酚酸B对创伤后应激障碍模型大鼠认知功能和GSK-3β/β-Catenin信号通路的影响
2024-01-15杨阳何巧玉
杨阳,何巧玉
创伤后应激障碍(PTSD)是一种严重的心理障碍疾病,发病机制十分复杂且目前对其的治疗方式有限[1-2]。因此,有必要探索干预、治疗和预防PTSD的新方法。PTSD患者伴有各种心理和行为异常,其中认知功能障碍较为常见,故改善PTSD患者认知功能一直是主要的治疗目标[3]。丹酚酸(Sal)作为一种从丹参中提取的天然化合物,具有抗炎、抗氧化、抗凋亡等多种生物学活性。Sal A 可通过抑制神经炎症和神经细胞凋亡减轻慢性脑缺血引起的大鼠认知功能障碍[4];Sal B 能够通过多种机制改善阿尔茨海默病导致的认知功能障碍[5]。但Sal 能否有效改善PTSD 诱导的认知功能障碍以及其相关机制至今仍未知。研究表明,糖原合成酶激酶-3β(GSK-3β)/β-连环蛋白(β-Catenin)信号通路在学习和记忆等认知损伤的调节过程中发挥重要作用[6]。此外,长期给予Sal A 可通过激活Wnt3a/GSK-3β/β-Catenin信号通路抑制缺血性卒中大鼠的神经元凋亡并改善神经功能[7];Sal B 能够通过促进GSK-3β 磷酸化同时抑制β-Catenin磷酸化,从而促进神经元分化与增殖[8]。本研究以丹参中含量丰富、生物活性强的水溶性化合物Sal B 为干预药物,初步探讨Sal B 对PTSD 模型大鼠认知功能的影响以及GSK-3β/β-Catenin 信号通路在此过程中的作用,以期为PTSD防治提供实验依据。
1 材料与方法
1.1 主要材料
1.1.1 实验动物 6~7 周龄SPF 级健康雄性Wistar 大鼠60只,体质量190~210 g,购自北京北方艾特生物科技有限公司,生产许可证号:SCXK(京)2020-0005。大鼠在温度23~25 ℃、12 h光/暗循环、相对湿度50%~55%的动物房内统一饲养,自由摄食饮水。动物实验程序均遵循《实验动物护理和使用指南》中的相关要求,按照3R原则给予人道主义关怀。
1.1.2 药物、主要试剂与仪器 Sal B(纯度HPLC≥98%)、Nissl 染色液(焦油紫法)购自北京索莱宝科技有限公司;GSK-3β抑制剂CHIR-99021,纯度99.71%,购自美国MCE公司;TUNEL细胞凋亡原位检测试剂盒购自北京百奥莱博科技有限公司;BCA蛋白质定量试剂盒购自天根生化科技(北京)有限公司;兔抗鼠裂解的胱天蛋白酶3(cleaved caspase-3)、B细胞淋巴瘤基因-2 相关X 蛋白(Bax)、磷酸化GSK-3β(p-GSK-3β,Ser9)一抗抗体购自美国Invitrogen 公司;兔抗鼠原癌基因(c-Myc)、细胞周期蛋白D1(Cyclin D1)、总GSK-3β(t-GSK-3β)、总β-Catenin(t-β-Catenin)、磷酸化β-Catenin(p-β-Catenin)、磷酸甘油醛脱氢酶(GAPDH)一抗抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗购自英国Abcam 公司;超敏ECL底物液购自武汉伊莱瑞特生物科技股份有限公司。EthoVision XT 动物行为视频分析系统购自荷兰Noldus公司;旷场箱(100 cm×100 cm×40 cm)购自上海玉研科学仪器有限公司;生物显微镜(BX53 型)购自日本Olympus 公司;凝胶成像分析系统(WD-9413C 型)购自北京六一生物科技有限公司。
1.2 方法
1.2.1 PTSD 大鼠模型构建 采用单一延长应激(single prolonged stress,SPS)法构建PTSD 大鼠模型[9-10]。将大鼠置于有机玻璃制成的束缚装置中固定束缚2 h,然后置于透明的圆柱形玻璃容器,高50 cm,直径35 cm,水深35 cm,水温23~25 ℃,强迫游泳20 min;随后,取出大鼠并擦干,使其休息15 min后使用乙醚麻醉1~2 min,直到失去意识;待大鼠清醒后放回笼中饲养。若大鼠出现毛发竖立、警觉性增高、聚集蜷缩、易激惹等应激现象,则视为造模成功[11]。
1.2.2 动物分组与给药 60 只大鼠适应性饲养1 周后按随机数字表法分为正常组、PTSD组、Sal B低剂量组、Sal B高剂量组和GSK-3β 抑制剂组,每组12 只。除正常组外,其余组大鼠均构建PTSD 模型。Sal B 低、高剂量组分别灌胃10、20 mg/kg Sal B[12];GSK-3β 抑制剂组灌胃30 mg/kg CHIR-99021,研究前期已通过预实验证实30 mg/kg CHIR-99021对正常饲养大鼠无明显毒性作用;正常组、PTSD组灌胃等量生理盐水,每天1次,连续14 d。
1.2.3 旷场实验 给药结束后,通过旷场实验评估大鼠自主活动能力和探索行为能力。将大鼠放入1个100 cm×100 cm×40 cm 的黑色旷场箱中,箱子底部平分为25 个方格,正上方放置1个摄像机,视野可覆盖整个场箱内部。观察大鼠活动情况,记录5 min内大鼠的爬行格数,4爪均进入方格才计数;站立次数,大鼠后肢直立,前肢离开地面≥1 cm 的次数;采用EthoVision XT 动物行为视频分析系统测定运动总距离。实验过程保持安静,每只大鼠从中间格放入,每只大鼠实验结束后用75%乙醇擦拭场箱内部以消除其残留气味。
1.2.4 Morris 水迷宫实验 旷场实验结束后,通过Morris 水迷宫实验评估大鼠学习记忆能力。将直径160 cm、水深30 cm、水温22~24 ℃的圆形水池平分为4个象限,并在其中1个象限中放入1个直径10 cm的平台,位于水面1 cm以下,水池上方安装摄像机。(1)定位航行实验。训练大鼠从每个象限的正中间出发寻找平台,记录大鼠自每个象限出发找到平台的时间,即逃避潜伏期,若大鼠未能在120 s 内找到平台,则进行引导,并将逃避潜伏期记为120 s,连续训练4 d,4次/d,结果取平均值。为了保证大鼠的体力,应使每次游泳时间间隔≥10 min。(2)空间探索试验。于第5天撤去平台,将大鼠从同一位点放入水中,记录大鼠120 s 内跨越原平台次数以及首次跨越原平台时间。
1.2.5 海马组织Nissl染色 行为学实验结束后,每组按随机数字表法取大鼠6 只,腹腔注射10%水合氯醛使其麻醉,使用4%多聚甲醛进行心脏灌流固定后摘取完整大脑,4%多聚甲醛固定24 h 后进行脱水、透明和石蜡包埋,制备常规脑组织石蜡切片,厚4µm。脑组织石蜡切片脱蜡至水,将切片浸入Nissl染色液中室温孵育15 min,蒸馏水冲洗后70%乙醇分色,随后脱水、透明、封片后置于显微镜下观察海马神经元形态结构及数目变化,尼氏小体呈紫色,细胞核呈淡紫色。
1.2.6 海马组织TUNEL染色 将1.2.5制备的脑组织石蜡切片脱蜡至水后滴加TUNEL 反应混合液37 ℃孵育1 min,PBS洗涤后DAB 显色,苏木素衬染细胞核,脱水、透明、封片后置于显微镜下观察细胞染色情况并拍照,TUNEL染色阳性细胞的细胞核呈棕黄色,任选5个视野计数TUNEL染色阳性细胞和总细胞,结果取平均值。以TUNEL 染色阳性细胞数占总细胞数的百分比表示神经元凋亡率(%)。
1.2.7 Western blot 检测海马组织中相关蛋白表达 每组剩余6只大鼠麻醉后处死,小心剥离海马组织,用含蛋白酶抑制剂和磷酸酶抑制剂的裂解液于冰上充分裂解,离心取上清液,BCA法检测蛋白浓度。SDS-PAGE 电泳分离等量变性蛋白(上样量20µg),随后将分离的蛋白转至PVDF膜,5%BSA室温封闭1 h 后于兔抗鼠cleaved caspase-3、Bax、c-Myc、Cyclin D1、t-GSK-3β、p-GSK-3β、t-β-Catenin、p-β-Catenin、GAPDH 一抗稀释液中4 ℃孵育过夜,稀释比例为1∶1 000,PBS洗涤后于对应种属的HRP标记的羊抗兔IgG二抗稀释液中室温孵育1.5 h,稀释比例为1∶20 000,PBS 洗涤后ECL 显色。采用Image J 软件分析蛋白条带灰度值,以目的蛋白与GAPDH灰度值计算目的蛋白相对表达量。
1.3 统计学方法 采用SPSS 25.0 软件分析处理数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠旷场实验行为学比较 与正常组比较,PTSD 组大鼠爬行格数、站立次数和运动总距离减少(P<0.05);与PTSD 组比较,Sal B 低、高剂量组和GSK-3β 抑制剂组爬行格数、站立次数和运动总距离增多(P<0.05);与Sal B低剂量组比较,Sal B高剂量组和GSK-3β 抑制剂组大鼠爬行格数、站立次数和运动总距离增多(P<0.05);Sal B 高剂量组和GSK-3β 抑制剂组大鼠爬行格数、站立次数和运动总距离比较,差异无统计学意义(P>0.05),见表1。
Tab.1 Comparison of the number of crawling cells,standing times and total distance of exercise in open field experiment between the five groups of rats表1 各组大鼠旷场实验中爬行格数、站立次数和运动总距离比较(n=12,)

Tab.1 Comparison of the number of crawling cells,standing times and total distance of exercise in open field experiment between the five groups of rats表1 各组大鼠旷场实验中爬行格数、站立次数和运动总距离比较(n=12,)
**P<0.01;a与正常组比较,b与PTSD 组比较,c与Sal B 低剂量组比较,P<0.05。表2—6同。
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F爬行格数/个76.33±4.68 48.21±3.95a 61.83±4.40b 72.50±4.06bc 69.58±4.12bc 82.233**站立次数/次14.25±1.46 5.17±0.85a 9.08±1.02b 12.47±1.25bc 11.67±1.18bc 108.915**运动总距离/cm 2 436.18±90.29 1 059.67±52.43a 1 836.29±71.85b 2 345.35±83.86bc 2 308.42±89.27bc 635.255**
2.2 各组大鼠Morris水迷宫实验行为学比较 与正常组比较,PTSD 组大鼠逃避潜伏期、首次跨越原平台时间延长,跨越原平台次数减少(P<0.05);与PTSD 组比较,Sal B 低、高剂量组和GSK-3β 抑制剂组大鼠逃避潜伏期、首次跨越原平台时间缩短,跨越原平台次数增多(P<0.05);与Sal B低剂量组比较,Sal B 高剂量组和GSK-3β 抑制剂组大鼠逃避潜伏期、首次跨越原平台时间缩短,跨越原平台次数增多(P<0.05);Sal B高剂量组和GSK-3β抑制剂组大鼠逃避潜伏期、首次跨越原平台时间和跨越原平台次数比较,差异无统计学意义(P>0.05),见表2、3。
Tab.2 Comparison of escape latency in Morris water maze experiment between the five groups of rats表2 各组大鼠Morris水迷宫实验中逃避潜伏期比较(n=12,s,)

Tab.2 Comparison of escape latency in Morris water maze experiment between the five groups of rats表2 各组大鼠Morris水迷宫实验中逃避潜伏期比较(n=12,s,)
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F 1 d 31.59±4.42 75.64±6.83a 56.78±5.97b 43.15±5.62bc 46.06±4.98bc 104.545**2 d 23.47±4.03 70.95±6.92a 49.26±5.84b 35.24±5.16bc 37.58±5.34bc 126.256**组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F 3 d 15.26±3.15 67.08±6.54a 41.65±5.23b 30.57±4.31bc 33.19±4.58bc 182.284**4 d 8.95±2.64 61.24±6.71a 33.17±4.38b 24.97±3.97bc 27.12±3.65bc 217.942**
Tab.3 Comparison of the times of crossing the original platform and the time of crossing the original platform for the first time in Morris water maze experiment between the five groups of rats表3 各组大鼠Morris水迷宫实验中跨越原平台次数和首次跨越原平台时间比较 (n=12,)
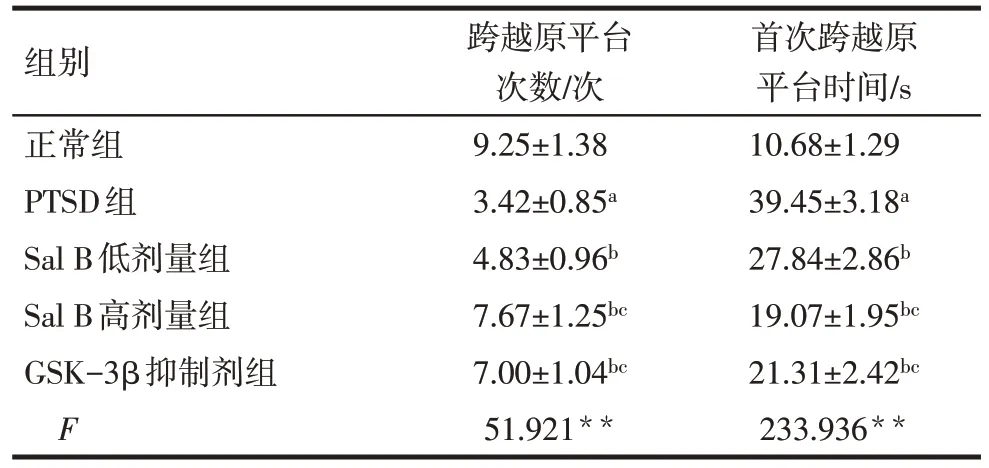
Tab.3 Comparison of the times of crossing the original platform and the time of crossing the original platform for the first time in Morris water maze experiment between the five groups of rats表3 各组大鼠Morris水迷宫实验中跨越原平台次数和首次跨越原平台时间比较 (n=12,)
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F跨越原平台次数/次9.25±1.38 3.42±0.85a 4.83±0.96b 7.67±1.25bc 7.00±1.04bc 51.921**首次跨越原平台时间/s 10.68±1.29 39.45±3.18a 27.84±2.86b 19.07±1.95bc 21.31±2.42bc 233.936**
2.3 各组大鼠海马神经元病理学变化 Nissl 染色后光镜下可见正常组大鼠海马神经元轮廓清晰,排列整齐,染色均匀,核大而圆,尼氏小体丰富;与正常组比较,PTSD 组大鼠海马神经元受损,表现为外形不规则、排列紊乱且存在不同程度萎缩以及尼氏小体数量减少等;与PTSD 组比较,Sal B 低剂量组、Sal B 高剂量组和GSK-3β 抑制剂组大鼠海马神经元损伤均有不同程度改善,其中Sal B 高剂量组和GSK-3β 抑制剂组大鼠海马神经元损伤改善程度几乎相近,且均优于Sal B低剂量组,见图1。

Fig.1 Pathological changes of hippocampal neurons in each group(Nissl staining,×200)图1 各组大鼠海马神经元病理学变化(Nissl染色,×200)
2.4 各组大鼠海马神经元凋亡率以及海马组织中凋亡相关蛋白表达水平比较 与正常组比较,PTSD组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3 蛋白表达水平升高(P<0.05);与PTSD 组比较,Sal B 低剂量组、Sal B 高剂量组和GSK-3β 抑制剂组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3 蛋白表达水平降低(P<0.05);与Sal B低剂量组比较,Sal B高剂量组和GSK-3β 抑制剂组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3 蛋白表达水平降低(P<0.05);Sal B高剂量组和GSK-3β抑制剂组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3 蛋白表达水平比较,差异无统计学意义(P>0.05),见图2、3,表4。

Fig.2 Apoptosis of hippocampal neurons in each group(TUNEL staining,×200)图2 各组大鼠海马神经元凋亡情况(TUNEL染色,×200)
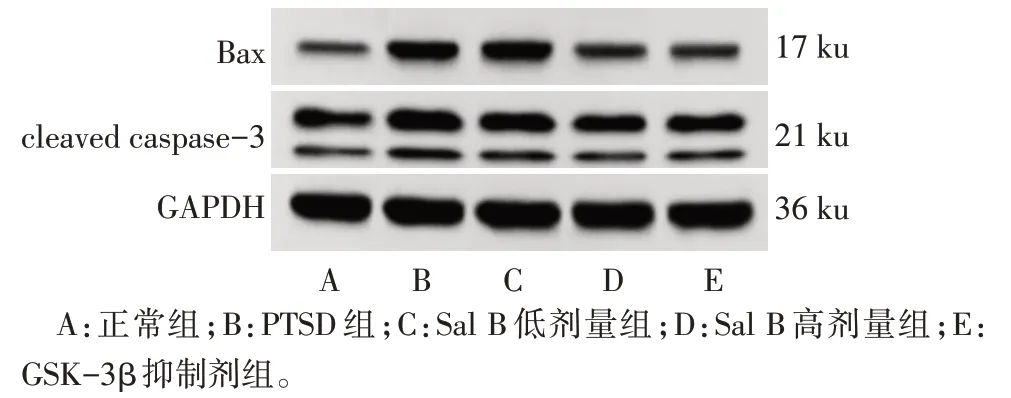
Fig.3 The expression of Bax and cleaved caspase-3 protein in hippocampus of each group detected by Western blot assay图3 Western blot检测各组大鼠海马组织中Bax、cleaved caspase-3蛋白表达
Tab.4 Comparison of apoptosis rate of hippocampal neurons and expression levels of Bax and cleaved caspase-3 in hippocampal tissue between the five groups of rats表4 各组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3蛋白表达水平比较(n=6,)
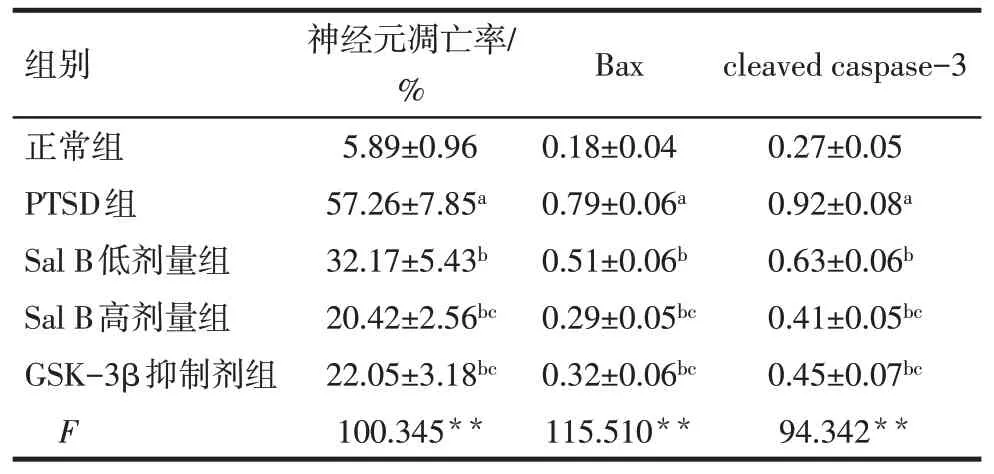
Tab.4 Comparison of apoptosis rate of hippocampal neurons and expression levels of Bax and cleaved caspase-3 in hippocampal tissue between the five groups of rats表4 各组大鼠海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3蛋白表达水平比较(n=6,)
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F神经元凋亡率/%5.89±0.96 57.26±7.85a 32.17±5.43b 20.42±2.56bc 22.05±3.18bc 100.345**Bax 0.18±0.04 0.79±0.06a 0.51±0.06b 0.29±0.05bc 0.32±0.06bc 115.510**cleaved caspase-3 0.27±0.05 0.92±0.08a 0.63±0.06b 0.41±0.05bc 0.45±0.07bc 94.342**
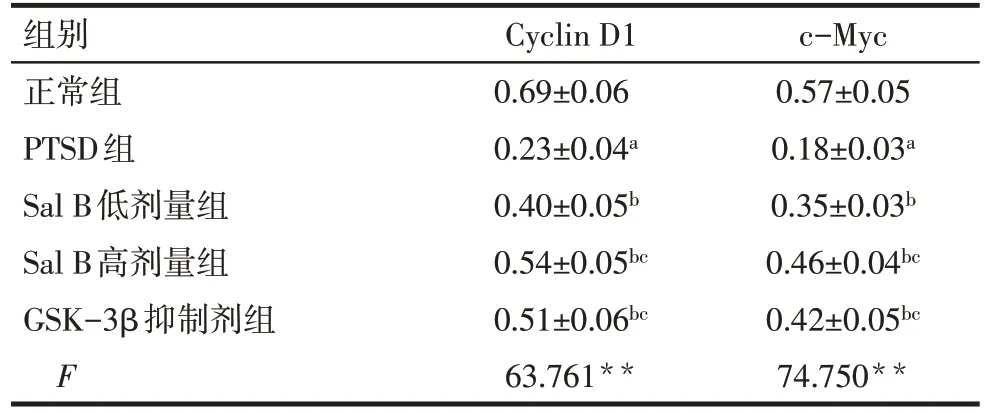
2.5 各组大鼠海马组织中细胞周期调节因子Cyclin D1、c-Myc 蛋白表达水平比较 与正常组比较,PTSD 组大鼠海马组织中Cyclin D1、c-Myc 蛋白表达水平降低(P<0.05);与PTSD 组比较,Sal B 低剂量组、Sal B 高剂量组和GSK-3β 抑制剂组大鼠海马组织中Cyclin D1、c-Myc 蛋白表达水平升高(P<0.05);与Sal B 低剂量组比较,Sal B 高剂量组和GSK-3β抑制剂组海马组织中Cyclin D1、c-Myc蛋白表达水平升高(P<0.05);Sal B 高剂量组和GSK-3β抑制剂组海马组织中Cyclin D1、c-Myc 蛋白表达水平比较,差异无统计学意义(P>0.05),见图4,表5。
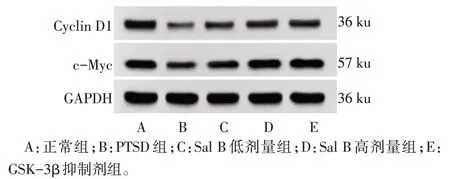
Fig.4 The expression of Cyclin D1 and c-Myc protein in hippocampal tissue of rats in each group detected by Western blot assay图4 Western blot检测各组大鼠海马组织中Cyclin D1、c-Myc蛋白表达
Tab.5 Comparison of protein expression levels of c-Myc and Cyclin D1 in hippocampal tissue between the five groups of rats表5 各组大鼠海马组织中c-Myc、Cyclin D1蛋白表达水平比较(n=6,)
Tab.5 Comparison of protein expression levels of c-Myc and Cyclin D1 in hippocampal tissue between the five groups of rats表5 各组大鼠海马组织中c-Myc、Cyclin D1蛋白表达水平比较(n=6,)
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F Cyclin D1 0.69±0.06 0.23±0.04a 0.40±0.05b 0.54±0.05bc 0.51±0.06bc 63.761**c-Myc 0.57±0.05 0.18±0.03a 0.35±0.03b 0.46±0.04bc 0.42±0.05bc 74.750**
2.6 各组大鼠海马组织中GSK-3β/β-Catenin 信号通路关键蛋白表达水平比较 与正常组比较,PTSD组大鼠海马组织中t-GSK-3β、p-β-Catenin 蛋白表达水平升高,p-GSK-3β、t-β-Catenin 蛋白表达水平降低(P<0.05);与PTSD组比较,Sal B低剂量组、Sal B 高剂量组和GSK-3β 抑制剂组大鼠海马组织中t-GSK-3β、p-β-Catenin 蛋白表达水平降低,p-GSK-3β、t-β-Catenin 蛋白表达水平升高(P<0.05);与Sal B 低剂量组比较,Sal B 高剂量组和GSK-3β抑制剂组大鼠海马组织中t-GSK-3β、p-β-Catenin 蛋白表达水平降低,p-GSK-3β、t-β-Catenin 蛋白表达水平升高(P<0.05);Sal B高剂量组和GSK-3β抑制剂组大鼠海马组织中t-GSK-3β、p-GSK-3β、t-β-Catenin、p-β-Catenin 蛋白表达水平比较,差异无统计学意义(P>0.05),见图5,表6。
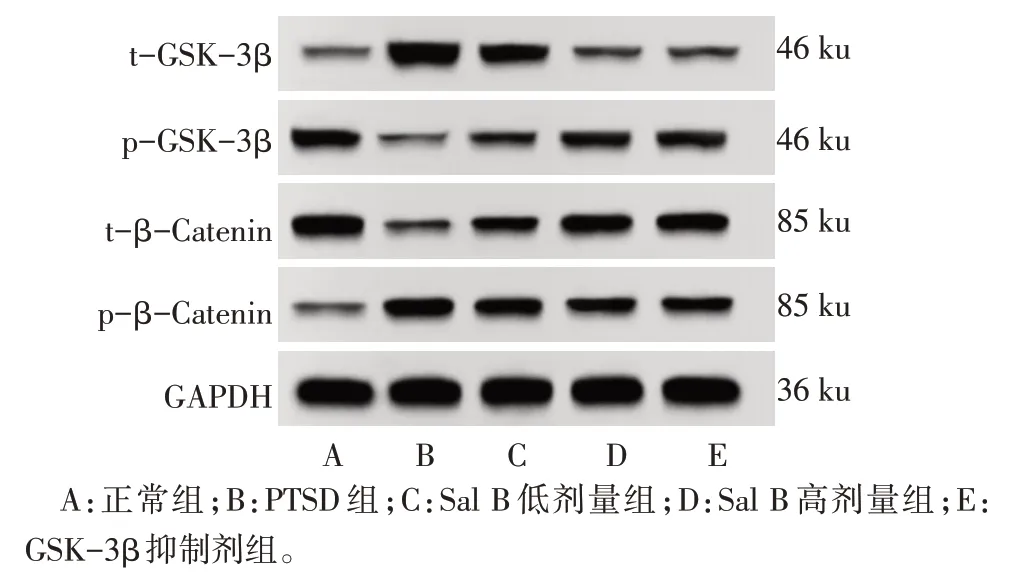
Fig.5 The expression of t-GSK-3β,p-GSK-3β,t-β-Catenin and pβ-Catenin in hippocampal tissue of rats in each group detected by Western blot assay图5 Western blot检测各组大鼠海马组织中t-GSK-3β、p-GSK-3β、t-β-Catenin、p-β-Catenin蛋白表达情况
Tab.6 Comparison of protein expression levels of t-GSK-3β,p-GSK-3β,t-β-Catenin and p-β-Catenin in hippocampal tissue between the five groups of rats表6 各组大鼠海马组织中t-GSK-3β、p-GSK-3β、t-β-Catenin、p-β-Catenin蛋白表达水平比较(n=6,)

Tab.6 Comparison of protein expression levels of t-GSK-3β,p-GSK-3β,t-β-Catenin and p-β-Catenin in hippocampal tissue between the five groups of rats表6 各组大鼠海马组织中t-GSK-3β、p-GSK-3β、t-β-Catenin、p-β-Catenin蛋白表达水平比较(n=6,)
组别正常组PTSD组Sal B低剂量组Sal B高剂量组GSK-3β抑制剂组F t-GSK-3β 0.15±0.03 0.78±0.06a 0.54±0.05b 0.37±0.04bc 0.34±0.04bc p-GSK-3β 0.61±0.05 0.18±0.03a 0.35±0.04b 0.45±0.04bc 0.47±0.05bc t-β-Catenin 0.79±0.05 0.23±0.04a 0.51±0.05b 0.65±0.05bc 0.66±0.06bc p-β-Catenin 0.18±0.03 0.67±0.06a 0.49±0.05b 0.35±0.04bc 0.33±0.05bc 165.088**83.802**107.528**92.378**
3 讨论
有循证依据的心理疗法是PTSD 的一线治疗方法,认知行为疗法是其主要疗法,包括延长暴露(实地暴露和想象暴露)、认知加工疗法、眼动脱敏和再加工等。血清素再摄取抑制剂是PTSD 的一线治疗药物,通常与其他治疗干预措施联合使用[3]。但现有的治疗方式周期长、见效慢,用于PTSD 临床治疗的药物仍十分有限,且存在不良反应。因此,进一步探究PTSD发病机制并开发新的PTSD治疗药物具有重大意义。基于动物模型寻找治疗药物或治疗靶点是PTSD 研究的一大热点[13-14]。本研究通过SPS 法构建了PTSD 大鼠模型,结果显示,相比于正常饲养大鼠,PTSD模型大鼠爬行格数、站立次数、运动总距离、跨越原平台次数减少,逃避潜伏期、首次跨越原平台时间延长,表明模型大鼠自主活动能力、探索行为能力和学习记忆能力受到损害,即存在一定认知功能障碍。此外,海马与PTSD认知功能障碍的发生发展关系密切,且海马神经元凋亡、损伤也是PTSD模型中神经病理学变化的主要特征[15-16]。本研究中,Nissl 染色后观察可见PTSD 模型大鼠海马神经元严重受损;此外,海马神经元凋亡率以及海马组织中促凋亡蛋白Bax、cleaved caspase-3 表达水平升高,而细胞周期调节因子Cyclin D1、c-Myc蛋白表达水平降低,表明PTSD 模型大鼠存在海马神经元凋亡、损伤等病理变化,与既往研究结果[15-16]一致。同时以上研究结果提示PTSD大鼠模型构建成功,可用于药物治疗效果研究。
近年来,中医药用于PTSD 治疗受到广泛关注。Sal B 作为一种来源于丹参干燥根和根茎的重要天然产物,既是丹参的主要生物活性成分之一,也是Sal类的代表成分,其抗氧化[17]、抗癌[18]、抗神经元凋亡[19]等作用已被证实。本研究结果显示,给予10 mg/kg、20 mg/kg Sal B 治疗后,PTSD 模型大鼠自主活动能力、探索行为能力、学习记忆能力以及海马神经元损伤程度均有所改善,同时海马神经元凋亡率以及海马组织中Bax、cleaved caspase-3 蛋白表达降低,Cyclin D1、c-Myc蛋白表达水平升高,且20 mg/kg的作用效果优于10 mg/kg。Sal B 能够减轻PTSD 模型大鼠海马神经元凋亡、损伤并改善大鼠认知功能障碍。Yu 等[20]研究显示Sal B 可通过激活AKT/CREB/BDNF 信号通路在戊四唑诱导的癫痫大鼠模型中发挥抗惊厥和抗细胞神经元凋亡作用。Zhao等[21]研究表明,Sal B能够通过抑制氧化应激和恢复线粒体功能来防止1-甲基-4-苯基吡啶(MPP+)诱导的神经元损伤。但Sal B在PTSD模型大鼠中的作用机制仍有待明确。
研究证实,脑内GSK-3β/β-Catenin 信号通路调控异常与阿尔茨海默病[22]、帕金森病[23]等神经退行性疾病的发生和病情进展密切相关,且抑制GSK-3β 活性可改善由多种疾病引起的认知功能障碍[24-25]。GSK-3β/β-Catenin 信号通路中,GSK-3β、β-Catenin均在胞质中以磷酸化和非磷酸化2种形式存在,GSK-3β 磷酸化后活性受到抑制,失活的GSK-3β不能再使β-Catenin磷酸化,导致β-Catenin在胞质内大量聚集并进入细胞核,进而启动细胞增殖、分化等相关基因转录,如Cyclin D1、c-Myc等[26]。本研究显示,PTSD模型大鼠海马中t-GSK-3β、p-β-Catenin 蛋白表达水平升高,p-GSK-3β、t-β-Catenin蛋白表达水平降低,表明海马中GSK-3β/β-Catenin信号通路参与PTSD 发生。而给予Sal B 治疗后,PTSD 模型大鼠海马中t-GSK-3β、p-β-Catenin 蛋白表达水平降低,p-GSK-3β、t-β-Catenin 蛋白表达水平升高,提示Sal B 可能通过降低PTSD 模型大鼠海马中GSK-3β 活性,增加β-Catenin 活性,进而诱导Cyclin D1、c-Myc 蛋白表达,同时抑制Bax、cleaved caspase-3 蛋白表达,发挥促进神经元存活、分化以及抑制其凋亡作用。据报道,Sal B可通过激活Wnt/β-catenin 信号通路减少神经元凋亡并促进神经元存活,从而在脊髓损伤大鼠模型中发挥神经保护作用[27]。CHIR-99021既是一种高度特异性、安全且有效的GSK-3β 抑制剂,也是一种有效的Wnt/β-Catenin 信号通路激活剂[28-29]。本研究显示,CHIR-99021 对PTSD 模型大鼠海马中GSK-3β/β-Catenin信号通路以及神经元凋亡、损伤和认知功能障碍的作用效果接近于20 mg/kg Sal B,并优于10 mg/kg Sal B。这进一步证实了Sal B减轻PTSD模型大鼠海马神经元凋亡、损伤并改善认知功能障碍的作用机制与调节GSK-3β/β-Catenin信号通路有关。
综上所述,Sal B 能够减轻PTSD 模型大鼠海马神经元凋亡、损伤并改善认知功能障碍,抑制GSK-3β/β-Catenin 信号通路,且调节GSK-3β/β-Catenin信号通路可能是其作用机制之一(图6)。本研究为PTSD防治提供了新的见解,但存在指标检测方法单一等局限性,有待后续进一步补充与完善。

Fig.6 Signal path diagram of Sal B图6 Sal B的信号通路图
