奥曲肽修饰的壳聚糖纳米递送分子信标成像肺癌研究
2024-01-15马雪吴婧张红丽李勇宋娟李源丽鲁亮朱海振
马雪,吴婧,张红丽,李勇,宋娟,李源丽,鲁亮,朱海振△
在我国肺癌发病率及病死率处于恶性肿瘤之首[1],早期诊断是改善患者预后的关键。微小RNA(microRNA,miRNA)在促进肿瘤发生、侵袭、转移等恶性生物学行为中发挥重要作用,其中miR-155 在肺癌患者癌组织及血清中均高表达并参与肺癌的发生发展,可能成为肺癌早期诊断的分子靶标[2]。分子信标(molecular beacon,MB)技术对检测DNA、RNA和miRNA具有高度敏感性[3]。但MB需要合适的载体才能进入细胞,壳聚糖(chitosan,CS)纳米已被作为理想的基因载体广泛应用于细胞和动物实验[4]。现有研究表明癌细胞表面存在着多种特异性抗原或受体,可被用来精准识别癌细胞[5]。其中典型的有生长抑素受体(somatostatin receptor,SSTR),在肺癌中SSTR2 广泛高表达[6]。奥曲肽(octreotide,OCT)是一种人工合成的生长抑素,可以和SSTR2进行特异性牢固结合。本团队前期已合成了OCT修饰的CS MB 纳米(CS-MB-OCT),在A549、SPC-A1 等肺癌细胞水平上实现了检测肿瘤中的miR-155并成像肺癌细胞[7]。本研究拟采用CS-MB-OCT 在动物水平上识别miR-155 并成像肺癌,以期为肺癌早诊提供新思路,并为临床前验证奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 28只8周龄雌性SPF级裸鼠购自北京维通利华公司,体质量18~20 g,动物生产许可证号:SCXK(京)2021-0020,63 只8 周龄Lox-Stop-lox K-rasG12D(LSL K-rasG12D)转基因雌性SPF 级小鼠由陆军军医大学肿瘤研究所赠予,体质量20~24 g,动物生产许可证号:SCXK(渝)2021-0052。裸鼠和小鼠均饲养于贵州中医药大学SPF级动物中心[动物使用许可证号:SYXK(黔)2021-0005],温度21~24 ℃,湿度55%~60%,动物自由获取食物和水。本研究经贵州中医药大学伦理委员会批准(伦理号:2021 伦审第032号),均按照伦理委员会要求进行动物研究。
1.1.2 主要试剂与仪器 人肺腺癌A549细胞购自美国典型菌种保藏中心;SSTR2 兔单克隆抗体(美国santa cruz 公司);OCT(上海吉尔生化有限公司),miR-155 MB(上海生工生物工程股份有限公司);Cre 腺病毒(深圳百恩维公司);实时荧光定量PCR 试剂盒(日本TaKaRa 公司);CS 纳米(四川广汉恒宇新材料有限公司);辣根过氧化物酶标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司);U6、miR-155 引物套装(广州锐博生物有限公司)。SP5 激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM,德国莱卡公司);小动物活体体内成像系统(in vivo imaging system spectrum,IVIS spectrum,美国Caliper Life Sciences公司)。
1.2 方法
1.2.1 细胞培养和动物模型构建 人肺腺癌A549细胞使用RPMI-1640培养基于37 ℃、5%CO2孵箱中培养。采用随机数字表法对裸鼠及转基因小鼠进行分组。随机抽取7只裸鼠使用戊巴比妥钠麻醉后,通过尾静脉注入1×106个A549细胞建立裸鼠肺移植瘤模型。4 周后脱颈处死小鼠,取肺组织,经4%甲醛固定后制作4 µm 石蜡切片,行HE 染色观察及SSTR2表达检测。LSL K-rasG12D转基因小鼠通过鼻腔滴入分泌Cre酶的腺病毒后,根据滴入腺病毒后作用时间的不同,可动态展示从正常肺组织到肺的非典型增生、腺瘤、原位癌、肺腺癌的不同病变阶段[8]。随机抽取28只转基因小鼠,鼻腔缓慢滴入5×109PFU 的腺病毒,在滴入腺病毒后4、6、8、12 周分别处死7只小鼠,建立不同病变时期肺腺癌模型;取一侧肺组织制作石蜡切片,行HE染色及SSTR2表达检测,另一侧肺组织液氮冻存后检测miR-155表达。
1.2.2 免疫组化染色检测SSTR2 表达 肺移植瘤模型及转基因小鼠的不同病变时期肺组织蜡块切片脱蜡,过氧化氢封闭,高压修复,滴加1∶200 的STRR2 一抗,4 ℃过夜,滴加二抗,DAB 显色,封片。免疫组化染色检测SSTR2 在肺移植瘤组织及不同病变时期肺肿瘤组织的表达。
1.2.3 实时荧光定量PCR检测miR-155的表达 使用Trizol试剂提取不同病变时期转基因小鼠模型肺组织中的总RNA,逆转录成cDNA,实时荧光定量PCR 检测miR-155 的表达变化。反应体系:cDNA模板2µL,荧光染料0.4µL,上、下游引物各0.8 µL,Taq Ⅱ聚合酶10 µL,灭菌水6 µL,共20 µL。95 ℃预变性30 s,1个循环,PCR反应:95 ℃5 s,60 ℃34 s,40个循环。以U6 为内参,采用2-ΔΔCt法计算不同病变时期转基因小鼠肺组织中miR-155的表达变化。
1.2.4 CS-MB-OCT合成 根据人及小鼠miR-155序列(http://www.mirbase.org/)设计并合成Hsa-miR-155 MB(5'-Cy5-CCAGCG-ACC+CCT+ATCA+CGAT+TAGCATTAA-CGCTGGBHQ2-3')和Mmu-miR-155 MB(5'-Cy5-CCAGCG-ACC+CCT+ATCA+CAAT+TAGCATTAA-CGCTGG-BHQ2-3'),Cy5表示荧光基团,BHQ2表示淬灭基团,+N表示碱基进行了锁核酸修饰,下划线处为茎干结构。同时根据前期研究方法,制备CS-MBOCT[7]。
1.2.5 肺移植瘤裸鼠模型活体成像 剩余21只裸鼠随机抽取14 只,再次建立肺移植瘤模型后戊巴比妥钠麻醉,7 只裸鼠尾静脉内注射100µL未经OCT修饰的CS-miR-155-MB,7只裸鼠注射OCT修饰的CS-miR-155-MB-OCT。7只未造模裸鼠作为对照组,尾静脉注射100 µL CS-miR-155-MBOCT。MB 终浓度为2µmol/L。2 h 后置于IVIS 平台,活体成像仪检测肺部荧光信号及荧光强度。活体成像后,脱颈处死裸鼠并取肺组织再次成像,成像后制成肺部冰冻切片,多聚甲醛固定,4',6-二脒基-2-苯基吲哚(DAPI)染细胞核,CLSM检测荧光信号来源。
1.2.6 转基因小鼠模型活体成像 随机选取剩余的35只转基因小鼠,再次建立4、6、8、12周组不同病变时期转基因小鼠模型,每组7 只,同时取未滴入Cre 酶的正常7 只转基因小鼠为对照组,戊巴比妥钠麻醉各组小鼠后,脱毛膏胸部体毛脱毛,尾静脉分别注射100µL CS-miR-155-MB-OCT,MB终浓度为2µmol/L。2 h 后置于IVIS 平台,活体成像仪检测肺部荧光信号及荧光强度。活体成像后,脱颈处死转基因小鼠并取肺组织再次成像,成像后制成肺部冰冻切片,多聚甲醛固定,DAPI染细胞核,CLSM检测荧光信号来源。
1.3 统计学方法 采用SPSS 17.0 软件进行数据分析,计量资料用表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理改变 HE 染色结果显示,在裸鼠肺移植瘤模型中可见大小不等的肺腺癌肿瘤细胞种植结节;转基因小鼠模型中,在滴入腺病毒后的4、6、8、12 周的肺组织内可观察到非典型增生、腺瘤、原位癌、肺腺癌的不同病理学表现,见图1。
2.2 SSTR2 的表达 免疫组化染色发现在肺移植瘤组织及转基因小鼠肺癌模型不同病变时期肺组织的细胞膜和细胞浆均表达SSTR2,见图2。
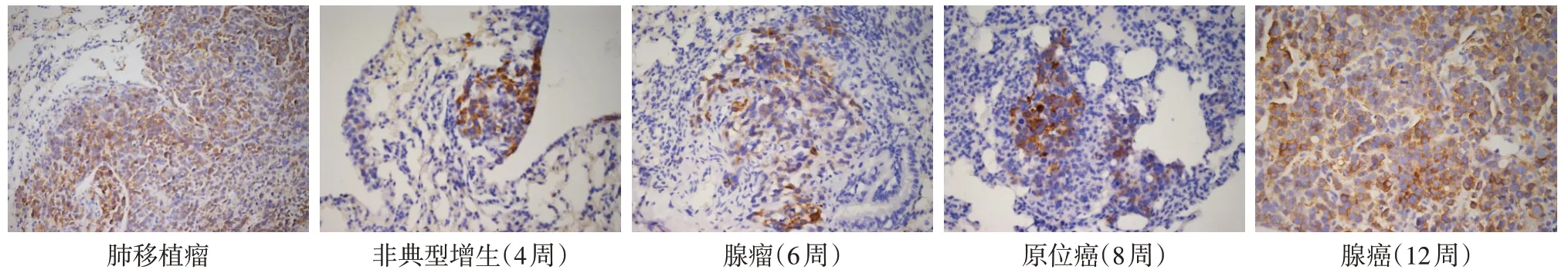
Fig.2 Expression of SSTR2 in lung transplanted tumor and different pathological stages(IHC staining,×400)图2 肺移植瘤及不同病变时期SSTR2的表达(免疫组化染色,×400)
2.3 miR-155 在不同病变时期转基因小鼠中的表达 对照组、4周组、6周组、8周组、12周组miR-155的相对表达量分别为1.08±0.04、11.11±1.69、17.40±1.56、24.37±1.58、32.76±2.16,各组间比较差异有统计学意义(n=7,F=414.829,P<0.05),随着疾病进展,miR-155表达逐渐增加(P<0.05)。
2.4 CS-MB 及CS-MB-OCT 对肺移植瘤裸鼠模型中miR-155 的识别成像功能 活体成像仪检测发现,CS-miR-155-MB-OCT 组荧光信号更强,而对照组未检测到荧光信号(图3A)。对照组、CS-miR-155-MB组、CS-miR-155-MB-OCT 组荧光强度分别为1.86±0.46、22.38±2.21、68.23±2.98,与CS-miR-155-MB组比较,CS-miR-155-MB-OCT 组荧光强度更强(n=7,F=32.693,P<0.05)。分离肺组织后,活体成像仪检测表明荧光信号来自肺组织,且CS-miR-155-MB-OCT 组信号更强,而对照组未检测到荧光信号(图3B)。再次将肺组织制成冰冻切片,CLSM检测发现荧光信号大部分来自肿瘤细胞,CS-miR-155-MB-OCT 组荧光信号最强,大部分定位在细胞浆,小部分定位在细胞核,见图4。
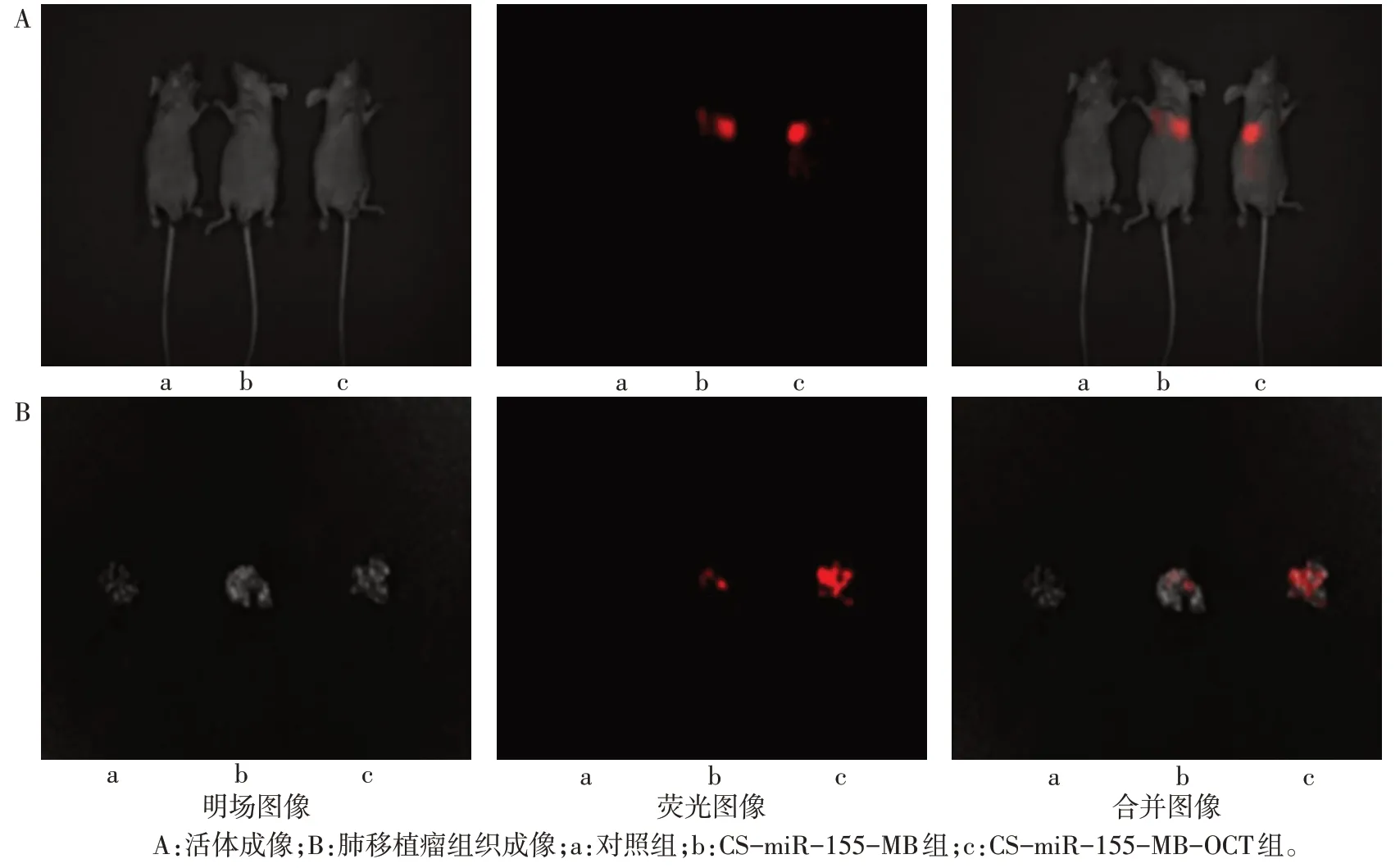
Fig.3 Detection of nanoparticles for miR-155 recognition and fluorescence intensity analysis by living imaging system in lung xenograft models图3 肺移植瘤模型中活体成像系统检测纳米粒对miR-155的识别及荧光强度分析
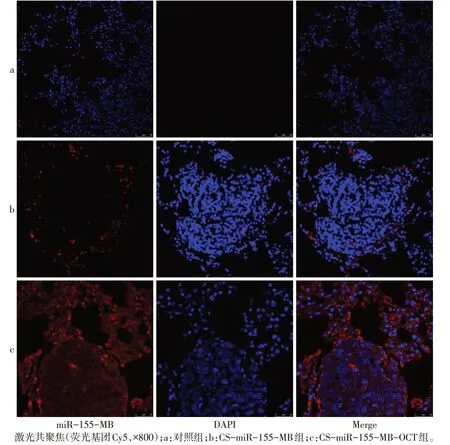
Fig.4 The source of fluorescence signals detected by confocal laser scanning microscope in lung xenograft models图4 肺移植瘤模型中激光共聚焦检测荧光信号来源
2.5 CS-miR-155-MB-OCT 对转基因小鼠肺组织中miR-155的识别 转基因小鼠模型不同病变时期小鼠肺内可检测到不同强度的荧光信号,且随着肺癌疾病的发展,信号逐渐增强,而对照组未检测到荧光信号,4 周组未检测到明显的荧光信号(图5A)。对照组,4、6、8、12 周组荧光强度分别为2.56±0.60、14.62±2.02、22.26±2.18、29.26±1.41、38.24±1.22,各组间比较差异有统计学意义(n=7,F=516.444,P<0.05),而且荧光强度趋势和miR-155表达趋势一致。将肺组织体内取出后再次成像后发现荧光信号来自肺组织(图5B),将转基因小鼠肺组织制成冰冻切片,CLSM发现荧光信号来自肿瘤细胞及部分正常肺泡上皮细胞,见图6。

Fig.5 Nanoparticles for miR-155 recognition imaging function and fluorescence intensity analysis detected by the living imaging system in transgenic mouse models图5 转基因小鼠模型中活体成像系统检测纳米粒对miR-155的识别成像功能及荧光强度分析

Fig.6 The source of fluorescence signals detected by confocal laser scanning microscope in transgenic mouse model图6 转基因小鼠模型中激光共聚焦检测荧光信号来源
3 讨论
肺癌的发病率和病死率近年来一直持续增长,且患者生存期短,严重威胁人类健康[9]。肺癌早期诊断可大大提高患者总生存期[10]。目前肺癌早期诊断手段有呼吸气体检测、胸部CT、基因测序、肿瘤标志物检测等,但都有一定局限性[11-13]。肺癌早期诊断的研究需要建立合适的动物模型。肿瘤细胞经尾静脉注射后,先通过肺部的毛细血管网进入血液循环,由于肿瘤细胞黏稠并易聚团,会首先积聚在小鼠肺部微血管,并形成肺转移。本研究通过注射A549肺腺癌细胞后4周,HE染色结果表明肺内可观察到大小不等的肺移植瘤结节,表明肺移植瘤肺腺癌模型建模成功。本研究所使用的LSL K-rasG12D转基因小鼠有一个K-rasG12D 突变位点,在无Cre 酶诱导的情况下不表达K-ras,不会产生肿瘤。一旦给予小鼠鼻腔吸入分泌Cre酶的腺病毒,表达的Cre酶将会在DNA 水平特异性切除LSL 元件并诱导突变的K-ras 基因持续表达,导致小鼠肺癌的发生,且肺癌发生率为100%[14]。通过控制滴入病毒的滴度及病变发展时间,可以动态地研究肺癌的发生、发展过程,为肺癌的早期诊断提供了理想的生物平台模式。本研究HE 染色发现在滴入分泌Cre 酶的腺病毒后的4、6、8、12周,转基因小鼠肺组织内可观察到非典型增生、腺瘤、原位癌、肺腺癌的不同病理学表现,表明成功建立了肺癌发生、发展的不同病变时期的转基因小鼠模型。
miR-155 高表达可促进肺癌的发生、发展及扩散[15-16]。MB是一种茎环结构的寡核苷酸序列,在自然状态下其本身不产生荧光,但当有靶DNA、RNA或miRNA 存在时,MB 可与之杂交结合并产生强烈的荧光信号。MB非常灵敏,即使靶基因有一个碱基存在差异,MB 也不会与之杂交及产生荧光信号;且分子信标与靶基因结合牢固,可用于检测并成像miRNA[17]。MB中部分碱基经过锁核酸修饰,和靶基因结合后具有不可逆性,杂交能力更强,且耐高温及抗核酸酶降解。MB 设计的原则为:环状区一般由15~30个核苷酸组成,避免同源杂交,茎干区一般由5~8 个碱基对组成,G、C 含量在70%~80%,连接荧光基团的末端最好不用G,荧光基团需要能被淬灭基团特异性淬灭[18]。但MB需要合适的载体才能够进入细胞。CS 为带正电的天然多糖,而碱基带负电,两者可通过静电作用自组装形成稳定的核壳结构,已被广泛用于介导基因转染,且具有较高的安全性和有效性[19]。SSTR 显像技术因可利用OCT 和肿瘤表面的SSTR 发生特异性结合,已被用于检测肺癌、前列腺癌、乳腺癌SSTR 表达[20-22]。本团队前期基于以上研究设计并合成了CS-MB-OCT[7]。本研究免疫组化染色结果表明,在肺移植瘤及不同病变时期的转基因小鼠模型病变组织中均表达SSTR2,提示可利用OCT与SSTR2特异性结合达到识别成像肿瘤的目的。且随着肺癌病变进展,miR-155 表达依次增加,可作为分子靶标进行示踪、成像。
因裸鼠可排除小鼠体毛对MB Cy5荧光的影响,故本研究先选用相对简单的裸鼠肺移植瘤模型进行研究。在肺移植瘤模型中,活体成像仪检测发现对照组未检测到荧光信号,和未经OCT 修饰的CS-miR-155 MB 组相比,CS-miR-155-MB-OCT 组荧光信号更强,表明OCT可以和SSTR2特异性结合,促使更多的CS-miR-155-MB-OCT 进入细胞,更易于早期识别成像肺癌细胞,且产生的荧光信号更强。在转基因小鼠模型中,因小鼠黑色体毛对Cy5 荧光有遮挡作用,故使用脱毛膏进行胸部体毛脱毛。活体成像仪检测发现尾静脉注入CS-miR-155-MB-OCT后,未进行腺病毒滴入的无肺部病变的转基因小鼠肺内未检测到荧光信号,4 周组非典型增生阶段未检测到明显的荧光信号,但可测量到明显的荧光强度,仍需进一步研究以增加成像灵敏性;其余不同病变时期转基因小鼠肺内可检测到不同强度的荧光信号,且随着肺癌的发展,荧光信号逐渐增强。且荧光强弱与miR-155的表达趋势较一致。本研究实现了通过识别成像miR-155 进而成像肺癌细胞,并可通过不同的荧光强度反映肺癌发生、发展的各个阶段。
综上,本研究利用纳米和MB技术合成CS-MBOCT,在动物实验上实现了根据产生的荧光强度变化观察肺癌的发生、发展,为肺癌的早诊提供新技术,并为后续可能的临床前研究奠定基础。
