气道类器官研究哮喘中Lkb1调控上皮再生的机制
2024-01-15徐桂颖李玉李雪刘怡萌陈怀永
徐桂颖,李玉,李雪,刘怡萌,陈怀永,△
支气管哮喘是一种常见的慢性呼吸道疾病,其主要病理特征包括气道炎症反应、杯状细胞增多、气道上皮损伤、平滑肌增生等[1-2]。其中,气道上皮损伤是哮喘最重要的病理特征,表现为呼吸道上皮细胞间连接结构受损、气道上皮细胞大量死亡,从而导致气道的屏障功能被破坏[3-4]。气道上皮大量损伤后依赖于气道祖细胞再生来修复受损的气道结构。Club细胞是一种气道祖细胞,大量分布于气道上皮,可增殖并分化为杯状细胞和纤毛细胞[5]。气道上皮受到损伤后,Club 细胞通过其增殖和分化功能对其进行修复[6-7],在气道上皮修复再生中发挥重要作用。许多呼吸系统疾病的发生与气道祖细胞的功能异常密切相关,因此,气道祖细胞再生功能必须受到严格调控。肝激酶B1(liver kinase B1,Lkb1)参与多种生物学过程的调控,如组织稳态[8]、干细胞功能[9]、能量代谢[10]等,是细胞中与代谢反应相关的重要调节因子。既往研究表明,在成年小鼠中敲除Lkb1后,小鼠体内的造血干细胞的再生能力显著降低且数量明显减少[11]。Lkb1还参与调控肝细胞增殖以控制肝脏再生[12]。小鼠的卫星细胞缺失Lkb1基因导致该细胞再生能力受损[13]。小鼠胚胎干细胞中敲除Lkb1会导致胚胎发育过程中气道上皮化生受到抑制、小鼠体质量下降和胚胎死亡[14]。然而,肺损伤中Lkb1对成年小鼠气道祖细胞增殖分化功能的调控作用目前尚不清楚。本研究旨在通过体外类器官培养的方法探究Lkb1对成年小鼠气道祖细胞再生功能的调控机制。
1 材料与方法
1.1 主要材料
1.1.1 实验动物Lkb1f/f小鼠来源于中科院上海生化细胞研究所。Scgb1a1CreER小鼠购自The Jackson Laboratory(美国)。Lkb1f/f小鼠与Scgb1a1CreER小鼠杂交数代后获得Club细胞中条件性敲除Lkb1基因的纯合Scgb1a1CreER;Lkb1f/f小鼠。所有小鼠饲养在天津市海河医院SPF 级动物房中,动物使用许可证号:SYXK(津)2021-0002。小鼠饲养严格遵循以下条件:温度20~26 ℃,湿度40%~70%,光照每12 h 循环1 次,鼠粮经60Co 辐射灭菌,小鼠饮用水和垫料经高温高压蒸汽灭菌。选取8~12 周龄,体质量25~30 g 的Lkb1f/f小鼠(对照组)10只和Scgb1a1CreER;Lkb1f/f小鼠(Lkb1敲除组)9只用于实验研究。
1.1.2 实验仪器 荧光倒置显微镜(Olympus),自动组织脱水处理机、组织包埋机、病理切片机(莱卡),全波长读数仪(Thermo),PCR 仪(Bio-Rad),实时荧光定量PCR(RT-PCR)仪(Roche),分选型流式细胞仪(BD Biosciences)。
1.1.3 实验试剂 他莫昔芬(Tamoxifen)、玉米油、鸡卵清蛋白(Ovalbumin,OVA)、氢氧化铝佐剂、二甲基亚砜(DMSO)购自Sigma 公司,柠檬酸盐抗原修复液粉剂购自福州迈新生物技术开发有限公司,正常山羊血清(normal goat serum,NGS)、Hanks 缓冲液购自索莱宝公司,DAPI、SYBR Green PCR 试剂盒购自Roche 公司,鼠源CYP2F2 一抗购自Santa Cruz Biotechnology 生物科技有限公司,腺苷酸活化蛋白激酶(AMPK)激活剂AICAR、兔源钙激活氯离子通道蛋白3(CLCA3)一抗购自Abcam 公司,山羊抗鼠二抗(Alexa Fluor 594®Goat anti-Mouse IgG)、驴抗兔二抗(Alexa Fluor 488®Donkey anti-Rabbit IgG)、Trizol 试剂、胎牛血清(Fetal bovine serum,FBS)、青/链霉素溶液购自Invitrogen公司,荧光封片剂购自Vectorlabs 公司,弹性蛋白酶(Elastase)购自Worthington Biochemical 公司,DMEM/F12 培养基、24 孔Transwell 小室购自Corning 公司,脱氧核糖核酸酶Ⅰ(Deoxyribonuclease Ⅰ,DNase Ⅰ)、HEPES 缓冲液购自Sigma-Aldrich 公司,Matrigel基质胶购自BD Pharmingen,流式抗体PE-CD24、PE-Cy7-EpCAM、APC-Sca-1、CD31、CD34、CD45、Streptavidin 购自eBioscience 公司,小鼠肺成纤维细胞系MLg2908购自美国模式培养物细胞库。
1.2 实验方法
1.2.1 条件性诱导Lkb1基因敲除 2 组小鼠腹腔注射200 mg/kg的他莫昔芬(溶剂为玉米油)诱导Club细胞中Lkb1基因敲除,隔1 d 注射1 次,共注射3 次。在注射完成后让小鼠休息1周使药物充分代谢。
1.2.2 小鼠过敏性哮喘模型的建立 第0 天(D0)和第7 天(D7)腹腔注射100µL OVA(10µg/g,PBS 为溶剂,氢氧化铝为佐剂,配制成质量浓度为100 g/L 的溶液)致敏小鼠;第14—18天连续5 d用2%OVA雾化剂(溶剂为PBS)雾化小鼠,每次30 min,保证雾化过程气雾均匀;于第19天回收小鼠,收集支气管肺泡灌洗液(BALF)及肺组织。
1.2.3 三色染色法计数BALF中炎性细胞数量 将方法1.2.2中获得的BALF 离心(1 000 r/min,15 min),去除上清液后用PBS重悬细胞沉淀,取10µL细胞悬液加台盼蓝溶液按1∶5稀释,用血球计数板计数细胞。剩余细胞悬液涂片晾干用Hema 3染色剂染色,经乙醇脱色后显微镜下观察细胞数量、形态,将细胞分类并计数。
1.2.4 肺组织切片免疫荧光染色 肺组织石蜡切片置于55~60 ℃烤片机上45 min,依次经过二甲苯、无水乙醇、95%乙醇、85%乙醇、75%乙醇、蒸馏水中脱蜡,在煮沸的柠檬酸抗原修复液中修复抗原2 min,冷却至室温;PBS 浸洗,加0.2%Triton X-100/PBS打孔1 h;PBS浸洗后加5%NGS室温封闭1 h,滤纸吸干封闭液后加一抗(CLCA3 和CYP2F2,1∶200稀释于5%NGS)于4 ℃条件下避光孵育过夜;PBS 浸洗后加二抗(驴抗兔二抗和山羊抗鼠二抗,1∶200稀释于5%NGS中)避光室温孵育2 h,PBS 浸洗后加DAPI(1∶1 000 稀释于5%NGS 中)室温避光孵育20 min,PBS 浸洗后加防猝灭封片剂封片。用荧光显微镜对气道区域拍照。
1.2.5 流式细胞术分选原代Club细胞 7.5%水合氯醛麻醉小鼠,打开腹腔,剪断腹主动脉处死小鼠,PBS经心脏灌洗肺脏,取下肺组织,经气管插管灌入弹性蛋白酶消化肺组织,将肺叶剪下切碎,加入DNase Ⅰ消化后获得单个细胞。将细胞重悬于含有2%FBS、1%HEPES 缓冲液、1%青/链霉素溶液的Hanks 缓冲液中,加入荧光标记抗体PE-CD24、PE-Cy7-EpCAM、APC-Sca-1、CD31、CD34、CD45于4 ℃条件下避光孵育45 min,洗去未结合的一抗,加入Streptavidin于4 ℃条件下避光孵育30 min;洗去未结合的二抗,Hanks 缓冲液重悬细胞,使用 BD Ario Ⅲ流式细胞仪分选出表型CD31-CD34-CD45-PE-Cy7-EpCAM+APC-Sca-1+CD24+小鼠原代Club细胞。
1.2.6 体外类器官模型的建立 将分选出来的Club 细胞(3 000个/孔)与MLg2980细胞(3×104个/孔)在干细胞培养基(DMEM/F12,10%FBS,1%青/链霉素溶液)和Matrigel基质胶中混合均匀(干细胞培养基:50 µL/孔;Matrigel 基质胶:50 µL/孔)种到小室中。对照组和Lkb1敲除组各种5个孔,沿小室外侧每孔加入410µL干细胞培养基,培养条件为37 ℃、5%CO2,隔天换液,培养至第7 天时拍照记录细胞的生长情况,统计直径大于50µm 的类器官数量及直径,计算类器官形成率。类器官形成率=直径大于50µm的类器官数量/接种的Club 细胞数量×100%。药物刺激实验中类器官建立方法与上文相同,分别设置药物(AICAR)刺激组和溶剂(DMSO)对照组,药物刺激组使用含有AICAR 药物的干细胞培养基(DMEM/F12,10%FBS,1%青/链霉素溶液,1 mmol/L AICAR)培养,溶剂对照组使用含有等体积DMSO 的干细胞培养基(DMEM/F12,10%FBS,1%青/链霉素溶液,DMSO)培养,隔天换液,第7天时拍照记录。
1.2.7 RNA 提取及RT-PCR Trizol 裂解细胞提取总RNA,反转录成cDNA,以此为模板进行SYBR Green RT-PCR检测。扩增程序:95 ℃3 min;95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸10 s,循环45 次,分析熔解曲线。检测高脚杯细胞标志物CLCA3,纤毛细胞标志物叉头框蛋白J1(FOXJ1),AMP 依赖的蛋白激酶基因AMPKα、β、γ的表达情况,以β-actin作为内参,各基因的引物序列见表1。目的基因的相对表达量用2-ΔCt法计算,ΔCt=目的基因Ct-内参基因Ct。

Tab.1 Primer sequences表1 引物序列
1.3 统计学方法 采用SPSS 27.0 进行数据分析,符合正态分布的计量资料以表示,组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1Lkb1对OVA引起的肺部炎症的影响 BLAF细胞计数结果显示,与对照组相比,Lkb1敲除组BLAF中炎性细胞总数无明显变化,巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量变化差异无统计学意义,见表2。
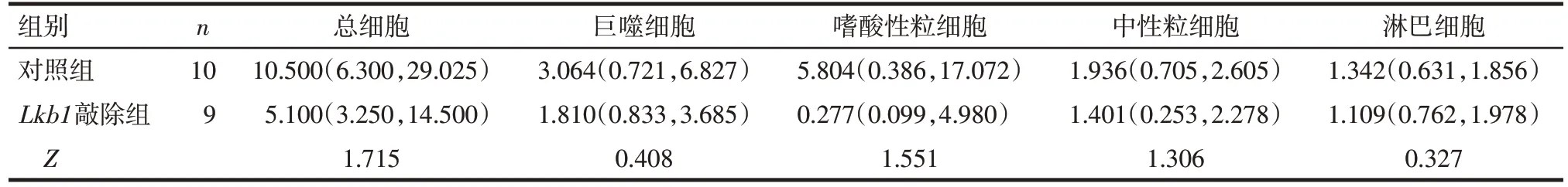
Tab.2 Comparison of the number of different types of cells in BALF between the two groups表2 2组BALF中不同种类细胞数比较[×104个,M(P25,P75)]
2.2Lkb1缺失对OVA 引起的杯状细胞分化的影响 CLCA3 是杯状细胞的标志物,Lkb1敲除组肺组织免疫荧光染色CLCA3阳性区域明显少于对照组,见图1。
2.3Lkb1缺失对气道祖细胞Club 增殖和分化的影响 对照组Club 细胞和Lkb1敲除组Club 细胞来源的体外类器官模型培养至第7天的代表性图像如图2所示。Lkb1敲除组和对照组的类器官直径分别为(146.200±13.580)µm 和(175.591±11.076)µm,差异有统计学意义(n=5,t=3.750,P<0.01)。Lkb1敲除组的类器官形成率为(3.960±0.779)%,显著低于对照组的(10.873±3.261)%(n=5,t=4.611,P<0.01)。RT-PCR 结果显示,Lkb1敲除组FOXJ1 mRNA 表达水平低于对照组(0.001±0.000vs.0.003±0.002,n=5,t=3.603,P<0.05),LKB1敲除组CLCA3 mRNA 表达水平(0.001±0.000)与对照组(0.001±0.001)比较差异无统计学意义(n=5,t=1.202,P>0.05)。

Fig.2 Growth of organoids图2 类器官的生长情况
2.4Lkb1通过AMPK 通路对Club 细胞增殖发挥促进作用 AMPK 是Lkb1的下游信号通路。RT-PCR结果显示,与对照组相比,Lkb1敲除组AMPKα mRNA 表达水平下降(0.005±0.001vs.0.012±0.004,n=5,t=3.103,P<0.05);AMPKβ(0.003±0.001vs.0.005±0.002,n=5,t=2.378,P>0.05)和 AMPKγ(0.008±0.001vs.0.015±0.006,n=5,t=2.566,P>0.05)mRNA 表达水平与对照组相比差异无统计学意义。药物体外刺激实验中类器官培养至第7天代表性图像如图3 所示,从图中可以看出Lkb1缺失抑制了Club 细胞增殖,加入AMPK 的激活剂AICAR 后可以缓解Lkb1缺失对Club细胞增殖功能的抑制。

Fig.3 Effects of AMPK signaling pathway on the proliferation function of Club cells图3 AMPK信号通路对Club细胞增殖功能的影响
3 讨论
Club 细胞是主要的气道上皮祖细胞,具有很强的自我更新能力,肺气道上皮稳态维持以及损伤后的再生修复都依赖于Club 细胞[15]。肺是生物体重要的呼吸器官,肺上皮直接与大气中的颗粒物、微生物等有害物质接触很容易使上皮细胞受损。当损伤发生时,Club细胞可迅速增殖补充缺失,同时向纤毛细胞和杯状细胞分化以修复气道上皮的正常结构和功能。因此,Club 细胞在稳态维持和气道上皮损伤后的再生修复过程中发挥着重要作用,其功能必须受到严格调控。
Lkb1是一种肿瘤抑制基因,其功能异常改变或发生基因突变会导致疾病的出现,有研究表明肺腺癌的发生与Lkb1基因异常高度相关[16-17]。本研究利用OVA 诱导小鼠发生支气管哮喘,BALF 细胞计数结果显示Lkb1敲除组巨噬细胞、嗜酸性粒细胞、中性粒细胞、淋巴细胞数量与对照组相比无明显变化,说明Lkb1对OVA 诱导的肺部炎症无显著影响。免疫荧光染色结果显示Lkb1缺失可减弱OVA 所致的杯状细胞分化,说明Lkb1对杯状细胞分化有促进作用,在一定程度上促进哮喘的进程。气道上皮损伤是支气管哮喘的主要病理特征[3-4],上皮损伤后修复不完全导致炎性细胞进一步浸润从而加重哮喘[18-19],所以气道祖细胞Club 及时增殖修复气道上皮非常关键。为了研究Lkb1基因对Club 细胞增殖分化的调控作用,本研究构建了体外类器官培养模型。类器官是来源于组织干细胞的可以模仿组织或器官再生能力的体外3D 结构[20-21]。肺上皮祖细胞来源的类器官已经被成功用于肺癌、肺纤维化、肺炎等多种呼吸系统相关的疾病研究中[22-23]。在本研究成功建立了Club细胞来源的类器官,结果显示,Lkb1基因敲除后类器官平均直径减小,形成效率降低,Club 细胞分化减弱。提示Lkb1缺失可能导致Club细胞增殖和分化都受到抑制。既往研究表明,在胚胎和成人肺中,Lkb1可促进纤毛细胞分化[24],并可介导巨噬细胞与气道祖细胞相互作用调控气道杯状细胞化生[14]。维持组织稳态和干细胞再生都离不开Lkb1稳定表达[25-27]。本研究结果与此一致。
AMPK 作为一种重要调节因子,参与真核生物的细胞以及组织代谢,在代谢重编程与生长调节中具有重要作用。研究表明,AMPK 可介导Lkb1相关的许多进化保守功能[13]。机体缺乏能量时,AMPK抑制mTORC1 靶点以达到控制细胞生长的目的[28]。本研究中类器官培养结果显示,Lkb1敲除后Club细胞来源的类器官形成数量减少,说明Lkb1缺失会抑制Club 细胞增殖,而AMPK 激活剂AICAR 可缓解Lkb1缺失对Club细胞增殖功能的抑制,提示Lkb1可能通过激活AMPK信号通路调控Club细胞生长。
综上,本研究通过体外类器官模型发现Lkb1与Club 细胞增殖分化密切相关,Lkb1通过AMPK 信号通路介导Club细胞增殖,这给哮喘以及其他与气道祖细胞增殖有关的疾病提供了新的治疗思路。
