微乳头型肺腺癌类器官的构建及其靶向药物的筛选
2024-01-15姜忠敏张春艳刘敏郑洁李艳霞仁青措孟纬刘晓智
姜忠敏,张春艳,刘敏,郑洁,李艳霞,仁青措,孟纬,刘晓智△
微乳头型肺腺癌是肺癌中的罕见病理亚型之一,其在肺癌的发生率不超过3%。微乳头型肺腺癌在病灶早期即出现广泛淋巴管癌栓,易侵犯胸膜,并发生骨转移[1],从而导致患者手术及化疗效果不佳,预后极差[2]。因此,寻找提高此类患者疗效的新方法势在必行。肿瘤类器官能够高度还原肿瘤亲本组织的遗传学和细胞学特征[3],极大地缩短化疗药物或靶向药物的筛选时间[4],提高个体化治疗精度。然而,目前针对不同病理亚型的肺癌类器官的培养基的研发及相应靶向药物的筛选仍处于起步阶段,尚少见微乳头型肺腺癌类器官培养及靶向药物筛选的相关报道。因此,本研究尝试从1 例确诊为微乳头型肺腺癌患者手术切除组织中提取和培养原代肺腺癌类器官,并基于其基因突变表型,筛选出潜在的靶向治疗药物,再以上述肺腺癌类器官为研究对象,选出抑瘤效果最佳的靶向药物,为临床医师提供治疗参考。
1 材料与方法
1.1 材料 肺腺癌类器官培养基、原代组织保存液(伯桢生物),消化液Ⅰ(创芯国际),Hanks'平衡盐溶液(HBSS,美国Gibco 公司);苏木精-伊红(HE)染色液(武汉赛维尔公司);环保脱蜡液(珠海贝索生物),无水乙醇(天津市津东天正精细化学试剂厂),甲状腺转录因子-1(thyroid transcription factor-l,TTF-1)抗体、角蛋白7(cytokeratin 7,CK7)抗体、新天冬氨酸蛋白酶A(Napsin A)抗体和Ki67 抗体(北京中山金桥);核酸提取试剂盒、基因检测试剂盒(厦门艾德生物);塞尔帕替尼、卡博替尼和凡德他尼(美国MedChem Express 公司);alamarBlueTM细胞活力检测试剂盒(美国Invitrogen公司)。
1.2 病例信息 患者,女,53岁,主因体检发现肺部占位7 d入院。既往无高血压、糖尿病病史,无肺结核、肝炎等传染病史,否认吸烟史。胸CT 示右下肺占位性病变,大小约2 cm×2 cm。其中,实验室检测血清肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)和细胞角蛋白19 片段(CYFRA21-1)分别为1.42µg/L和3.35µg/L。病理诊断为肺腺癌,免疫组织化学染色结果显示,Ki67、Napsin A、TTF-1、CK7和CD31均呈阳性,其中微乳头型(40%)、乳头型(30%)、腺泡型(20%)、贴壁型(10%),侵及胸膜下,并见支气管侵犯和气腔播散,可见脉管内癌栓。
1.3 肿瘤样本的收集 本研究方案得到天津市第五中心医院医学伦理委员会批准(WZX-EC-KY2022028)。在患者知情同意的前提下,从术中切除的肺腺癌标本中提取肿瘤组织。为避免肿瘤组织污染及蛋白降解,手术标本离体后用无菌生理盐水冲洗3次,于离体30 min内获取0.4 cm×0.4 cm的新鲜肿瘤组织2块。将肿瘤组织放入适量冰冷的原代组织保存液中,于2~3 h内低温(4 ℃)转运至实验室进行原代提取、分离。
1.4 微乳头型肺腺癌类器官的提取、分离与培养 将肿瘤组织转移到生物安全柜中,用冰冷HBSS 洗涤样品3 次。对照HE染色结果,认真判别组织块中微乳头型肺腺癌区域,用无菌眼科剪剪成约0.5 mm3的碎块。根据组织量加入适量消化液,于37 ℃培养箱消化约30 min,用1 mL 枪头充分吹散,直至组织块全部顺利进出枪头后终止消化。将消化后的组织细胞悬液经100µm细胞过滤器研磨过滤。取过滤后的细胞少许,用台盼蓝染色检测细胞活力。当细胞活力达80%以上时,滤液以200×g低温离心3 min。将细胞沉淀物于冰上用适量Matrigel 重悬,混匀,接种于24 孔板中,37 ℃培养箱放置15 min。最后加入肺癌类器官培养基观察。
1.5 微乳头型肺腺癌类器官的鉴定
1.5.1 HE 染色 收集适量微乳头型肺腺癌类器官,经琼脂糖预包埋后于4%多聚甲醛中固定1 h。将固定后的类器官与亲本组织经常规脱水、包埋、切片后行HE染色和免疫组化染色。以上石蜡切片依次放入环保脱蜡液中进行3次脱蜡,2次置入无水乙醇后在95%、90%、80%、70%乙醇和蒸馏水中各浸泡5 min。随后将切片置于苏木精溶液中染色5 min 后流水冲洗。再用0.5%盐酸乙醇分化30 s,流水冲洗0.5 h,伊红染色3 min,流水冲洗30 min。将切片放入95%乙醇中浸泡2次,各5 min,再放入无水乙醇中浸泡2次,各5 min,使其彻底脱水。脱水后的切片依次放入环保脱蜡液浸泡3次,每次5 min,透明后取出,晾干后滴加中性树胶封片。
1.5.2 免疫组化染色及评分 将HE染色后的类器官与亲本组织用柠檬酸盐缓冲液进行高压热修复抗原。将样品用H2O2封闭内源性过氧化物酶,随后经封闭、一抗(TTF-1、Napsin A、CK7、p63)工作液和二抗工作液孵育后,用DAB 显色,经复染、脱水、透明后封片即可镜下观察。评分方法:每张切片随机读取10个高倍视野(×400),每个视野数100个细胞,首先按阳性细胞所占百分比评分,≤4%为0分;5%~25%为1 分;26%~50%为2 分;51%~75%为3 分;≥76%为4 分。然后按染色强度评分:不着色为0分;黄色为1分;棕黄色为2分;棕褐色为3 分。两者乘积数作为总评分,≥4 分为高表达,≤3分为低表达。
1.6 实时荧光定量聚核酶链反应(qRT-PCR)检测基因突变 提取类器官与亲本组织核酸,反转录后按照基因检测试剂盒说明书检测亲本癌组织和微乳头型肺腺癌类器官中基因突变情况。检测指标:间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、c-ros 肉瘤致癌因子-受体酪氨酸激酶(ROS proto-oncogene 1-receptor tyrosine kinase,ROS1)、原癌基因酪氨酸蛋白激酶受体Ret(proto-oncogene tyrosineprotein kinase receptor Ret,RET)融合基因联合检测,及表皮生长因子受体(epidermal growth factor receptor,EGFR)、KRAS、神经母细胞瘤RAS病毒癌基因同源物(Neuroblastoma RAS Viral Oncogene Homolog,NRAS)、磷脂酰肌醇3-激酶催化亚基p110α(PIK3CA)、BRAF、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)、间质表皮转化因子(cellular-mesenchymal to epithelial transition factor,Met)基因突变联合检测。PCR 反应程序为:95 ℃预变性5 min;95 ℃变性25 s,64 ℃退火20 s,72 ℃延伸20 s,36 个循环。每份样本与阳性对照、阴性对照样本同步上机分析。随后通过SLAN全自动医用PCR分析系统8.2.2计算Ct值,并得出样本结论。
1.7 靶向药物治疗与半数致死剂量(IC50)检测 基于以上基因检测结果及基因检测试剂盒说明书推荐的靶向药物,选择3种靶向RET融合的药物塞尔帕替尼、卡博替尼和凡德他尼,使用alamarBlueTM细胞活力检测试剂盒进行细胞毒性检测。微乳头型肺腺癌类器官培养3 d 后加入梯度浓度的药物(塞尔帕替尼、卡博替尼和凡德他尼的浓度分别为0.001、0.01、0.1、1、5、10、20、40、60和80µmol/L)干预,48 h后在培养基中加入终浓度为10%的活性试剂,继续放入细胞培养箱中孵育4 h后,于酶标仪检测其在波长570 nm和参考波长600 nm处的光密度(OD)值。实验中同时设立空白对照(无细胞)组、阴性对照(未经处理细胞)组及DMSO 溶剂对照组。最后根据实验结果测量各种靶向药物对微乳头型肺腺癌类器官的IC50。
1.8 统计学方法 使用GraphPad Prism 6 软件进行数据分析,计量资料以表示,2组间比较采用配对t检验,多组间比较采用单因素方差分析,组间多重比较采用Tukey 检验,P<0.05为差异有统计学意义。
2 结果
2.1 微乳头型肺腺癌类器官的生长状态 原代培养第2天可见折光性强的微小克隆球形成;第4天可见克隆球体积进一步增大,其间可见蜂窝状细胞间隔;第12 天可见克隆球直径超过60 µm,周长达到200µm,克隆球截面面积超过4 000µm2;第14天进行首次细胞传代,至第2代及第3代肿瘤细胞克隆球长势良好,未见明显老化与凋亡,见图1。
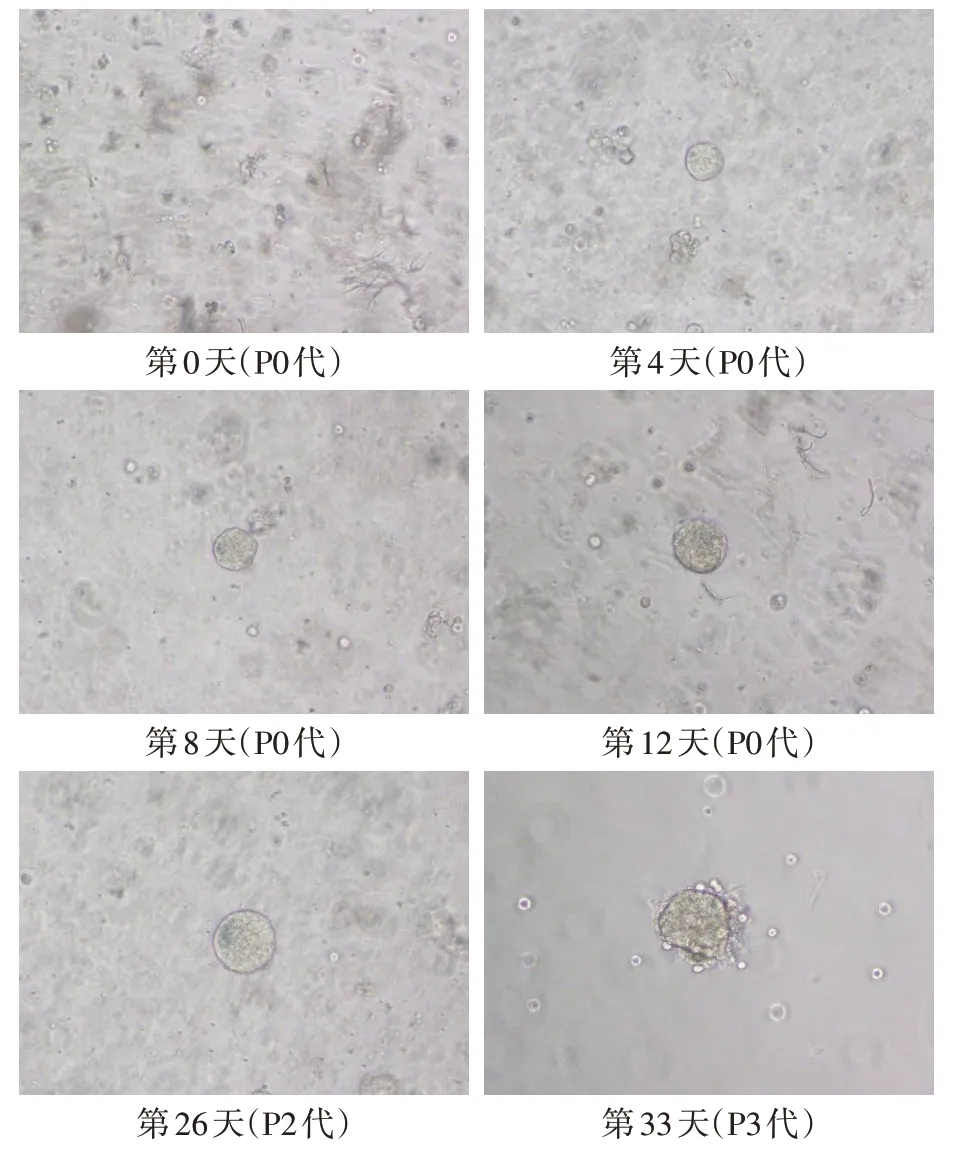
Fig.1 Culture of micropapillary lung adenocarcinoid organoid图1 微乳头型肺腺癌类器官的培养
2.2 微乳头型肺腺癌类器官的表型鉴定 HE染色结果显示,肿瘤亲本组织中,肿瘤腺腔内可见簇状、丝状乳头,乳头无纤维血管轴心,肿瘤细胞体积较大,胞浆嗜酸,核浆比高,胞核中-重度异型;微乳头型肺腺癌类器官中,肿瘤细胞胞体较大,胞浆嗜酸,核浆比高,可见中-重度异型胞核。两者细胞形态高度相似。免疫组化及评分结果显示,微乳头型肺腺癌类器官中TTF-1、CK7、Napsin A 和Ki67 的蛋白表达水平与肿瘤亲本组织基本一致,见图2、表1。
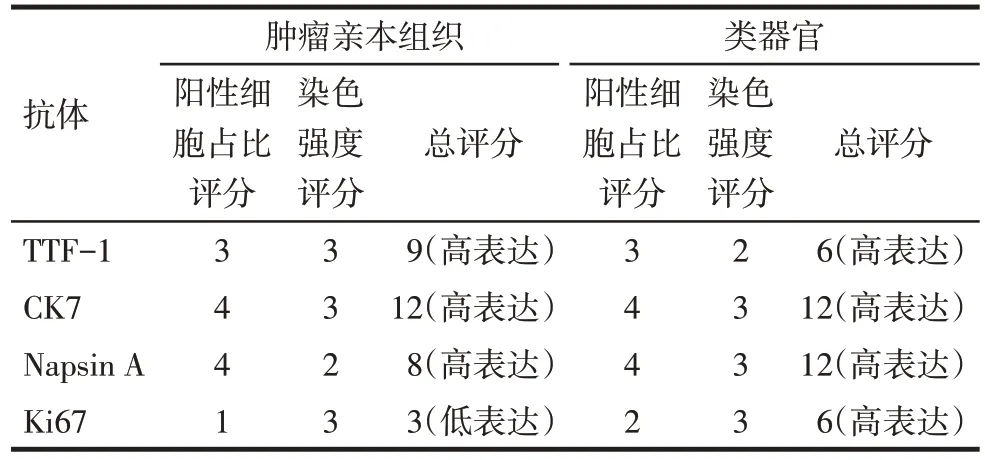
Tab.1 Analysis of immunohistochemical result score表1 免疫组化结果评分分析
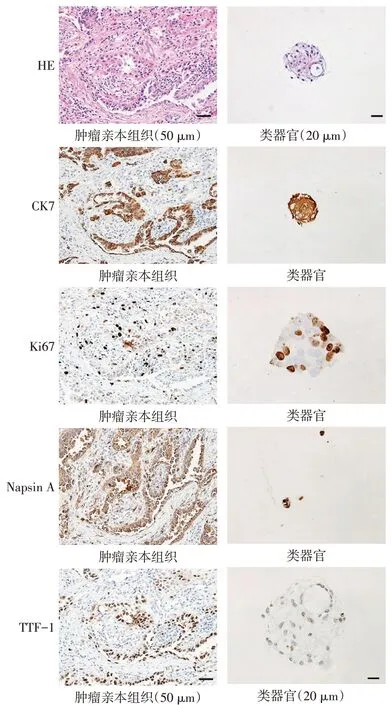
Fig.2 HE staining and immunohistochemistry experiments identify the phenotype of micropapillary lung adenocarcinoma organoid图2 HE染色及免疫组化实验鉴定微乳头型肺腺癌类器官的表型
2.3 基因突变检测结果 qRT-PCR检测结果显示,微乳头型肺腺癌亲本组织样本和类器官的突变基因结果一致,均体现为RET 融合阳性,见图3。其余ALK、ROS1 融合基因检测及EGFR、KRAS、NRAS、PIK3CA、BRAF、HER2、Met基因突变检测均为阴性。
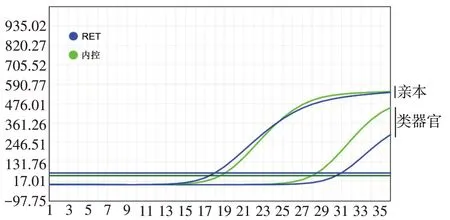
Fig.3 The detection results of RET fusion genes in parental tissue and its organoid图3 肿瘤亲本组织和类器官RET融合基因检测结果
2.4 受试靶向药物IC50检测结果 3 种靶向RET 融合的受试药物塞尔帕替尼、卡博替尼和凡德他尼的IC50检测结果分别为59.71、42.87、10.02 µmol/L,凡德他尼对该例微乳头型肺腺癌类器官的抑瘤效果最为明显,见图4。
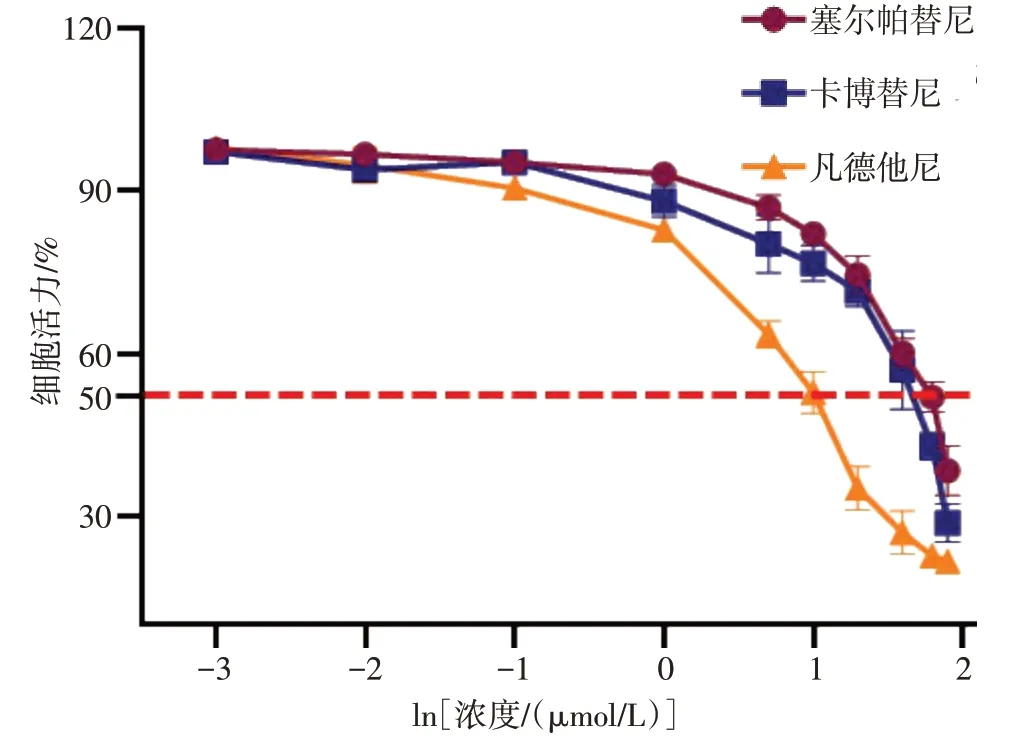
Fig.4 IC50 results of target drugs图4 受试靶向药物IC50检测结果
3 讨论
肺腺癌的演进历程一般包括腺瘤样增生—原位腺癌—微浸润腺癌—浸润腺癌4 个阶段,其中浸润腺癌中又包含贴壁型、腺泡型、乳头型、实体型、微乳头型病理亚型[5]。就复发风险而言,贴壁型肺腺癌为低复发风险,腺泡型和乳头型肺腺癌为中等复发风险,而微乳头与实体型肺腺癌为高复发风险[6]。我国微乳头型肺腺癌的发生率低于2%,属于相对罕见类型[7]。其具有小病灶,大转移,多数发现时即为晚期,术后无复发生存时间短等特点[8]。研究表明,即使微乳头型肿瘤细胞成分只有1%,也会严重影响患者的生存[9]。因此,在肺腺癌的各种病理亚型中,微乳头型被认为是预后最差的病理类型[10],而靶向微乳头型肿瘤细胞亚群的治疗尤为关键。
近年来,人源性肿瘤类器官的成功培养为肿瘤患者靶向药物的筛选和精准治疗提供了重要实验工具。肿瘤类器官具有高度保留肿瘤亲本组织遗传和表观遗传特征,极大地缩短靶向药物筛选时程和提高精准度的优势[11]。然而,瘤内异质性的存在是降低靶向药物筛选精度,制约精准医疗发展的重要原因[12]。因此,提高不同病理亚型肿瘤细胞的分选和培养水平对于提高靶向药物的筛选精度至关重要。本研究选择当前在肺腺癌中恶性度最高,患者预后最差的病理亚型—微乳头型肺腺癌为研究对象,成功建立了1 例微乳头型肺腺癌类器官,并就其常见癌变基因表型进行检测和分析,筛选出3 种潜在的靶向治疗药物,分别进行药物敏感性检测,发现凡德他尼的体外抑瘤效果最佳,为临床患者的精准治疗提供了重要实验参考。
实验中,笔者选择了4 个基因TTF-1、CK7、Napsin A 和Ki67 进行了免疫组化检测,以检测肿瘤类器官与肿瘤亲本组织间基因表达的一致性。TTF-1在非小细胞肺癌中的阳性表达与患者预后呈负相关,可作为独立的预后指标,其在肺腺癌具有较高的敏感度和特异度[13]。CK7 为碱性细胞角蛋白,可作为肺腺癌分化的客观指标,用于鉴别肿瘤类型及判断转移部位肿瘤细胞的来源[14]。Napsin A是一种肺泡上皮细胞特异性的酸性蛋白酶,有助于肺腺癌的分类和诊断[15]。Ki67 作为一种细胞增殖的重要标志物,其表达的高低直接预示着肿瘤的生长速度和病情的发展进程[16]。但由于肿瘤类器官主要源于增殖指数Ki67较大的肿瘤干细胞,而肿瘤组织中仅存在少数肿瘤干细胞。因此,本研究中肺腺癌类器官的Ki67阳性率高于其亲本组织。总之,本研究中微乳头型肺腺癌类器官与亲本组织间各基因的蛋白表达基本一致,表明微乳头型肺腺癌类器官很好地保留了肿瘤亲本组织的遗传特征。
基因突变结果显示,微乳头型肺腺癌组织亲本样本和类器官的突变基因结果一致,均体现为RET融合。RET 原癌基因是一种受体酪氨酸激酶(RTK)。现有文献已证实RET原癌基因主要通过基因的突变和融合参与多种恶性肿瘤的发生和发展[17]。RET原癌基因发生融合后可导致自我磷酸化及信号转导功能增强,使得RET基因表达失控,引起激酶活化,最终导致肿瘤发生[17]。RET 在人类正常肺组织中表达极低,但当肺上皮细胞发生恶性转变时,RET基因可能发生融合,进而在非小细胞型肺癌中呈现高表达,参与非小细胞型肺癌的发生和发展[18]。Tan等[19]对在新加坡国家癌症中心接受治疗的肺癌患者进行回顾性分析,其中77%患者为华裔,他们中有95%为腺癌,结果在88%的腺癌病例中检测到RET 重排。潘放等[20]研究发现酪氨酸激酶ALK、ROS1、RET这3种基因在肺癌中的表达相互排斥。另有研究表明非小细胞型肺癌患者中RET基因融合一般聚集在年龄偏低、非吸烟的腺癌患者中[21]。由此可见RET基因融合的发生与非小细胞型肺癌的发生、发展关系密切,其发生率受年龄、是否吸烟、组织类型等因素影响,且与其他基因相斥。以上研究提示RET基因融合可能成为非小细胞型肺癌患者行靶向治疗的新靶点。
由于本例患者存在RET 基因融合,笔者选择了3 种靶向RET 基因融合的药物塞尔帕替尼、卡博替尼和凡德他尼。其中,塞尔帕替尼是一种强效、口服、高度选择性转染期间重排RET激酶抑制剂,它通过干扰癌细胞代谢途径,限制转移和侵袭,同时抑制肿瘤的生长和增殖,可在一定程度上改善患者的生存质量[22]。目前已经被美国食品和药物管理局批准上市,用于晚期或转移性结直肠癌、甲状腺癌和非小细胞肺癌中肿瘤细胞发生RET基因融合的患者的治疗[22]。卡博替尼属于多靶点RTK抑制剂,对酪氨酸激酶受体RET、ROS1、KIT、ALK 等均有抑制作用。Nokihara等[23]报道了一项关于卡博替尼的Ⅰ期临床试验,在剂量递增组中的9 例非小细胞型肺癌患者中4 例肿瘤病灶缩小(其中ALK 融合2 例,EGFR 突变1 例,RET 融合1 例)。Wang 等[24]对1 例KIF5BRET 基因融合的患者行卡博替尼治疗,剂量为140 mg/d,1 次/d,在治疗约9 个月时,患者达到疾病稳定;治疗期间除发生Ⅱ级皮疹的不良反应外,未发生严重不良事件。但是该研究结果也发现卡博替尼对RET基因融合的特异性不强。凡德他尼能通过抑制表皮生长因子受体、血管内皮生长因子受体、RET等发挥抗肿瘤的作用。Yoh 等[25]通过对19 例RET基因融合的非小细胞型肺癌患者行凡德他尼治疗,300 mg/d,1 次/d,结果显示17 例患者符合临床疗效评估,9例患者达到总体客观缓解,总体客观缓解率为53%,无进展生存时间为4.7 个月,未见严重不良反应的发生。这些结果提示凡德他尼可延长RET基因融合的非小细胞型肺癌患者的生存期,且无严重不良反应,为晚期非小细胞型肺癌的治疗提供了新的治疗方案。
本研究基于本例患者源性的微乳头型肺腺癌类器官药物敏感性检测结果表明,3 种靶向RET 基因融合的药物塞尔帕替尼、卡博替尼和凡德他尼均能够有效杀伤微乳头型肺腺癌细胞,但以凡德他尼的抑瘤效果最为明显。遗憾的是,本例患者在术后因转院并未接受本研究基于微乳头型肺腺癌类器官的药物敏感性试验结果进行相应治疗。
目前,临床上关于针对RET 基因融合为阳性的靶向药物尚未应用于临床,但关于多靶点RTK 抑制剂的药物已应用于临床,且被证实有效。此外,艾乐替尼、莫特塞尼、索拉菲尼、AUY922 等多靶点RTK抑制剂被尝试作为RET基因融合的非小细胞型肺癌患者的治疗,但目前仍缺乏临床研究,证据多来自于临床前研究[26]。
