大黄素调控组蛋白乙酰化促进HpG2肝癌细胞焦亡及凋亡的发生
2024-01-15刘国旗李程程刘声菊朱丽英
刘国旗,李程程,刘声菊,朱丽英△
肝细胞癌死亡率居恶性肿瘤排名的第4 位[1]。肝癌患者的治疗以手术结合放、化疗为主,系统性全身治疗是晚期肝癌患者治疗的唯一选择,但疗效有限,亟需开发更多有效的治疗方案来改善晚期患者的生存状况。大黄素属蒽醌类化合物,具有抗炎、抑菌、镇痛等功效[2]。大黄素还能通过诱导细胞凋亡,调控细胞周期,抑制肿瘤增殖、迁移、侵袭[3]和耐药[4]。组蛋白乙酰化能通过改变染色质的螺旋程度,参与和调控细胞增殖、细胞周期、细胞凋亡等多种过程,影响肿瘤的发生发展[5]。有研究发现,组蛋白乙酰化修饰可调控关键代谢酶的功能[6],促进肝癌细胞的快速增殖[7]。大黄素能有效降低由糖尿病所致的组蛋白乙酰化水平增高[8],据此推测大黄素有调控组蛋白乙酰化的功能。本研究围绕大黄素抗肝癌的作用展开,利用生物信息学和分子生物学手段,探究大黄素是否参与肝癌细胞组蛋白乙酰化调控过程,促进肝癌细胞凋亡及细胞焦亡的发生。
1 材料与方法
1.1 试剂与仪器 人肝癌细胞系HepG2细胞及人正常肝细胞系L02 细胞由贵州医科大学附属医院医学检验实验室保存;大黄素购于Merck 公司,相对分子质量270.24,纯度≥97%。DMEM培养液(美国Gibco公司);凋亡试剂盒(南京凯基公司);CCK-8试剂盒(日本东仁公司);组蛋白乙酰化转移酶(histone acetyltransferase,HAT)、组蛋白去乙酰化酶(histone deacetylase,HDAC)、白细胞介素(IL)-1β、IL-18 酶联免疫吸附试验(ELISA)试剂盒(上海酶联公司);实时荧光定量PCR(qPCR)试剂盒(日本TAKARA 公司);引物及总RNA 提取试剂盒(上海生工公司);胎牛血清(以色列BI 公司);2.5%胰酶(美国Gibco 公司);鼠源B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、兔源β-actin、Bcl-2-相关X 蛋白质(Bax)、赖氨酸乙酰基转移酶2A(lysine Acetyltransferase,KAT2A)一抗(武汉三鹰);兔源NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、胱天蛋白酶1(Caspase-1)、Gasdermin家族成员D N 端(Gasdermin-D N terminal,GSDMD-N)一抗(美国CST 公司);辣根过氧化物酶(HRP)偶联的羊抗兔及羊抗鼠IgG 二抗(武汉三鹰);细胞蛋白提取试剂盒(北京索莱宝公司)。倒置显微镜(日本佳能公司);细胞培养箱(美国赛默飞公司);ECL曝光仪、蛋白电泳仪、酶标仪(美国伯乐公司);流式细胞仪(美国贝克曼公司);荧光PCR仪、普通PCR仪(上海宏石公司)。
1.2 细胞培养 从液氮罐中选择传代数较少的HepG2细胞及L02细胞进行复苏培养,细胞培养液为含10%胎牛血清和1%青霉素/链霉素的DMEM 培养基。选择生长周期为指数期的细胞进行后续操作,经2.5%胰蛋白酶消化后,以1.0×105个/mL 密度均匀铺到培养板或培养瓶中,当细胞生长到90%融合度进行传代处理。
1.3 CCK-8 法检测细胞活力 提前将HepG2 细胞以2.0×105个/mL 密度均匀铺到96 孔板中,将大黄素终浓度设置为0、10、20、30、40、50、60、70、80、100µmol/L,检测24 h 的细胞活性,每组设置5个复孔以降低实验误差。各组细胞到达作用时间后,按照细胞活力试剂盒操作说明,将CCK-8 溶液加入96 孔中(每孔10µL),随后置于37 ℃、5%CO2细胞培养箱中避光孵育2 h,放置于酶标仪中,以450 nm波长检测各孔细胞光密度(OD)值,计算得到细胞活力情况。
1.4 细胞分组及干预 将生长状态良好的HepG2细胞分为对照组和大黄素干预组,对照组细胞在DMEM培养基中正常培养,不进行干预处理;大黄素干预组细胞采用含60µmol/L大黄素的DMEM培养基处理24 h。
1.5 TCGA数据库分析肝癌患者组蛋白乙酰化水平 371例肝癌患者样本与50 例健康人肝组织样本的RNAseq 数据分别从TCGA(The Cancer Genome Atlas Program)数据库(https://portal.gdc.com)及GTEx(Genotype-Tissue Expression)数据库(https://gtexportal.org/home/)获取,R 软件Limma 包用于研究mRNA 的差异表达。在Gene Cards 数据库pathway 中以“Histone acetylation”为搜索词条,收集与组蛋白乙酰化相关的基因。比较371例肝癌样本与50例癌旁样本中92个组蛋白乙酰化相关基因mRNA的表达,以AdjustedP<0.01且|log2(Fold change)|>1为筛选条件使用R软件ggVolcano包绘制火山图。在Gene Cards 数据库pathway 中以“Apoptosis”为搜索词条,收集与细胞凋亡通路相关的基因,通过R软件GSVA包进行分析,选择参数method='ssgsea',最后通过Spearman 法分析KAT2A mRNA与凋亡通路得分的相关性。
1.6 qPCR 验证KAT2A 基因转录水平 收集生长状态良好的HepG2细胞与L02细胞,提取RNA后立即进行普通PCR逆转录成cDNA 保存。使用2×iQ SYBR Green SuperMix 进行qPCR,反应体系:2×iQ SYBR Green SuperMix 10 µL,上游引物0.5 µL,下游引物0.5 µL,cDNA2 µL,ddH2O 7 µL,总体积20 µL;反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火20 s,72 ℃延伸15 s,循环40 次。KAT2A 引物:上游5'-CTAGGGGTCTTCTCGGCTTG-3',下游5'-CTCTTCTCGCCTGGCATAGG-3';GAPDH 引物:上游5'-TGTGGGCATCAATG-GATTTGG-3',下游5'-ACACCATGTATTCCGGGTCAAT-3',每组设置5 个复孔。按照2-ΔΔCt法计算不同细胞组KAT2A mRNA的相对表达量。
1.7 ELISA 法检测HAT、HDAC、IL-1β、IL-18 水平 待大黄素达到作用细胞的时间后,利用反复冻融法裂解细胞,随后收集细胞液,按照ELISA 试剂盒操作说明进行,加入HPR 标记的山羊抗兔抗体100µL,经孵育、洗涤处理后,再加入显色剂100µL,室温避光反应20 min,最后加入终止液50µL。使用酶标仪在450 nm波长处检测各组细胞OD值。
1.8 流式细胞仪检测细胞凋亡情况 待大黄素达到作用细胞的时间后,采用无EDTA 的胰酶消化收集细胞置EP 管中,利用无菌PBS 漂洗3 次,随后按照凯基双染凋亡检测试剂盒说明书,加入500 µL Buffer 重悬细胞,分别加入5 µL PI 和5µL FITC 反应液,随后震荡混匀后避光保存,1 h 内上机完成检测,每组重复3次。
1.9 Western blot 检测KAT2A、细胞凋亡和细胞焦亡相关蛋白表达 收集到达作用时间的细胞,利用细胞强力裂解液(RIPA∶PMSF=100∶1)破碎细胞膜获得细胞蛋白。采用BCA法定量各组细胞蛋白浓度,加入蛋白上样缓冲液后金属浴10 min 使蛋白变性。按照蛋白检测的方法进行电泳及转膜后,放置于提前配制好的KAT2A(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶2 000)、NLRP3(1∶1 000)、Caspase-1(1∶2 000)、GSDMD-N(1∶2 000)和β-actin(1∶5 000)一抗溶液中,于4 ℃冷库摇床孵育过夜。第2天TBST漂洗3次后,室温放置在羊抗鼠(1∶5 000)或羊抗兔(1∶5 000)二抗溶液中孵育2 h,TBST中漂洗3次,每次15 min,采用ECL法显色,曝光仪收集图像,Image J软件分析目的蛋白灰度值,实验重复3次。
1.10 统计学方法 使用Graphpad Prism 9.0 软件及SPSS 22.0 软件进行数据分析。计量资料以均数±标准差()表示,2 组间比较差异采用独立样本t检验,相关性分析采用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 大黄素作用肝癌细胞最适浓度 CCK-8 结果显示,大黄素干预半抑制浓度(IC50)的95%置信区间为58.12~66.52µmol/L,见图1。取60µmol/L的大黄素进行后续实验。
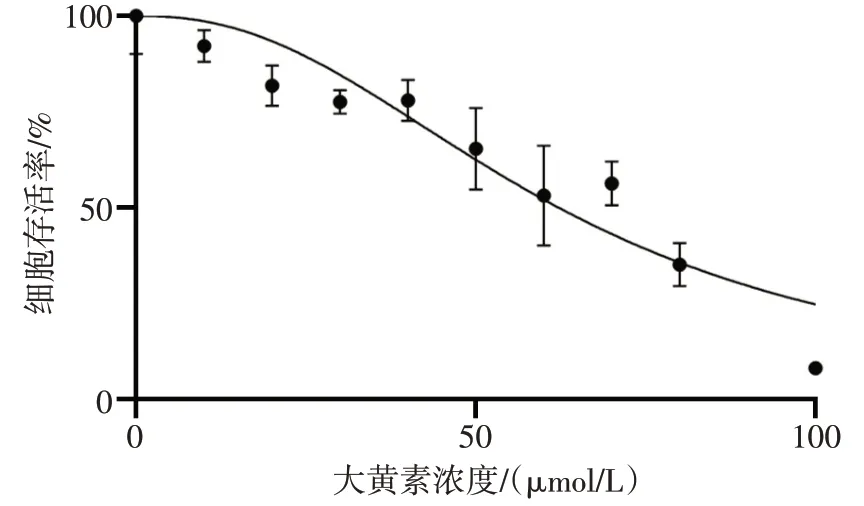
Fig.1 Emodin affected IC50 of hepatocellular carcinoma cells图1 大黄素作用肝癌细胞IC50值
2.2 肝癌患者组蛋白乙酰化水平 TCGA数据分析发现,健康人肝组织与肝癌组织中组蛋白乙酰化差异表达的基因共有22 个,均表达上调,且KAT2A 表达变化倍数最高[log2(Fold Change)=2.010,P<0.01],见图2。KAT2A mRNA 在肝癌组织中表达量明显增高(Z=17.780,P<0.01),见图3。相关性分析发现,肝癌患者中KAT2A mRNA的表达与细胞凋亡通路得分呈负相关(rs=-0.230,P<0.01),见图4。
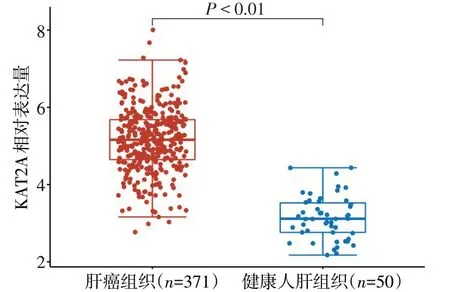
Fig.3 Comparison of mRNA expression of KAT2A between hepatocellular carcinoma tissue and normal tissue图3 KAT2A在肝癌组织及健康人肝组织mRNA表达量比较
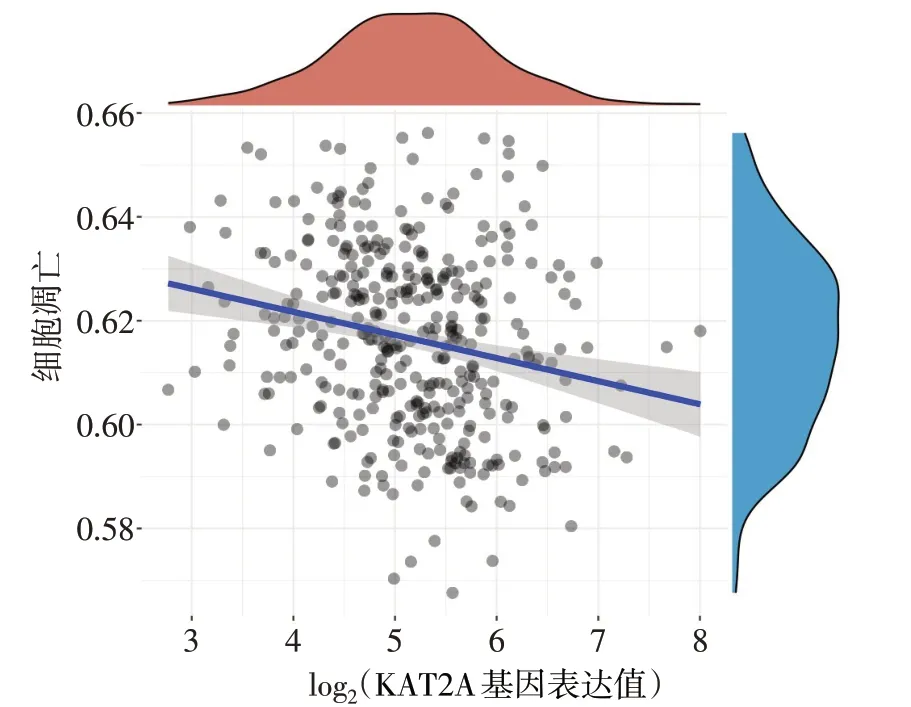
Fig.4 Spearman analysis of the correlation between KAT2A mRNA and the apoptotic pathway图4 Spearman分析KAT2A mRNA与细胞凋亡通路的相关性
2.3 肝癌细胞中KAT2A mRNA表达情况 qPCR结果显示,与L02细胞相比,KAT2A mRNA在HepG2中表达更高(26.97±4.45vs.1.00±0.25,t=13.045,P<0.05)。
2.4 大黄素对细胞HAT、HDAC、IL-18、IL-1β 水平的影响 ELISA结果显示,与对照组相比,大黄素干预组HAT和HDAC的表达水平下降,IL-18和IL-1β表达水平增高(P<0.01),见表1。
2.5 大黄素对细胞凋亡影响 流式细胞术结果显示,与对照组相比,大黄素干预组细胞凋亡率(%)升高(15.30±3.36vs.4.24±2.00,n=3,t=4.898,P<0.05),见图5。
Tab.1 Comparison of HAT,HDAC,IL-18 and IL-1β levels between the control group and the 60 μmol/L emodin intervention group表1 对照组与大黄素干预组HAT、HDAC、IL-18、IL-1β水平的比较(n=5,OD450,)
**P<0.01。
组别对照组大黄素干预组t HAT 1.37±0.20 0.69±0.13 6.043**HDAC 1.29±0.12 0.89±0.07 6.386**IL-18 0.14±0.01 0.31±0.05 7.077**IL-1β 0.18±0.04 0.40±0.05 6.753**
2.6 大黄素对HepG2 细胞KAT2A、Bcl-2、BAX、NLRP3、GSDMD-N 及Caspase-1 蛋白表达的影响 Western blot 结果显示,与对照组相比,大黄素干预组KAT2A 蛋白表达降低,细胞凋亡相关蛋白Bcl-2 表达水平增高,BAX 表达水平降低,细胞焦亡相关蛋白NLRP3、GSDMD-N 及Caspase-1 表达水平升高(P<0.05),见图6—8,表2。
Tab.2 Comparison of KAT2A,Bcl-2,BAX,NLRP3,GSDMD-N and Caspase-1 protein expression levels between the control group and the 60 μmol/L emodin intervention group表2 对照组和60 μmol/L大黄素干预组KAT2A等各种蛋白表达水平的比较(n=3,)
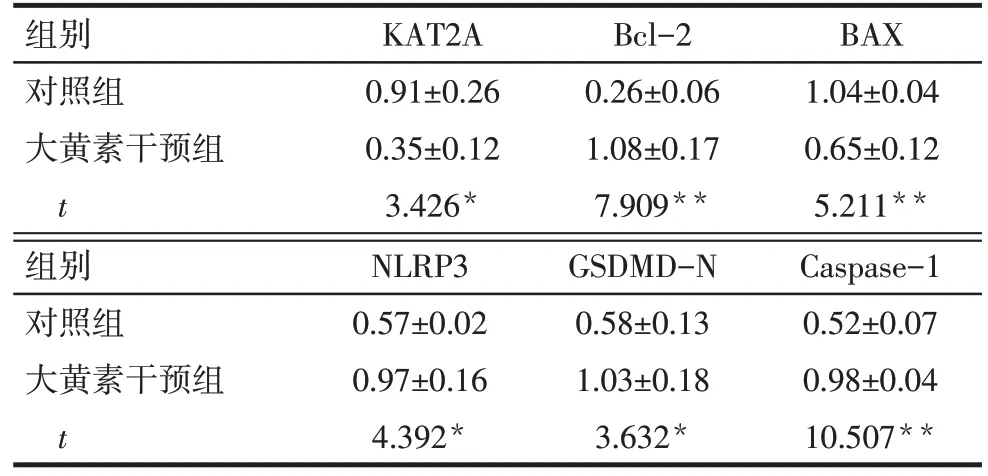
Tab.2 Comparison of KAT2A,Bcl-2,BAX,NLRP3,GSDMD-N and Caspase-1 protein expression levels between the control group and the 60 μmol/L emodin intervention group表2 对照组和60 μmol/L大黄素干预组KAT2A等各种蛋白表达水平的比较(n=3,)
*P<0.05,**P<0.01。
组别对照组大黄素干预组t KAT2A 0.91±0.26 0.35±0.12 3.426*Bcl-2 0.26±0.06 1.08±0.17 7.909**BAX 1.04±0.04 0.65±0.12 5.211**组别对照组大黄素干预组t NLRP3 0.57±0.02 0.97±0.16 4.392*GSDMD-N 0.58±0.13 1.03±0.18 3.632*Caspase-1 0.52±0.07 0.98±0.04 10.507**
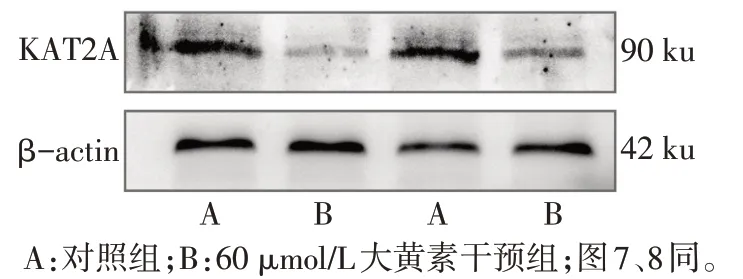
Fig.6 Western blot detection of KAT2A expression图6 Western blot检测KAT2A表达情况

Fig.7 Western blot detection of apoptosis-associated proteins图7 Western blot检测细胞凋亡相关蛋白
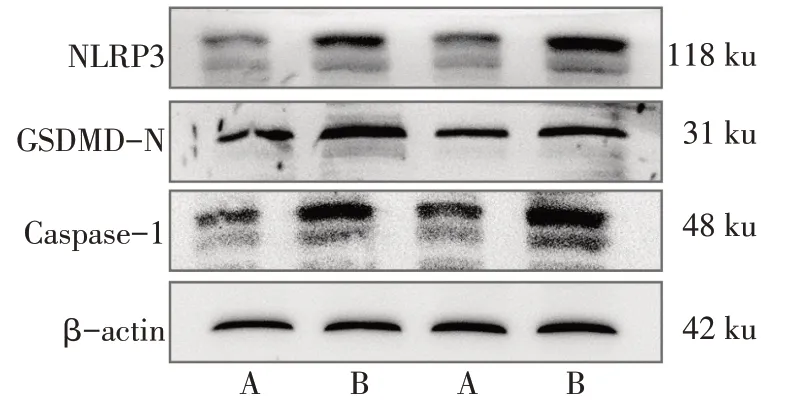
Fig.8 Western blot detection of pyroptosis related proteins图8 Western blot检测细胞焦亡相关蛋白
3 讨论
大黄素广泛存在于常见的中草药中,如大黄、虎杖、生何首乌、制何首乌等。大黄素可通过多途径抑制肝癌发展[9]。组蛋白乙酰化参与癌细胞增殖与转移[10]。多种癌症患者癌组织HDAC 显著增加,但不同类型的癌症增加程度不同,HDAC 在不同肿瘤中的表达差异可以被用来开发更有针对性的治疗方法。Yuan 等[11]在肝癌中发现组蛋白乙酰化模式异常,与肝癌细胞的增殖与迁移功能相关。本研究通过生物信息学分析也发现,在肝癌组织中,组蛋白乙酰化修饰相关基因的表达水平均上调。美国食品药品监督管理局已经批准了5种组蛋白脱乙酰酶抑制剂(HDACi)用于血液系统恶性肿瘤[12],且靶向HDACs 联合索拉菲尼能够让肝癌患者获益[13]。本研究发现,大黄素干预能够下调肝癌细胞HATs 和HDACs的表达,调控细胞组蛋白乙酰化水平。
进一步生物信息学分析发现,肝癌组织中赖氨酸乙酰基转移酶KAT2A mRNA水平上调,且与细胞凋亡存在负相关。作为首个被发现的赖氨酸乙酰基转移酶,KAT2A可将乙酰基转移到赖氨酸残基的游离氨基上,催化组蛋白多个位点的乙酰化修饰,广泛参与到包括基因转录、细胞分化、DNA 修复、核小体组装等多个生物学过程[14]。Guo 等[15]发现KAT2A在肾癌组织中的表达高于正常组织,高KAT2A表达可以作为一个独立的生物标志物,与肾癌患者不良的生存结局相关。Ma等[16]发现,KAT2A通过将长链非编码RNA(lncRNA)GCAWKR 作为连接支架,结合WD40重复结构域蛋白5(WD40 repeat-containing protein 5,WDR5),介导胃癌的发生。Domingues等[17]发现,高表达的KAT2A通过保存白血病干细胞样细胞促进了白血病细胞的增殖,而KAT2A的缺失会影响转录因子与靶基因的结合,进而转变白血病细胞的分化状态。Wu 等[18]发现,在神经元中,KAT2A 的缺失将导致细胞凋亡的发生。本研究也发现大黄素干预能在抑制肝癌细胞KAT2A 的表达的同时,促进细胞凋亡,促进细胞焦亡相关蛋白NLRP3,GSDMD-N,Caspase-1的表达。
综上,本研究发现在肝癌组织中组蛋白乙酰化相关基因表达上调,KAT2A 表达增高;当大黄素干预后,KAT2A表达下调,并促进细胞凋亡,上调细胞焦亡相关蛋白NLRP3、GSDMD-N 和Caspase-1 的表达。这提示大黄素可能靶向作用于组蛋白去乙酰化酶KAT2A,但仍需后续采用酶活实验、分子对接预测、表面等离子共振技术证明大黄素与KAT2A的直接结合作用。尽管大黄素具有促进肝癌细胞凋亡与焦亡的能力,但其IC50值较高。因此,对大黄素进行基于酶活的小分子药物改造,提高其口服利用度和生物活性是下一步的研究重点。
