新型多肽AMPP2在TGF-β1诱导的系膜细胞增殖中的作用及其机制
2024-01-15张琳琳赵唐明黄婵李善文甘卫华
张琳琳,赵唐明,黄婵,李善文,甘卫华
过敏性紫癜(Henoch-Schonlein purpura,HSP)是儿童时期最常见的血管炎性疾病,20%~54%的患儿可出现肾脏损害[1],常表现为血尿和(或)蛋白尿,称为紫癜性肾炎(Henoch-Schonlein purpura nephritis,HSPN)。HSP的预后与肾脏受累的严重程度有关[2],10%~20%的HSPN 患儿最终进展为肾衰竭或终末期肾病[3],危害儿童健康,因此寻找特异性治疗靶点对该病的诊断和治疗有重要临床意义。系膜细胞的异常增殖是引起HSPN的主要原因[4],故干预其过度增殖或成为HSPN的有效治疗策略。转化生长因子β1(TGF-β1)可参与调控多种细胞增殖、凋亡、氧化应激等过程,是公认用于体外制备系膜细胞增殖模型的细胞因子。研究显示多肽密切参与调控许多病理生理过程,与多种肾脏疾病的发生发展有关[5-7]。本课题组前期采用多肽组学方法在HSPN患 儿 血 清 中 筛 选 出 氨 基 酸 序 列 为HTADSGEGDFLAEGGGVR 的差异性低表达多肽AMPP2[8],其前体蛋白为纤维蛋白原。研究显示,纤维蛋白原参与调节细胞行为,如细胞黏附、迁移、分化、增殖及凋亡等[9]。鉴于多肽往往发挥与其前体蛋白相关的功能,本研究拟探讨AMPP2 在TGF-β1诱导的系膜细胞增殖中的作用及相关机制,以期为HSPN治疗提供新的治疗靶点。
1 材料与方法
1.1 细胞与试剂 小鼠肾小球系膜细胞(SV40 MES13 细胞株)购于武汉普诺赛生命科技有限公司。AMPP2由上海强耀生物科技有限公司合成;TGF-β1购于苏州Novoprotein公司;Trizol 购于美国赛默飞公司;蛋白裂解液购于美国Thermo Scientific 公司;SDS-PAGE 蛋白上样缓冲液、蛋白酶抑制剂、磷酸酶抑制剂购于北京碧云天生物技术有限公司;超敏ECL化学发光底物购于中国biosharp公司;mRNA逆转录试剂盒、qPCR试剂盒、CCK-8试剂盒购于南京诺唯赞公司;兔源α平滑肌肌动蛋白(α-SMA)、细胞周期蛋白依赖性激酶(CDK)-4、CDK-6、SMAD 同源物3(SMAD3)、磷酸化SMAD3(p-SMAD3)一抗,鼠源甘油醛-3-磷酸脱氢酶(GAPDH)一抗购于中国Affinity Biosciences LTD 公司;鼠源细胞增殖核抗原(proliferating cell nuclear antigen,PCNA)一抗购于美国Santa Cruz Biotechnology 公司;兔源Ⅰ型胶原蛋白(COL-Ⅰ)、纤维连接蛋白(fibronectin,FN)一抗购于英国Abcam 公司;羊抗兔、羊抗鼠二抗购于南京凯基生物技术有限公司。
1.2 方法
1.2.1 细胞培养与分组 小鼠系膜细胞用含10%胎牛血清、1%双抗(青霉素100 U/mL、链霉素100 mg/L)的DMEM 培养基进行培养,置于37 ℃、5%CO2培养箱中,隔天换液,待细胞融合率达70%~80%时,用0.25%胰酶进行消化传代,细胞培养至第3—8代用于实验。收集对数生长期的细胞,接种于6孔板内,待细胞贴壁且生长达60%~70%融合率时,更换无血清的DMEM培养基继续培养12 h使细胞同步化后,根据具体实验内容进行分组。用TGF-β1(10µg/L)干预细胞,实验分为Control组和TGF-β1组,验证增殖模型;用TGF-β1(10µg/L)及AMPP2(10 ng/L)干预细胞,实验分为Control 组、AMPP2组、TGF-β1 组和TGF-β1+AMPP2 组;继续孵育48 h 后,收集细胞用于后续实验。
1.2.2 CCK-8 法筛选AMPP2 适宜干预时间、浓度及检测细胞增殖活力 收集对数生长期系膜细胞接种于96孔板,每孔接种细胞数为2×103个,分别用不同质量浓度(0、1、10、100 ng/L)的AMPP2 干预细胞,孵育不同时间(0、24、48、72 h)后,加入10µL CCK-8溶液,在37 ℃培养箱中孵育1~4 h后,使用酶标仪测量细胞在450 nm 波长处的光密度(OD)值,设置空白调零孔(只加DMEM 培养基和CCK-8 溶液),筛选AMPP2 适宜干预时间及浓度。用TGF-β1(10µg/L)、AMPP2(10 ng/L)分组干预细胞48 h,其余步骤同前,检测细胞增殖活力。各组均设置4个复孔,实验重复3次。
1.2.3 Western blot检测目的蛋白表达 用TGF-β1(10µg/L)干预细胞48 h后,弃培养基,用预冷的PBS 洗涤细胞3次,加入细胞裂解液(含有100µL RIPA、1µL蛋白酶抑制剂及1µL磷酸酶抑制剂),使用细胞刮刮下细胞,于冰上裂解1 h,4 ℃、12 000 r/min 离心30 min 后取上清液,BCA 法检测蛋白浓度。每组蛋白上样量为30µg,经SDS-PAGE分离蛋白质,将蛋白转移至PVDF 膜上,室温下5%脱脂奶粉封闭1 h,加鼠源GAPDH 一抗(稀释比例1∶3 000),鼠源PCNA 一抗及兔源CDK-4、CDK-6、COL-Ⅰ及FN 一抗(稀释比例1∶1 000)于4 ℃孵育过夜。次日用TBST 洗膜3 次,加羊抗兔、羊抗鼠二抗(稀释比例1∶2 000)室温孵育2 h,TBST洗膜3次。ECL 显影,凝胶成像仪曝光并记录蛋白条带图像,Image J 软件进行灰度值分析。以GAPDH 为内参,计算细胞增殖相关蛋白及细胞外基质相关蛋白的表达量。用TGF-β1(10 µg/L)及AMPP2(10 ng/L)干预细胞48 h,其余步骤同前,计算细胞增殖相关蛋白、细胞外基质相关蛋白及p-SMAD3/SMAD3 蛋白的表达量。实验重复3次。
1.2.4 qPCR检测目的基因mRNA表达 用TGF-β1(10µg/L)干预细胞48 h后,弃去培养基,用预冷的PBS洗涤细胞3次后置于冰上,用Trizol 试剂提取细胞总RNA,20µL DEPC 水溶解,分光光度计检测浓度及纯度。根据逆转录试剂盒说明书,配制20µL 逆转录反应体系,制备cDNA;依据PCR 试剂盒说明书,配制10µL反应体系,进行qPCR 反应。PCR 引物序列由上海锐真生物公司合成,见表1。根据熔解曲线进行产物特异性分析。以β-actin 为内参,采用2-ΔΔCt法计算细胞外基质相关基因α-SMA、COL-Ⅰ及FN 的相对表达量。用TGF-β1(10µg/L)及AMPP2(10 ng/L)干预细胞48 h,其余步骤同前。各组均设置3个复孔,实验重复3次。

Tab.1 Sequences of qPCR primers表1 qPCR引物序列
1.3 统计学方法 采用GraphPad Prism 9.5软件进行数据分析,计量资料以均数±标准差()表示,2组间均数比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用Tukey法。P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1 诱导小鼠系膜细胞增殖模型的构建 Western blot 结果显示,与Control 组相比,TGF-β1 组CDK-4、CDK-6 及PCNA 的蛋白表达量升高(P<0.05),见图1、表2;TGF-β1组α-SMA、COL-Ⅰ及FN 蛋白表达量也升高(P<0.05),见图2、表3。qPCR 结果显示,与Control 组相比,TGF-β1 组α-SMA、COL-Ⅰ及FN 的mRNA 表达量均显著升高(P<0.05),见表3,以上结果均表明增殖模型构建成功。
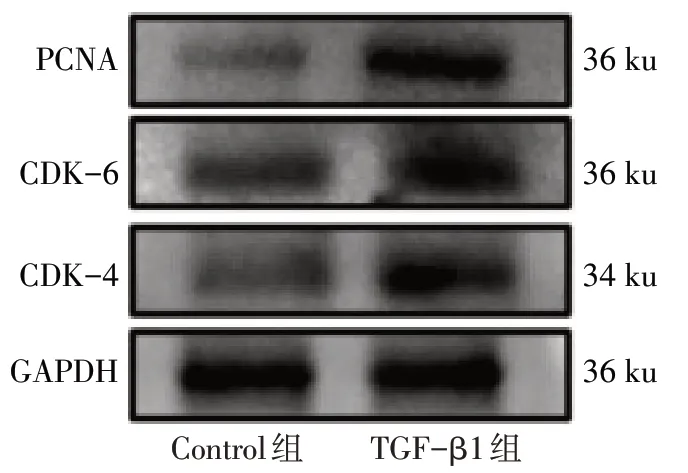
Fig.1 The protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells of two groups图1 2组系膜细胞中CDK-4、CDK-6及PCNA蛋白表达
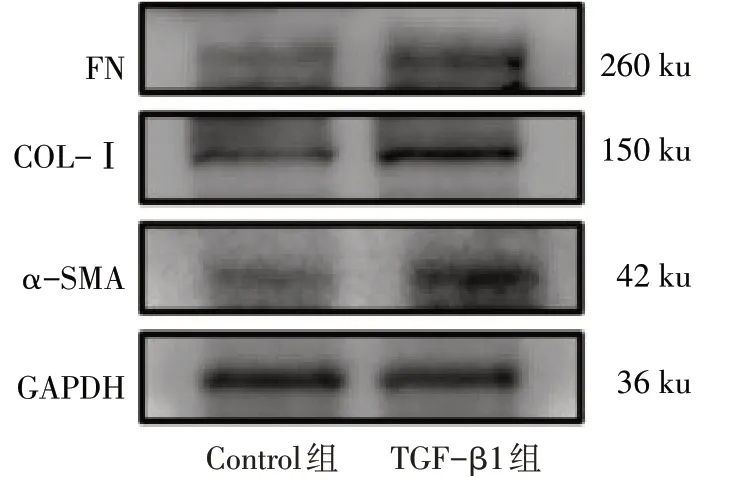
Fig.2 The protein expression levels of α-SMA,COL-Ⅰand FN in mesangial cells of two groups图2 2组系膜细胞中α-SMA、COL-Ⅰ及FN 蛋白表达
Tab.2 Comparison of protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells between two groups表2 2组系膜细胞中CDK-4、CDK-6及PCNA蛋白表达水平比较(n=3,)
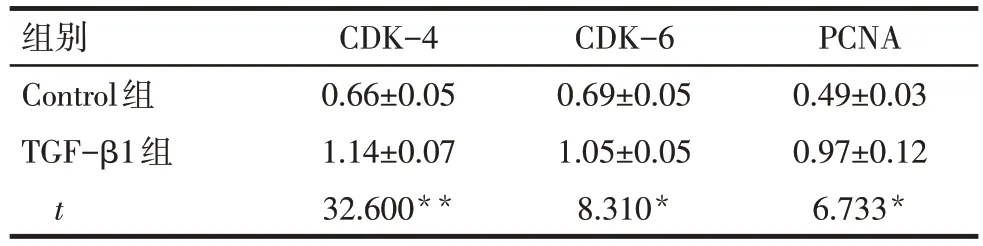
Tab.2 Comparison of protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells between two groups表2 2组系膜细胞中CDK-4、CDK-6及PCNA蛋白表达水平比较(n=3,)
*P<0.05,**P<0.01。
组别Control组TGF-β1组t CDK-4 0.66±0.05 1.14±0.07 32.600**CDK-6 0.69±0.05 1.05±0.05 8.310*PCNA 0.49±0.03 0.97±0.12 6.733*
Tab.3 Comparison of protein and mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between two groups表3 2组系膜细胞α-SMA、COL-Ⅰ及FN蛋白及mRNA表达水平比较(n=3,)
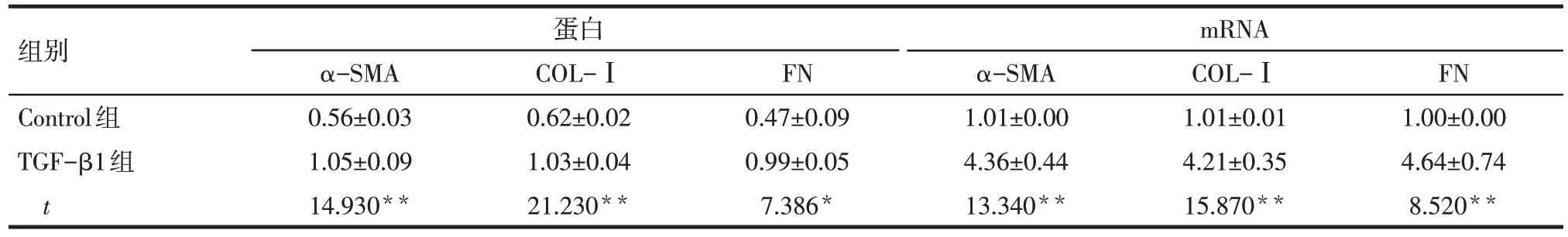
Tab.3 Comparison of protein and mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between two groups表3 2组系膜细胞α-SMA、COL-Ⅰ及FN蛋白及mRNA表达水平比较(n=3,)
*P<0.05,**P<0.01。
组别Control组TGF-β1组t蛋白mRNA α-SMA 0.56±0.03 1.05±0.09 14.930**COL-Ⅰ0.62±0.02 1.03±0.04 21.230**FN 0.47±0.09 0.99±0.05 7.386*α-SMA 1.01±0.00 4.36±0.44 13.340**COL-Ⅰ1.01±0.01 4.21±0.35 15.870**FN 1.00±0.00 4.64±0.74 8.520**
2.2 AMPP2 适宜干预浓度及时间的筛选 见表4。CCK-8 结果显示,干预24 h 后,与TGF-β1+0 ng/L AMPP2 组相比,TGF-β1+100 ng/L AMPP2 组细胞活力下降(P<0.05),1 ng/L 和10 ng/L AMPP2 作用不明显(P>0.05);干预48 h 后,AMPP2 各剂量组细胞活力均下降(P<0.05),其中10 ng/L AMPP2 组差异更显著;干预72 h 后,AMPP2 各剂量组细胞活力亦均下降(P<0.05)。与0 h 相比,不同干预时间的各组细胞活力均有差异(P<0.05);与24 h 相比,干预48 h 后TGF-β1+10 ng/L AMPP2 组细胞活力下降(P<0.05),其余2 组细胞活力差异无统计学意义(P>0.05);而干预72 h 后仅10 ng/L 及100 ng/LAMPP2 组细胞活力下降(P<0.05);与48 h 相比,干预72 h 后各组细胞活力差异无统计学意义(P>0.05)。因此本研究选择AMPP2 的干预质量浓度为10 ng/L,干预时间为48 h。
Tab.4 Comparison of mesangial cell proliferation at different time points between four groups表4 4组系膜细胞不同时间点增殖情况比较(n=3,)
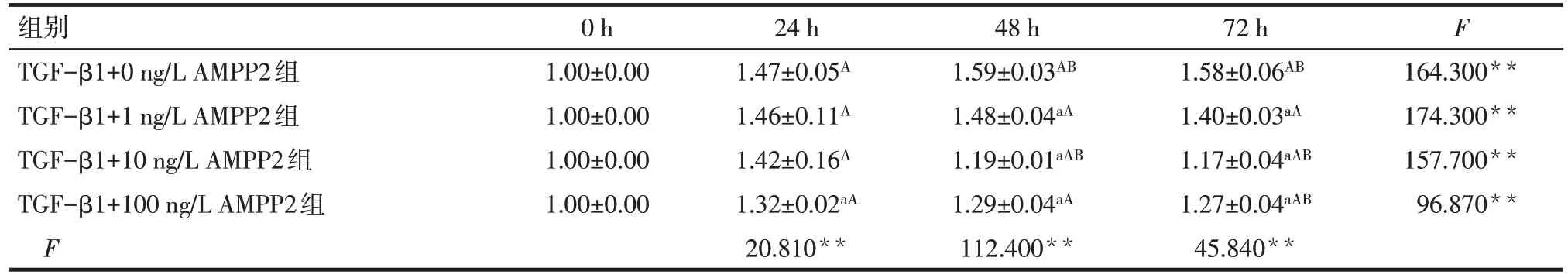
Tab.4 Comparison of mesangial cell proliferation at different time points between four groups表4 4组系膜细胞不同时间点增殖情况比较(n=3,)
**P<0.01;a与TGF-β1+0 ng/L AMPP2组比较,A与0 h比较,B与24 h比较,P<0.05。
组别TGF-β1+0 ng/L AMPP2组TGF-β1+1 ng/L AMPP2组TGF-β1+10 ng/L AMPP2组TGF-β1+100 ng/L AMPP2组F 0 h 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 24 h 1.47±0.05A 1.46±0.11A 1.42±0.16A 1.32±0.02aA 20.810**48 h 1.59±0.03AB 1.48±0.04aA 1.19±0.01aAB 1.29±0.04aA 112.400**72 h 1.58±0.06AB 1.40±0.03aA 1.17±0.04aAB 1.27±0.04aAB 45.840**F 164.300**174.300**157.700**96.870**
2.3 AMPP2 对系膜细胞增殖活力的影响 CCK-8结果显示,与Control 组相比,TGF-β1组细胞活力增加;与TGF-β1 组相比,TGF-β1+AMPP2 组细胞活力降低;与Control 组相比,AMPP2 组细胞活力差异无统计学意义(P>0.05),见图3。
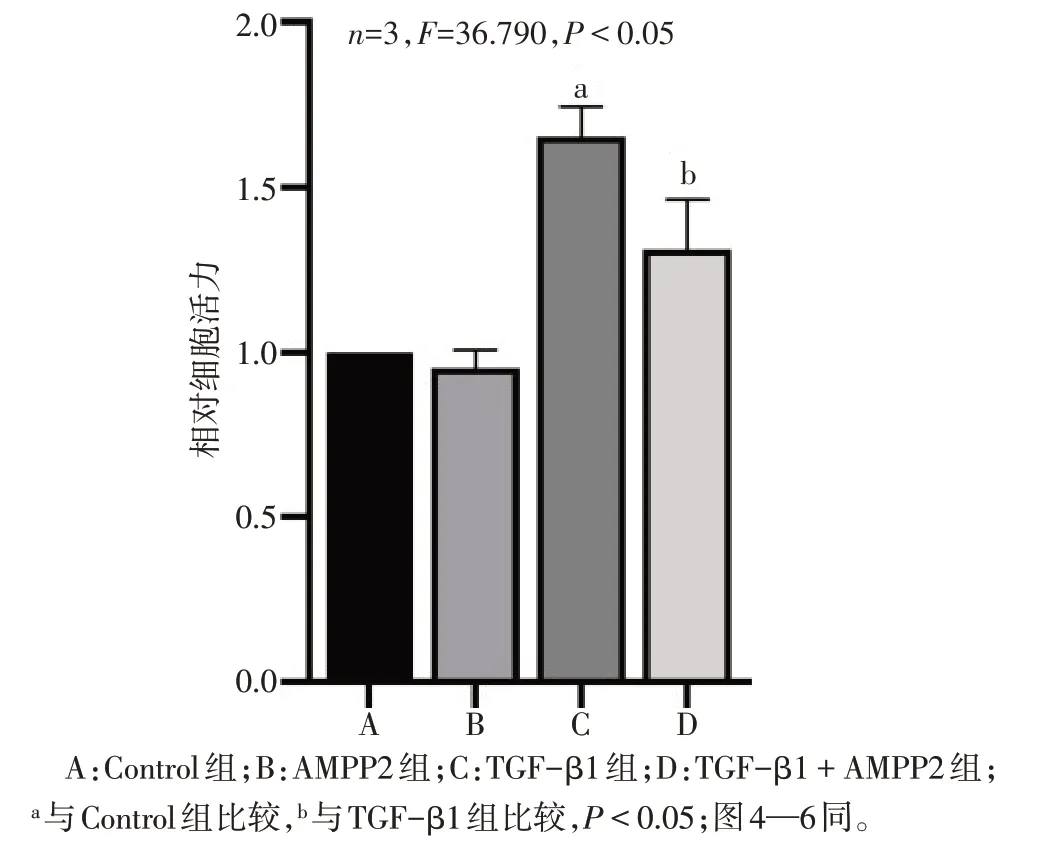
Fig.3 Effects of AMPP2 on mesangial cell proliferative activity图3 AMPP2对细胞活力的影响
2.4 AMPP2 对系膜细胞增殖及细胞外基质相关基因表达的影响 Western blot 结果显示,与Control组相比,TGF-β1 组CDK-4、CDK-6 及PCNA 的蛋白表达量升高(P<0.05);与TGF-β1 组相比,TGF-β1+AMPP2 组上述蛋白表达量降低(P<0.05);AMPP2组上述蛋白表达量与Control 组相比变化差异无统计学意义(P>0.05),见图4、表5。与Control 组相比,TGF-β1 组α-SMA、COL-Ⅰ及FN 的蛋白表达量升高(P<0.05);与TGF-β1 组相比,TGF-β1+AMPP2组α-SMA、COL-Ⅰ及FN的蛋白表达量降低(P<0.05);与Control 组相比,AMPP2 组上述蛋白表达量变化差异无统计学意义,见图5、表6。qPCR结果显示,各相关基因与蛋白变化相同,见表7。
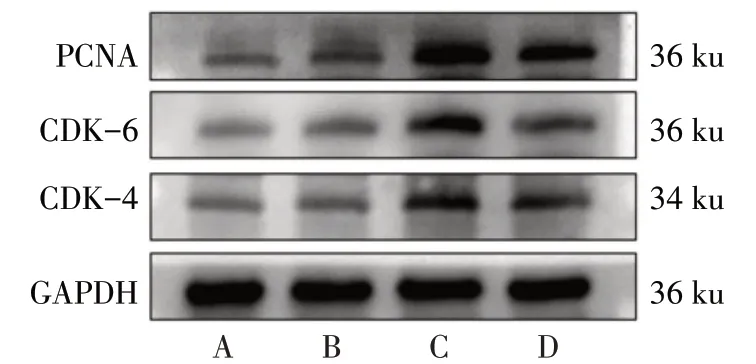
Fig.4 The protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells in four groups图4 4组系膜细胞中CDK-4、CDK-6及PCNA蛋白表达
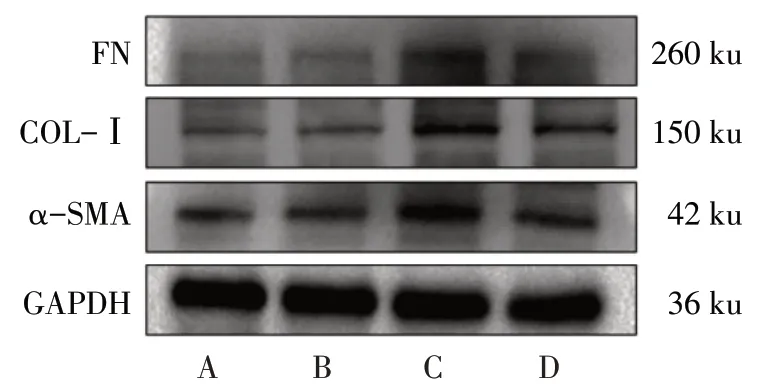
Fig.5 The protein expression levels of α-SMA,COL-Ⅰand FN in mesangial cells of four groups图5 4组系膜细胞中α-SMA、COL-Ⅰ及FN蛋白表达
Tab.5 Comparison of protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells between four groups表5 4组系膜细胞CDK-4、CDK-6及PCNA蛋白表达水平比较(n=3,)
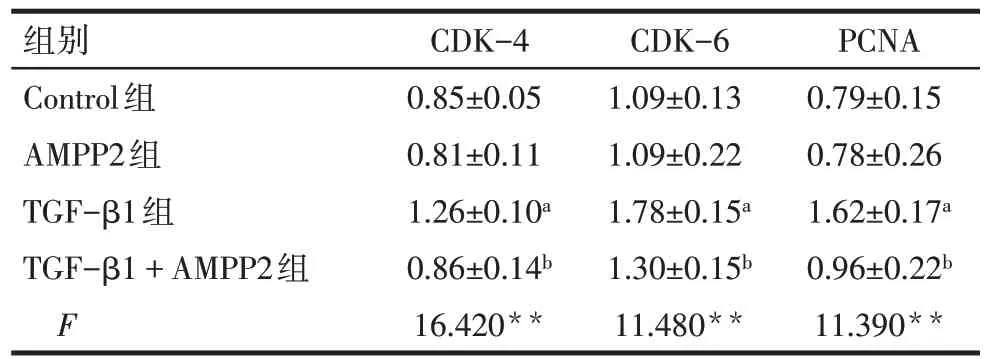
Tab.5 Comparison of protein expression levels of CDK-4,CDK-6 and PCNA in mesangial cells between four groups表5 4组系膜细胞CDK-4、CDK-6及PCNA蛋白表达水平比较(n=3,)
**P<0.01;a 与Control 组比较,b 与TGF-β1 组比较,P<0.05;表6、7同。
组别Control组AMPP2组TGF-β1组TGF-β1+AMPP2组F CDK-4 0.85±0.05 0.81±0.11 1.26±0.10a 0.86±0.14b 16.420**CDK-6 1.09±0.13 1.09±0.22 1.78±0.15a 1.30±0.15b 11.480**PCNA 0.79±0.15 0.78±0.26 1.62±0.17a 0.96±0.22b 11.390**
Tab.6 Comparison of mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between four groups表6 4组系膜细胞α-SMA、COL-Ⅰ及FN蛋白表达水平比较(n=3,)

Tab.6 Comparison of mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between four groups表6 4组系膜细胞α-SMA、COL-Ⅰ及FN蛋白表达水平比较(n=3,)
组别α-SMACOL-ⅠFN Control组AMPP2组TGF-β1组TGF-β1+AMPP2组F 0.63±0.08 0.60±0.05 1.20±0.11a 0.76±0.13b 32.660**0.85±0.10 0.81±0.12 1.23±0.08a 0.94±0.16b 12.520**0.67±0.05 0.60±0.01 1.24±0.19a 0.89±0.09b 20.940**
Tab.7 Comparison of mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between four groups表7 4组系膜细胞α-SMA、COL-Ⅰ及FN mRNA表达水平比较(n=3,)

Tab.7 Comparison of mRNA expression levels of α-SMA,COL-Ⅰand FN in mesangial cells between four groups表7 4组系膜细胞α-SMA、COL-Ⅰ及FN mRNA表达水平比较(n=3,)
组别Control组AMPP2组TGF-β1组TGF-β1+AMPP2组F α-SMA 0.99±0.03 0.90±0.06 4.03±0.45a 1.58±0.14b 98.530**COL-Ⅰ1.02±0.01 0.88±0.10 4.37±0.25a 1.68±0.52b 110.800**FN 0.92±0.03 0.92±0.11 4.12±0.60a 1.73±0.34b 54.750**
2.5 AMPP2 对系膜细胞TGF-β1/SMAD3 信号通路的影响 Western blot 结果显示,与Control 组相比,TGF-β1 组p-SMAD3/SMAD3 水平显著上调(P<0.05);与TGF-β1 组相比,TGF-β1+AMPP2 组p-SMAD3/SMAD3 水平显著下调(P<0.05);与Control组相比,AMPP2 组p-SMAD3/SMAD3 水平差异无统计学意义(P>0.05),见图6。

Fig.6 The protein expression levels of p-SMAD3/SMAD3 in mesangial cells in four groups图6 4组系膜细胞中p-SMAD3/SMAD3蛋白表达
3 讨论
3.1 HSPN 体外模型构建 HSPN 是儿童最常见的继发性肾脏疾病,研究表明系膜细胞的异常增殖与其发生发展密切相关[10],因此干预系膜细胞增殖或能成为其有效防治手段。本研究利用TGF-β1干预系膜细胞后,细胞增殖和细胞外基质相关基因表达水平明显高于Control 组,表明TGF-β1 可诱导系膜细胞增殖,与文献[11]结果一致。
3.2 AMPP2可抑制系膜细胞异常增殖 近年来,越来越多与肾脏疾病相关的多肽被发现[5-7]。与化学药物相比,多肽类药物更有效、更安全、耐受性更强,具有选择性高、体内蓄积少等优点,在治疗肾脏疾病方面有一定的优势[12]。本课题组前期研究发现,HSPN 患儿血清中AMPP2 低表达,利用the UniProt数据库分析前体蛋白的相关信息,发现其对应前体蛋白为纤维蛋白原[8]。纤维蛋白原在哺乳动物和无脊椎动物中普遍表达[13],与肾脏生理、病理过程密切相关,在肾淀粉样变性[14]、肾细胞癌[15]、免疫球蛋白A(IgA)肾病[16]、肾病综合征[17]中均有研究。鉴于多肽功能与其前体蛋白相关,提示AMPP2在肾脏疾病中有发挥作用的潜能。目前尚无研究证明AMPP2和系膜细胞增殖之间的关系。本研究发现,不同质量浓度的AMPP2干预TGF-β1诱导的系膜细胞48 h时各组系膜细胞增殖均受到抑制,AMPP2质量浓度为10 ng/L时抑制效果最显著,干预72 h的抑制效果与48 h相当,因此选择10 ng/L为最适干预浓度,48 h为最佳干预时间。此外,本研究表明,在TGF-β1诱导的系膜细胞增殖模型中加入AMPP2后,系膜细胞增殖活力下降,系膜细胞增殖相关基因CDK-4、CDK-6、PCNA 等蛋白表达水平显著下降,细胞外基质α-SMA、COL-Ⅰ、FN等mRNA及蛋白表达水平显著降低;而将AMPP2 加入正常系膜细胞后,系膜细胞增殖和细胞外基质相关基因表达水平无明显变化,表明AMPP2 能抑制系膜细胞异常增殖,对正常系膜细胞无抑制作用,但AMPP2调控系膜细胞增殖的具体机制还有待进一步研究。
3.3 AMPP2 通过抑制TGF-β1/SMAD3 通路抑制系膜细胞增殖 TGF-β1是一种多功能细胞因子,可调节多种细胞的增殖、分化、凋亡、黏附和迁移过程[18]。TGF-β1是引起肾脏纤维化的关键介质,主要通过直接激活SMAD 信号,从而触发促纤维化基因的过度表达[19],其中SMAD3 的磷酸化是TGF-β1 信号传导的关键步骤。Li 等[7]研究发现格列鲁肽通过抑制TGF-β1/SMAD3通路激活阻止肾纤维化。本研究发现,将AMPP2 加入TGF-β1 诱导的系膜细胞增殖模型后,SMAD3 磷酸化水平降低,表明AMPP2 可能通过抑制TGF-β1/SMAD3通路发挥其抑制系膜细胞异常增殖的作用。
综上所述,本研究发现AMPP2 可以显著抑制TGF-β1 诱导的系膜细胞增殖,其可能是通过调控TGF-β1/SMAD3 通路来发挥作用的,为HSPN 的临床治疗提供了新思路和治疗靶点。然而,AMPP2在体内能否发挥相同的生物学作用仍有待进一步研究。
