环氧丁烷开环胺解合成β-氨基醇
2024-01-15孙艳荣马利国张志鹏李赛松李冬至李双雯
孙艳荣,马利国,张志鹏,李赛松,李冬至,申 鹏,李双雯
北华航天工业学院材料工程学院,河北省热防护材料重点实验室,河北 廊坊 065000
β-氨基醇是应用很广泛的有机合成中间体,也是良好的有机合成催化剂。β-氨基醇可用来进行二乙基锌和酮的不对称性加成化学反应[1]、不对称性环氧化反应[2-3]和不对称催化Henry 反应[4],在不对称性反应催化剂研究中是主要的手性辅助化学试剂和手性配体,在参与的反应中表现出良好的立体催化活性[5],在人工合成拟肾上腺激素、β-受体阻滞剂[6]和具有抗癌活性的丁香酚[7]等手性药物中也都存在着β-氨基醇的结构单位,因此,β-氨基醇的制备以及寻找合成β-氨基醇的有效简便方法成为了研究热点。
环氧化合物开环胺解反应是制备β-氨基醇的常用方法。该反应过程通常需要过量的胺类化合物,且反应在高温下进行,由于大部分胺的亲核性弱、空间位阻大,会导致反应不均匀,而高温环境下某些高敏感性官能团会产生不良反应[8]。因此,开发了许多催化剂用于此反应来克服这些缺点。Chakravarti 等[9]以Pluronic F127 为结构导向剂,在高酸性介质中制备了具有笼型孔结构的铝硅酸盐催化剂AIKIT-5,用于催化环氧化合物与各种芳香族和脂肪族胺的反应;Robinson 等[10]采用蒸发诱导自组装(EISA)方法合成的纳米多孔铝硅酸盐材料催化芳香族化合物生成氨基醇;Mojtahedi 等[11]在无溶剂条件下,以MgBr2·OEt2为催化剂催化各种环氧化物与芳香族和脂肪族胺室温下开环胺解。由于这些催化剂的合成比较麻烦,开环胺解反应的副产物较多,人们研发了一些简单催化剂。Lee 等[12]采用阳离子Al-salen-Lewis 酸和非配位阴离子如BPh4-组成的催化剂催化环氧化物和苯胺反应,以很高的区域选择性和较高的产率成功地使多种环氧化物开环胺解,利用伯胺和仲胺选择性合成了β-氨基醇。Ji 等[13]合成了一种高活性固体Lewis 酸催化剂(ZrOTf-BTC),可在温和条件下催化环氧化物和芳香酮形成,以及环氧化物的区域选择性开环生成β-氨基醇;Yang 等[14]分别使用Li2CO3,Na2CO3和K2CO3催化烷基磺酰胺对环氧化物的开环反应,通过两步Smiles 重排实现了无金属β-氨基醇合成,研究发现K2CO3催化时具有更高的产物收率,该反应对N-芳基化的氨基醇尤其有效。Azizi 等[15]利用Tb2(WO4)3@N-GQDs-FA 多相纳米催化剂催化一系列胺类化合物和不同选择性的环氧化物反应合成了β-氨基醇;Said 等[16]以水作为催化剂,将(R)-(+)-α-甲基苄胺转化为两种仲胺和氨基甲酸酯,再与(+)-柠檬烯1,2-环氧化物反应合成得到两种新的β-氨基醇化合物。杨飞飞等[8]利用咪唑阴离子型碱性离子液体催化环氧化合物与芳香胺反应,在水溶剂下合成了β-氨基醇。杜正银等[17]则用水或甲醇水溶液作溶剂在一定温度下进行无催化剂的烟酰胺类化合物与环氧化物的热开环加成化学反应,也制备了一系列β-氨基仲醇。本工作从提高产物收率、简化反应过程和绿色环保化学角度出发,探索温和条件下环氧丁烷和戊胺无催化开环胺解反应合成β-氨基醇类化合物的可能性,以及优化合成条件。
1 实验部分
1.1 β-氨基醇制备
将戊胺加入装有溶剂的容器中,搅拌成均相后在混合溶液中通入二氧化碳直至测得pH 值为7.4,然后缓慢滴入环氧丁烷,滴加完成后在室温下搅拌反应3 h,反应液定时用薄层色谱(TLC)分析。反应结束后加10 mL 乙醚进行萃取,用分液漏斗分离。含有产物的乙醚溶液加入无水Na2SO4干燥,过滤后在通风橱中用氮气吹扫1 h,浓缩得到粗产物,再进行柱色谱分离提纯。
1.2 环氧丁烷开环胺解反应产物分析
环氧丁烷(A)的开环主要发生在碳基团,其被戊胺(B)上的胺基高度取代形成羟基,得到收率最多的产物C(目标产物)和极其少量链端开环的产物D;另外由于戊胺单胺上的两个氢是等量的,产物C 还可以继续与环氧丁烷反应生成少量的二取代副产物E,如式(1)所示[8,18]。目标产物的收率为产物C 生成的物质的量与进料中反应物A 的物质的量之比。
2 结果与分析
2.1 溶剂的选择
环氧化物的开环胺解反应是一种亲核取代反应,由于胺类物质能够作为亲核试剂攻击环氧化物的碳键并生成C—H 键,其本身和产生的β-氨基醇类物质都获得了更高的配位结合能力[19-20]。但是,由于部分芳香胺的亲核性较弱,在无溶剂情况下反应时间较长,再者部分胺的沸点低,在无溶剂情况下会挥发产生浪费,而在有溶剂时胺溶解在溶剂中,不易挥发。于是,考察了不同溶剂对环氧丁烷与戊胺开环胺解反应的影响。在环氧丁烷和戊胺的物质的量比为1:15(环氧丁烷为34.8 µL,戊胺为693 µL)的条件下,常温反应至析出产物为止,在相同体积用量的去离子水、乙腈或甲醇溶剂体系中产物C 的收率分别为89%,61%和43%。根据不同溶剂反应下的产物转化率可知,去离子水溶剂参与反应时产物的区域选择性要比其他溶剂参与反应时产物的区域选择性高。实验中发现,戊胺在甲醇中溶解性很小,在乙腈中溶解性也不好,而在去离子水中的溶解性很好,表明在去离子水参与反应的情况下,反应更均匀,同时因为去离子水廉价易得,环保无毒,所以选择去离子水作为反应溶剂更好。
2.2 去离子水用量的影响
为了考察水溶剂用量对环氧丁烷开环胺化反应结果的影响,在环氧丁烷和戊胺的物质量比为1:15(环氧丁烷为34.8 µL,戊胺为693 µL),常温,反应3 h 的条件下,不同去离子水剂量体系中环氧丁烷和戊胺的反应结果见表1。由反应结果可知,在环氧化物开环胺解反应中,当水溶剂加入的量不同时,其反应效果相差很大。当去离子水的剂量为2 mL 时,产物C 的收率可达82%,由2 mL 增加到3 mL 时,产物C 的收率相应提高;但水剂量再增加时,由于水量的增加和极性的原因,使原料与水中羟基反应的比例增加,环氧化物会发生聚合或重排,造成产物C 收率下降。用去离子水作此反应的促进剂,在取得好的反应效果的同时可以合理地对其加以处理再使用,不但无污染,同时节约资源,而且反应的后处理也相对容易便捷。因此,确定去离子水的用量以2~3 mL 为宜。

表1 不同去离子水用量下产物C 的收率Table 1 Yield of product C with different amount ofdeionized water
2.3 反应温度的影响
在化学反应中,反应温度对反应速度以及反应产物分布的影响很大。在环氧丁烷和戊胺的物质量比为1:15(环氧丁烷为34.8 µL,戊胺为693 µL),水溶剂为2.5 mL,反应时间为3 h 的条件下,考察了不同反应温度下环氧丁烷和戊胺的反应,结果如表2 所示。从表2 可以看出,反应温度为0 ℃时产物C 的收率很低,只有42%,这是因为在固定的时间内胺类化合物在低温下不能完全溶解,反应后溶液呈浑浊体,导致反应效果不够好。当反应温度为10 ℃时产物C 收率最高,约为87%,说明此温度下胺类化合物的溶解性对反应基本没有影响,有利于产物C 的收率提高。进一步提高反应温度,产物C 的收率则降低,说明副产物反应对温度更敏感。综合考虑选择反应温度为10 ℃较佳。

表2 不同反应温度下产物C 的收率Table 2 Yield of product C at different reactiontemperatures
2.4 原料比的影响
在水溶剂为2.5 mL,戊胺为693 µL,反应温度为10 ℃,反应时间为3 h 的条件下,考察了环氧丁烷滴加量不同(即环氧丁烷与戊胺的物质的量比不同)时产物C 的收率,结果见表3。由表3 可以看出,在反应条件下环氧丁烷与戊胺的物质的量比为1:15 时目标产物C 的收率最高。因为环氧化物在反应过程中会发生自身水解,戊胺浓度的增加有利于产物C 的生成,环氧化物水解的比例相对减小,目标产物C 的收率增加。但实验中环氧丁烷的滴加量更小时(如环氧丁烷为26 µL),实验操作误差对结果的影响较大,导致目标产物C 的收率下降。
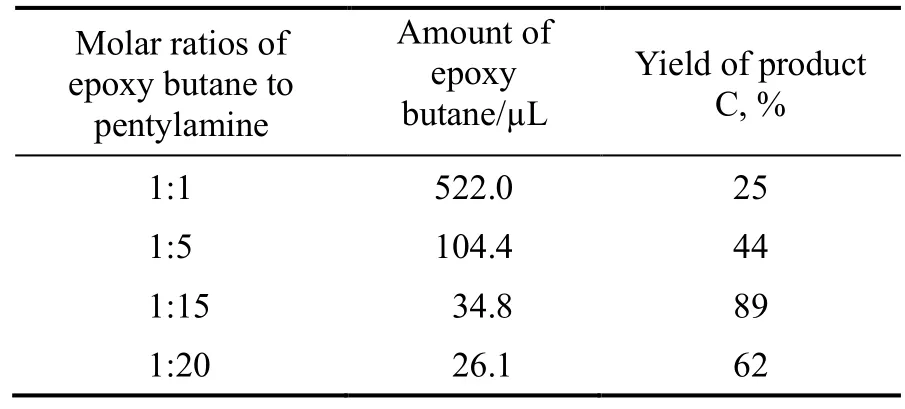
表3 不同原料比时产物C 的收率Table 3 Yield of product C with different ratios ofraw materials
3 结 论
研究了溶剂中胺类化合物对环氧化物的开环加成反应,在良好的反应条件下成功制备了β-氨基醇。初步考察了溶液类型、反应温度、反应投料比例和溶剂用量对目的产物C 收率的影响。环氧丁烷在无催化剂去离子水溶剂反应体系中的开环胺解反应操作简便,去离子水容易得到且环保安全,产物选择性好,是一种合乎“绿色化学”、环境友好的β-氨基醇制备技术。
