广西鸭源H3N8亚型禽流感病毒的分离鉴定及遗传进化分析
2024-01-15李孟李丹谢芝勋罗思思张民秀谢丽基华俊粟永春翟国胜黄娇玲陈智武
李孟 李丹 谢芝勋 罗思思 张民秀 谢丽基 华俊 粟永春 翟国胜 黄娇玲 陈智武

摘要 [目的]了解广西水禽中分离到的H3N8亚型禽流感病毒的分子遗传进化特征。[方法]将从活禽市场采集的水禽棉拭子样品经处理后接种SPF鸡胚,应用血凝试验和血凝抑制试验对收取尿囊液进行血清学鉴定,然后对分离到的禽流感病毒进行全基因序列测定和遗传进化分析。[结果]血清学及HA和NA基因测序结果显示,该分离毒株为H3N8亚型禽流感病毒,命名为A/duck/Guangxi/446D28/2021(H3N8)。全基因遗传进化分析显示,其HA蛋白无连续碱性氨基酸插入,符合典型低致病性禽流感病毒的特征;NA蛋白出现耐药性氨基酸位点突变;该毒株8个基因片段在GenBank中比对分析结果显示,其同源性最高的毒株基本主要来自越南和位于我国候鸟迁徙路线上的宁夏及江西等省(区)。[结论]该分离株可能是不同亚型禽流感病毒通过相互基因交换所形成的基因重组体。
关键词 禽流感病毒;H3N8;水禽;基因重组
中图分类号 S852.65 文献标识码 A 文章编号 0517-6611(2024)01-0072-06
doi:10.3969/j.issn.0517-6611.2024.01.016
开放科学(资源服务)标识码(OSID):
Isolation, Identification and Genetic Evolution Analysis of Avian Influenza Virus H3N8 from Ducks in Guangxi
LI Meng, LI Dan, XIE Zhi-xun et al
(Guangxi Veterinary Research Institute, Guangxi Key Laboratory of Veterinary Biotechnology, Key Laboratory of China(Guangxi)-ASEAN Cross-border Animal Disease Prevention and Control, Ministry of Agriculture and Rural Affairs, Nanning, Guangxi 530001)
Abstract [Objective] To understand the molecular genetic evolution characteristics of H3N8 subtype avian influenza virus isolated from waterfowl in Guangxi. [Method] The cotton swab samples collected from live poultry market were treated and inoculated into SPF chicken embryos. The collected allantoic fluid was serologically identified by hemagglutination test and hemagglutination inhibition test, and then the whole gene sequence and genetic evolution analysis of the isolated avian influenza virus were carried out. [Result] Serological HA and NA gene sequencing results showed that the isolated strain was H3N8 subtype avian influenza virus, named A/duck/Guangxi/446D28/2021 (H3N8). Genetic evolution analysis of the whole gene showed that there was no continuous basic amino acid insertion in HA protein, which accorded with the characteristics of typical low pathogenic avian influenza virus. NA protein appeared drug-resistant amino acid site mutation;The results of comparative analysis of eight gene fragments of this strain in GenBank showed that the strains with the highest homology mainly came from Vietnam, Ningxia and Jiangxi provinces, which are located on the migratory route of migratory birds in China. [Conclusion] The isolated strain may be a gene recombinant formed by gene exchange among different subtypes of avian influenza viruses.
Key words Avian influenza virus;H3N8;Waterfowl;Gene recombination
基金項目 广西重点研发计划项目(桂科AB21076004));广西自然科学基金项目(2022GXNSFAA035445,2021GXNSFBA196031);“广西八桂学者”专项(桂科专项21-1)。
作者简介 李孟(1981—),男,河南南阳人,正高级兽医师,博士,从事病原分子生物学研究。
*通信作者,研究员,从事动物疫病防控研究工作。
收稿日期 2023-01-13
流感病毒(influenza virus)属于正黏病毒科流感病毒属[1]。根据流感病毒表面的血凝素(HA)和神经氨酸酶(NA)2种蛋白可分为多个不同的亚型,目前已知HA亚型有18种,NA亚型有11种[2-3]。H3亚型禽流感病毒(avian influenza virus,AIV)属于低致病性AIV(LPAIV),是LPAIV中的主要亚型之一。H3亚型AIV不仅引发犬流感、猪流感和马流感等疾病,还可以通过基因重组跨越种属屏障感染人类[4-5]。1968年香港流感病毒(H3N2)大流行引发人们对H3亚型流感禽源重配毒株的重视[6]。研究表明,H3亚型AIV在LPAIV流行病学调查中具有较高的分离率,H3亚型AIV主要亚型组合包括H3N2、H3N3、H3N6和H3N8[7-8]。
H3N8亚型AIV主要存在于野生水禽体内,通常分为禽源与马源,不仅可以感染禽类,还可能感染一些哺乳动物。Scholtens等在1963年首次报道了马感染H3N8亚型AIV,而且禽源A/Equine /Jilin /1963(H3N8)流感病毒曾引起我国黑龙江省马流感的暴发,并造成马匹死亡[9]。研究表明,马源H3N8亚型AIV不仅感染马、骡和驴,还能够引起犬和猪感染发病[10]。Anthony等报道了H3N8亚型AIV引起海豹死亡的事件[11]。近年来,H3N8亚型AIV在我国野鸟和活禽市场中被分离到,2021年起引起鸡群发病的新型H3N8亚型AIV也在我国南方鸡群中被监测到[12-13]。2022年4月,我国河南省报道了全球首例人感染H3N8亚型AIV[14]事件。2022年5月,我国湖南省发现全球第二例人感染H3N8亚型AIV病例,即一名儿童与禽类同时感染H3N8亚型AIV的病例[15]。上述研究表明,H3N8亚型AIV的宿主范围在不断地扩大,可以跨越种属屏障感染哺乳动物和人类,严重威胁人类公共卫生安全。
广西地处热带和亚热带,毗邻流感疫情复杂的越南,还位于候鸟路线上,同时具备流感病毒生存与传播的天然条件,被国内外众多学者描述为“流感起源中心”之一[16]。每年大量的候鸟携带流感病毒经过广西迁徙,对广西流感的流行及防控带来巨大影响[17]。近年发生的人感染H3N8亚型AIV事件及H3N8亚型AIV引起鸡群发病的报道引发人们对H3亚型AIV的广泛关注。为进一步了解广西H3亚型AIV的遗传进化情况,笔者对从健康鸭中分离到的一株H3N8亚型AIV进行了全基因序列测定和遗传进化分析,以期为广西H3N8亚型AIV的防控提供理论支撑。
1 材料与方法
1.1 材料
1.1.1 样品与鸡胚。
2021年从广西南宁地区不同活禽交易市场采集鸭和鹅的口咽及泄殖腔棉拭子样品,所有样品存放在含有4种抗生素的保存液中。样品经低温运输至广西兽医生物技术重点实验室存放于-80 ℃冰箱备用。1龄SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司,自行孵化至9~11日龄用于病毒分离鉴定。
1.1.2 主要试剂。
RNA核酸提取试剂盒、琼脂糖凝胶回收试剂盒、DH5α大肠杆菌化学感受态细胞和平末端连接载体试剂盒pEASY-Blunt Cloning Kit均购自北京全式金生物技术有限公司;DNA Marker 1 000 bp、高保真PCR Mix、Uni-12随机引物、dNTP、cDNA第一链合成用的MLV反转录酶及RNA酶抑制剂购自宝生物工程(北京)有限公司;唾液酸酶6’-Sialyllactose-PAA-biotin(6’SL-PAA)和3’-Sialyllactose-PAA-biotin(3’SL-PAA)均购自GlycoTech公司;TMB 过氧化物酶(HRP)底物的即用型溶液购自北京天根生物科技有限公司;Streptavidin-HRP过氧化物酶购自美国R&D systems公司;其余试剂购自商业公司,均为国产分析纯。
1.1.3 引物设计及合成。
参照相关文献[18]及GenBank中已发表的H3亚型AIV全基因序列,利用Premier 7.0和Oligo 6.0软件设计针对H3亚型AIV基因组8个节段的特异性引物用于扩增A/duck/Guangxi/446D28/2021(H3N8)的全基因,引物由华大基因科技有限公司合成。
1.2 方法
1.2.1 病毒的分离鑒定及纯化。
将南宁市活禽交易市场采集到的家禽棉拭子样品放置在低温保藏箱中快速转运至实验室进行处理,处理后的样品上清液接种10日胚龄SPF鸡胚,每个样品0.2 mL/枚分别接种2枚鸡胚,在35 ℃条件下孵化96 h;采集24~96 h死亡和未死亡鸡胚尿囊液,用血凝试验(HA)和血凝抑制试验(HI)对其进行血清学鉴定,根据鉴定结果初步确定样品中所含禽流感病毒的HA亚型。将确定为H3亚型AIV病毒株尿囊液接种于鸡胚成纤维细胞(CEF),参照通过空斑纯化进行连续3轮的克隆纯化,再接种SPF鸡胚对纯化后的H3亚型毒株进行增殖并用HA试验验证,将收获的尿囊液置于-80 ℃保存备用。
1.2.2 病毒RNA的提取与RT-PCR扩增。
使用RNA抽提试剂盒按照说明书提取收获的病毒尿囊液总RNA,利用流感病毒Uni-12通用引物按照试剂盒说明书进行cDNA第一链的合成。根据不同目的基因引物特异性设计不同的PCR扩增程序,分别对8个基因片段进行PCR扩增。扩增产物采用1.0%琼脂糖凝胶电泳对目的片段进行检测和纯化。
1.2.3 PCR产物的回收纯化及克隆测序。
将目的片段按照胶回收试剂盒说明书进行回收纯化,然后将回收产物与快速克隆载体进行连接后转化至感受态细胞中,涂板经抗生素筛选培养后,挑取单个菌落进行菌液PCR鉴定,每个基因挑选3个不同阳性克隆菌液送华大基因(广州)公司进行序列测定。
1.2.4 分离株遗传进化及耐药性分析。
用DNASTAR软件对毒株各个基因测序结果进行比对和整理,将整理结果与NCBI中的相关参考毒株进行分析和确认。同时应用MEGA6.0软件对选择的有代表性参考毒株和分离株的各个基因进行比对分析并构建其遗传进化树,进而分析分离毒株的遗传演化情况。使用DNASTAR5.0生物软件对分离株NA基因氨基酸序列进行分析,并与NAI类药物敏感参考株A/California/07/2009(登录号FJ98386)的NA基因序列进行比对分析。
1.2.5 分离株受体亲和特性的测定。
用包被缓冲液将446D28毒株尿囊液稀释至HA效价为1∶128,按100 μL/孔将稀释好的病毒液加入96孔ELISA板中,将上述样品板放置在4 ℃冰箱包被过夜,设空白对照;将6’SL-PAA及3’SL-PAA唾液酸酶分别稀释至4个不同的梯度,每个稀释梯度设3次重复,按照操作说明进行加样和洗板,病毒和受体反应终止后加入终止液,将反应板放入酶标仪读取样品在450 nm波长下的吸光值并分析结果。
2 结果与分析
2.1 病毒的鉴定及纯化结果
笔者从收集HA试验效价大于1∶16的样品鸡胚尿囊液进行HI试验。446D28样品HI试验结果表明,该样品仅与H3亚型AIV血清发生血凝抑制作用,而与其他HA亚型AIV和NDV抗血清没有任何交叉反应,初步确定该分离株为H3亚型AIV。毒株尿囊液接种于CEF细胞上经过3轮蚀斑纯化后并用SPF鸡胚增殖的鸡胚尿囊液HA效价为26。
2.2 病毒全基因PCR扩增及测序
RT-PCR扩增均得到与引物设计预期大小相符合的目的基因条带。各目的基因经克隆和PCR鉴定阳性后送公司测序,测序结果应用DNAStar软件进行比对,将拼接后的基因序列进行同源性的BLAST比对分析。比对的结果表明,HA和NA基因与H3及N8亚型AIV的核苷酸同源性最高。因此,将该分离毒株命名为A/duck/Guangxi/446D28/2021(H3N8)。
2.3 分离株各基因片段的序列比对及遗传进化分析
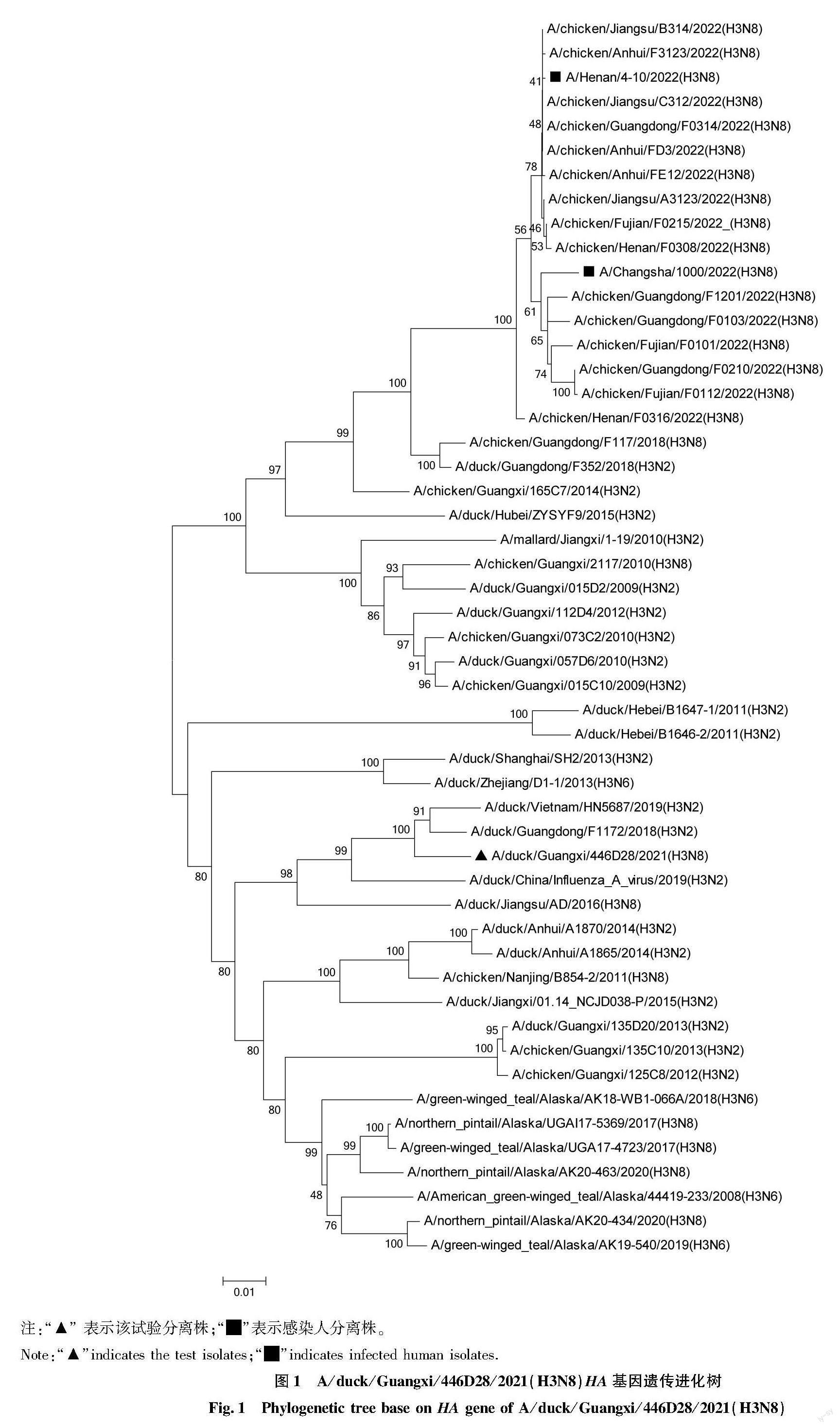
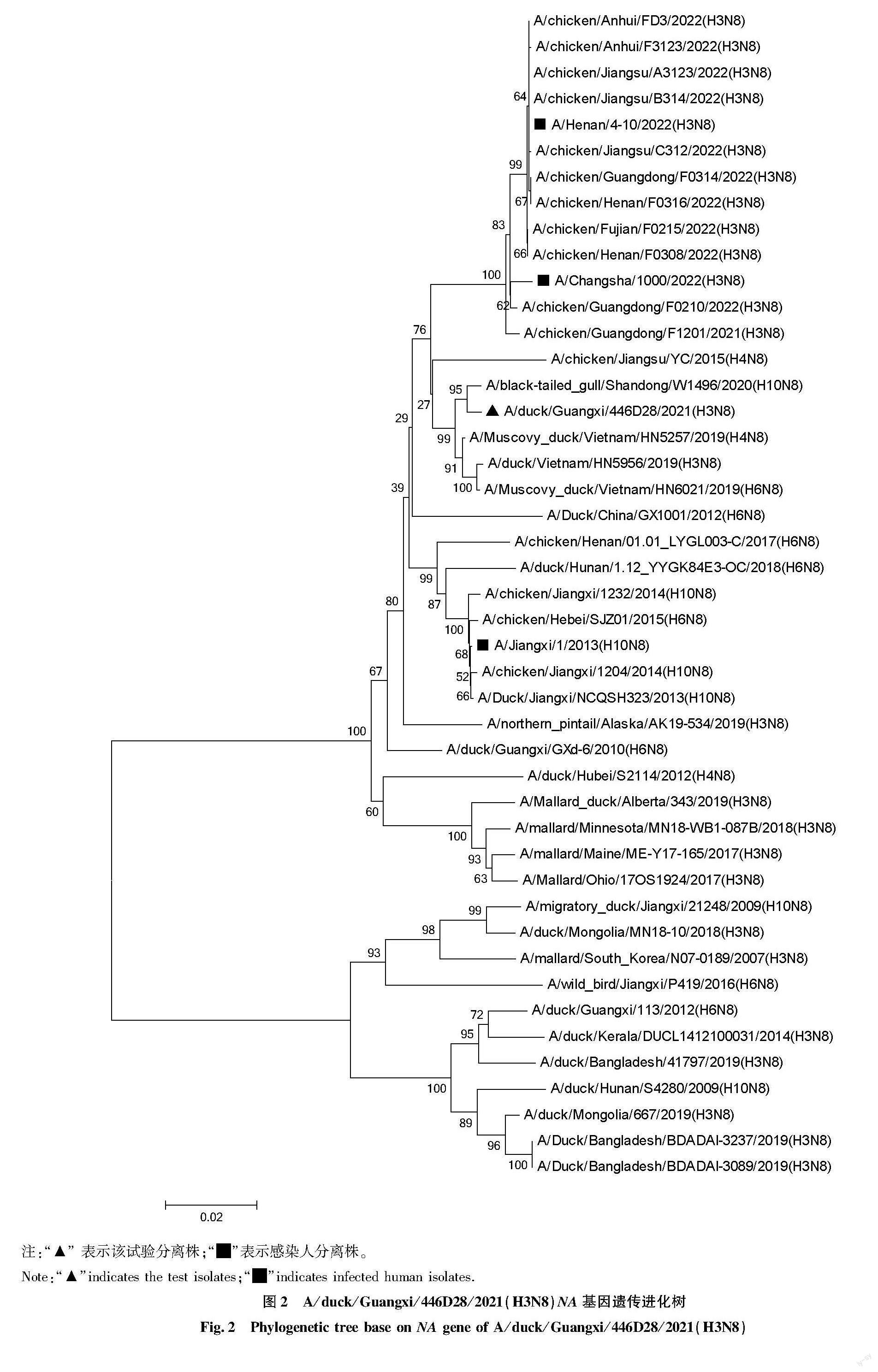
各个基因经过拼接形成全长基因序列,各个片段与GenBank中核苷酸同源性最高的病毒株进行BLAST分析,分析结果见表1。A/duck/Guangxi/446D28/2021(H3N8)HA基因比对分析结果表明,样品与越南鸭源分离株A/duck/Vietnam/HN5687/2019(H3N2)相似性最高,核苷酸同源性为97.30%。 序列分析的结果表明:其HA基因开放阅读框(ORF)全长为1 701 bp;HA1和HA2蛋白裂解位点没有出现3个以上连续性的碱性氨基酸(高致病性禽流感病毒的分子特征),符合低致病性AIV的分子特征。另外,HA受体结合位点未发生可感染人的Q226L突变。HA基因遗传进化分析结果显示,该毒株与感染人及对鸡有致病性鸡源H3亚型AIV毒株分别处于不同的分支,同时与北美分支H3亚型AIV毒株亲缘关系较远(图1)。NA基因的ORF全长为1 413 bp,与A/duck/Guangxi/446D28/2021(H3N8)的NA基因相似性最高的毒株是越南鸭源分离株A/Muscovy duck/Vietnam/HN5257/2019(H4N8)(98.63%)。NA基因遺传进化分析结果显示,该毒株与2022年感染人及流行的对鸡有致病性的鸡源N8亚型毒株分别处于不同的分支(图2)。PB2基因的ORF全长为2 280 bp,与 A/duck/Guangxi/446D28/2021(H3N8)的PB2基因核苷酸相似性最高的毒株为越南分离株 A/duck/Vietnam/HN6479/2020(H3N2)(99.06%)。PB1基因的ORF全长为2 274 bp,与该基因核苷酸相似性最高的毒株是越南分离株A/Muscovy duck/Vietnam/HN5901/2019(H4N6)(98.93%)。PA基因编码区全长为2 151 bp,同源性最高的毒株为A/duck/Vietnam/HN6105/2020(H4N2),相似性为98.56%。NP基因编码区全长为1 497 bp,与其相似性最高的毒株是A/duck/Vietnam/HN6038/2019(H11N2),核苷酸同源性为 99.11%。M基因编码区全长982 bp,与该基因相似性最高的毒株为A/spot-billed duck/Ningxia/YG83/2017(H5N6),核苷酸同源性为99.71%。NS基因编码区全长838 bp,与该基因相似性最高的毒株为A/chicken/Ganzhou/GZ43/2016(H3N2),核苷酸同源性为97.64%。
2.4 NA基因耐药性位点分析结果
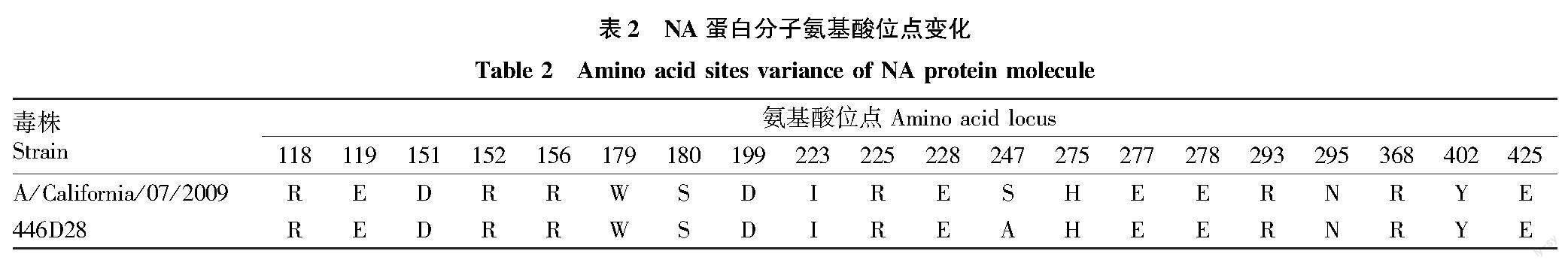
通过与参考株A/California/07/2009进行分析发现(按NI编码序号),446D28株NA基因的酶活性中心的第118R、119E、151D、152R、156R、179W、180S、199D、223I、225R、228E、275H、277E、278E、293R、295N、368R、402Y和425E位点均保守,未出现氨基酸位点替换;仅在S247A位点出现了氨基酸位点的替换(表2)。该位点的替换可能会影响酶的活性,但是否会对NAI类药物产生耐药性需要进一步研究证实。
2.5 受体亲和性的测定结果
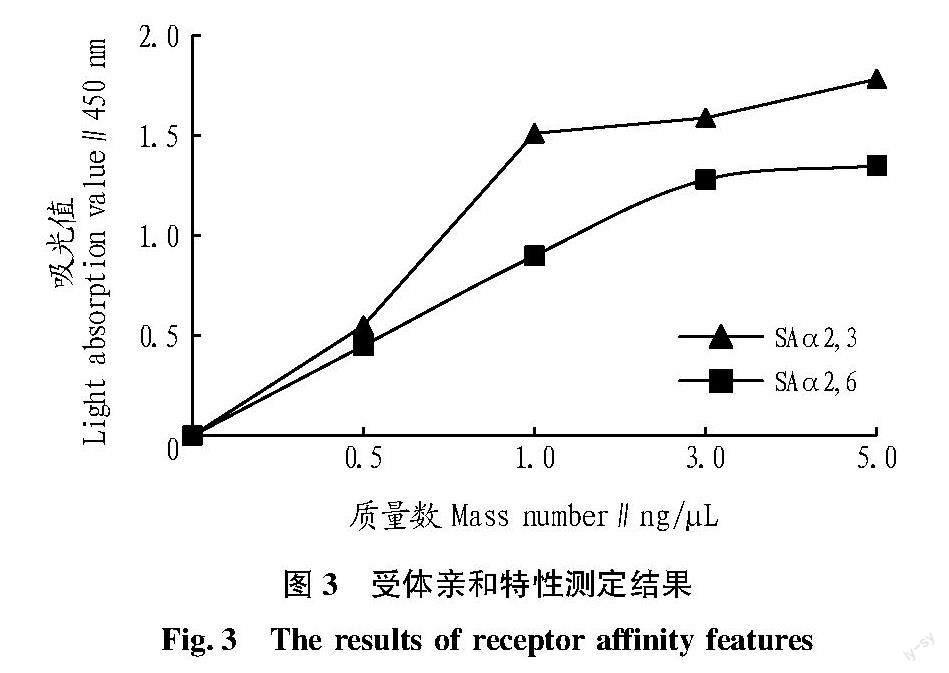
根据AIV结合不同唾液酸受体能力的差异,采用酶联免疫吸附试验按照说明对纯化后的H3N8亚型AIV 446D28毒株进行了唾液酸受体结合特异性的测定。测定结果表明,分离毒株446D28优先选择与SAα2,3受体结合,同时也具有与SAα2,6受体结合的特性,但与α-2,3唾液酸受体结合能力稍强(图3),表明该H3N8亚型AIV分离株具备结合感染人受体的特性,存在跨种属屏障感染哺乳动物和人的潜在风险。
3 讨论
流感病毒的多样性及其跨越种属障碍的能力一直令人担忧,需要对人类和动物流感病毒进行持续监测。H3N8亚型AIV经常在动物中检测到,也是野生鸟类中最常见的亚型之一[19]。曾有H3N8亚型AIV在多种哺乳动物宿主中跨越种属传播的报道,包括H3N8亚型AIV分别在马和犬中暴发的疫情[20-21]。在人类中,直到2022年5月我国2个省份分别报道了1例人感染H3N8亚型AIV的病例。虽然没有资料表明这种病毒有能力持续在人体内传播,但需要进行更多的流行病学和病毒学研究,以便更好地评估该病毒在人体细胞中的复制能力以及对公共卫生构成的风险。虽然当前H3N8亚型AIV为零星散发,鉴于H3亚型禽流感病毒曾引起1968年香港流感大流行,因此需要高度重视H3N8亚型禽流感病毒的公共卫生威胁。
该研究中,A/duck/Guangxi/446D28/2021(H3N8)的8个基因片段中HA、NA、PB1、PB2、PA和NP均与来自越南的鸭源分离株同源性最高,M和NS基因则分别与位于候鸟迁徙路线上的宁夏和江西分离株同源性最高。由此可见,分离的鸭源H3N8亚型AIV毒株就是由不同亚型毒株经过一系列基因重排产生的重组毒株。携带有不同亚型流感病毒的候鸟经长距离迁徙到达广西越冬或停息,然后在来年从热带地区经过广西向北,在此期间候鸟可以通过不同方式将病毒释放到周围环境中,同时广西多数水禽养殖户为开放式养殖,普遍的活禽交易习惯以及与流感疫情复杂的越南频繁边境贸易往来,这都为AIV在野生鸟类及家禽中的混合感染和传播创造了条件[22]。混合感染不同亚型AIV在禽类体内增殖过程中很容易形成“新的亚型毒株”。NAI类药物是治疗人感染禽流感的首选药物,但近年来有不少关于流感病毒对NAI类药物耐药的报道[23-24]。对分离株耐药性研究发现,NA蛋白中出现S247A位点氨基酸替换,该改变可能会降低病毒对NAI类药物的敏感性,尤其是奥司他韦[25]。及时发现AIV流行毒株中耐药毒株的出现,可为抗AIV新药开发奠定理论基础。
研究发现,H3N8亚型AIV在国内水禽和野鸟中不断被分离到[26-30]。直到2021年12月首先在广东省某三黄鸡群发现由H3和H9N2亚型AIV内部基因重排组成的对鸡致病的新型H3N8亚型AIV。新型AIV随后陆续在福建、安徽、江苏和河南等多个省份鸡群中被发现。感染人的新型H3N8亚型AIV出现后,通过对河南和湖南2省家禽相关从业人员
的血清学监测显示,感染人的新型H3N8病毒尚不具备持续人际间传播能力。迁徙候鸟携带流感病毒与家禽流感病毒之间的基因重排成为产生新型流感病毒的重要方式。2013年以来新出现的H7N9、H10N8、H10N3、部分H5N6及H3N8等一系列可感染人的新型禽流感病毒均含有H9N2病毒内部基因,表明H9N2病毒是通过提供内部基因产生新型流感病毒的“母病毒”[31]。该研究分离的鸭源H3N8亚型AIV虽然其内部未含H9N2病毒内部基因,但是其经历了鸭源H3亚型AIV与迁徙候鸟携带的其他亚型流感病毒的基因重排,产生了新的变异株。因此,改变目前广西家禽散养的养殖方式以及减少活禽交易是防控新型H3N8亚型AIV的重要措施。
参考文獻
[1]谭伟,徐倩,谢芝勋.禽流感病毒研究概述[J].基因组学与应用生物学,2014,33(1):194-199.
[2]SWAYNE D E.禽病学[M].刘胜旺,李慧昕,陈化兰,译.14版.沈阳:辽宁科学技术出版社,2022:220-266.
[3]WU Y,WU Y,TEFSEN B,et al.Bat-derived influenza-like viruses H17N10 and H18N11[J].Trends microbiol,2014,22(4):183-191.
[4]谭伟,谢芝勋.蝙蝠甲型流感病毒H17N10新亚型的研究进展[J].病毒学报,2015,31(1):80-84.
[5]程慧敏,刘立新.H3N2与H3N8亚型犬流感病毒研究进展[J].畜牧与兽医,2020,52(4):148-152.
[6]王秀荣,陈化兰.流感病毒对人类和畜牧业健康的影响[J].中国农业科学,2015,48(15):3038-3039.
[7]关立峥.2009~2013年我国H3亚型禽流感病毒部分生物学特性的研究[D].哈尔滨:东北农业大学,2014.
[8]刘婷婷.广西H3亚型禽流感病毒生态进化及检测技术的研究[D].桂林:广西师范大学,2015.
[9]张云,刘明,于康震,等.宠物鸟H3N8亚型流行性感冒病毒NA基因分子特征性分析[J].病毒学报,2005,21(2):145-149.
[10]欧淑丹.H3N8亚型马流感病毒样颗粒的构建及马Tetherin多样性的研究[D].广州:华南农业大学,2016.
[11]ANTHONY S J,ST LEGER J A,PUGLIARES K,et al.Emergence of fatal avian influenza in New England harbor seals[J].mBio,2012,3(4):1-84.
[12]孫洪磊,佟琪,李涵,等.新型H3N8亚型禽流感病毒分离鉴定与鸡致病性研究[J].中国农业大学学报,2022,27(8):131-139.
[13]YANG R G,SUN H L,GAO F,et al.Human infection of avian influenza A H3N8 virus and the viral origins:A descriptive study[J].Lancet Microbe,2022,3(11):e824-e834.
[14]CHENG D L,DONG Y L,WEN S F,et al.A child with acute respiratory distress syndrome caused by avian influenza H3N8 virus[J].J Infect,2022,85(2):174-211.
[15]TAN X,YAN X T,LIU Y,et al.A case of human infection by H3N8 influenza virus[J].Emerg Microbes Infect,2022,11(1):2214-2217.
[16]PENG Y,XIE Z X,LIU J B,et al.Epidemiological surveillance of low pathogenic avian influenza virus (LPAIV)from poultry in Guangxi Province,Southern China[J].PLoS One,2013,8(10):1-7.
[17]LUO S S,XIE Z X,LI M,et al.Survey of low pathogenic avian influenza viruses in live poultry markets in Guangxi Province,Southern China,2016-2019[J].Sci Rep,2021,11(1):1-10.
[18]HOFFMANN E,STECH J,GUAN Y,et al.Universal primer set for the full-length amplification of all influenza A viruses [J].Arch Virol,2001,146(12):2275-2289.
[19]崔鹏飞.2009—2013年中国H3N8亚型禽流感病毒生物学特性研究[D].兰州:甘肃农业大学,2016.
[20]刘春国,王伟,刘飞,等.H3N8亚型马流感病毒VLPs的构建及其生物学特性分析[J].中国兽医科学,2014,44(3):240-244.
[21]宋晶伟,王晨曦,张谞霄,等.北美H3N8亚型犬流感病毒双重RT-PCR检测方法的建立[J].中国兽医杂志,2017,53(8):26-28,31.
[22]李孟,谢芝勋,李丹,等.一株广西鸡源H6亚型禽流感病毒全基因组序列分析及其重要生物学特性[J].安徽农业科学,2020,48(23):125-128,142.
[23]颜健华,何奇松,熊毅,等.广西H3N8亚型马流感病毒耐药性分析[J].南方农业学报,2015,46(6):1127-1131.
[24]杨可妍.广西A型流感病毒的耐药性研究[D].南宁:广西大学,2015.
[25]HURT A C,LEE R T,LEANG S K,et al.Increased detection in Australia and Singapore of a novel influenza A(H1N1)2009 variant with reduced oseltamivir and zanamivir sensitivity due to a S247N neuraminidase mutation[J].Eurosurveillance,2011,16(23):1-6.
[26]王聪,费荣梅.野鸭源H3N8亚型禽流感病毒的系统进化和分子遗传特征分析[J].中国兽医科学,2016,46(12):1489-1496.
[27]崔鹏飞,彭志,张芳,等.四株鸭源H3N8亚型禽流感病毒对SPF鸡的感染性分析[J].畜牧兽医学报,2016,47(6):1209-1214.
[28]兰玲,王涛,王晶,等.一株野鸟源H3N8亚型流感病毒分离株的全基因组序列分析[J].中国动物检疫,2016,33(4):77-79,93.
[29]谭丹,关立铮,王晶,等.3株H3N8亚型禽流感病毒对SPF鸡和Balb/c小鼠致病性研究[J].动物医学进展,2014,35(4):77-80.
[30]郭亮,柴洪亮,张兰兰,等.野鸭源H3N8亚型禽流感病毒NS基因的分子克隆及序列分析[J].东北林业大学学报,2009,37(7):115-118.
[31]LI P D,NIU M H,LI Y T,et al.Human infection with H3N8 avian influenza virus:A novel H9N2-original reassortment virus [J].J Infect,2022,85(6):e187-e189.
