葡萄风信子MaMYB114 基因克隆及功能研究
2024-01-13史程程焦清正刘艺平刘红利
史程程,陈 鹏,焦清正,刘艺平,刘红利
(河南农业大学 风景园林与艺术学院,郑州 450000)
花色是观赏植物的重要性状之一,影响着园林植物的观赏价值和经济价值,而类黄酮物质中花青素苷(anthocyanin)是影响大多数观赏植物呈色的主要原因之一[1]。近年来社会各界采用各种方法改变花色达到创造新奇色彩、扩充稀缺花色资源的目的,其中最有效的是基于花青素苷呈色机理分子育种手段[2-4]。花青素是一种多酚类水溶性色素,广泛存在于不同植物的各个植物组织中,从而使其呈现出红、蓝、紫等不同颜色[5-7]。植物形成丰富色彩表型的原因是多样的,植物体内花青素代谢途径不同、花青素的含量不同以及环境影响等因素共同作用使植物展现不同的颜色[8-9]。
目前花青素生物合成途径已清晰明了,其合成过程主要受两类基因的调控:一类是编码花青素生物合成各种酶的结构基因,一类是起转录调控作用的调节基因,其主要通过MYB-bHLH-WD40(MBW)三元复合物的形式发挥作用[10-12]。
MYB转录因子在植物生长发育过程中广泛参与植物色素合成、细胞分化与发育、信号转导以及抗病抗逆等次生代谢过程[13-17]。MYB 转录因子在N端含有高度保守的DNA 结合域,即MYB 结构域,每个结构域含有50~53 个氨基酸残基,根据含有MYB结构域的数量可将其分为4个亚家族,分别是1R(R1/2/3-MYB)、2R(R2R3-MYB)、3R(R1R2R3-MYB)和4R(含有4个R1/R2重复基序)[18-19]。其中R2R3-MYB在植物中的研究最为广泛,发挥着各种各样的功能,尤其是在调控花青素生物合成方面表现出较高的特异性,其活性通常决定了特定细胞花青素的含量、花色强度和模式[20-21]。它们能够与结构基因启动子结合,从而促进或抑制结构基因表达,发挥调控花青素生物合成的功能。如苹果(Malus×domestica)中MdMYB306-like直接抑制结构基因MdDFR的表达,负调控苹果表皮花青素的合成[22];菊花(Chrysanthemummorifolium)CmMYB21在植物褪色过程中表达水平增高,抑制CmDFR启动子活性,是调控花青苷代谢的转录抑制因子[23];水仙(Narcissustazetta)中NtMYB12直接与NtFLS、Nt-LAR、NtDFR启动子结合,激活NtFLS和NtLAR表达,抑制NtDFR表达,导致中国水仙(原)花青素含量低,类黄酮含量高[24];牡丹(Paeoniasuffruticosa)PsMYB30激活PsANS的表达[25],PsMYB12通过调节PsCHS表达[26],都能促进花瓣色斑形成。因此,研究观赏植物花青素生物合成相关的R2R3-MYB基因对实现花色定向改良十分重要。
葡萄风信子(Muscariarmeniacum)是从欧洲引进的多年生单子叶球根花卉,花序似成串的葡萄,花姿秀丽,具有较高的观赏价值。因其罕有的蓝色花色及简单的花色遗传背景深受大众和科研工作者的青睐,是研究蓝色花形成机制的理想植物材料[27-29]。本研究以葡萄风信子亚美尼亚(M.armeniacum)为试验材料,基于课题组前期获得的葡萄风信子M.armeniacum转录组数据库,利用RT-PCR 法克隆获得1条R2R3-MYB 序列,命名为MaMYB114。对基因序列进行生物信息学分析、亚细胞定位、转录自激活活性分析、时空表达模式分析及异源过表达烟草,以明确该基因的功能,为分子育种定向改良花色提供基因资源,进一步为探究葡萄风信子蓝色花色形成机理提供理论依据。
1 材料和方法
1.1 试验材料
葡萄风信子‘亚美尼亚’(M.armeniacum)植株栽植于河南农业大学第三试验田。花发育阶段定义如下:S1(Stage1),未着色的花蕾;S2(Stage2),开始着色的花蕾;S3(Stage3),完全着色但未开放的花蕾;S4(Stage4),花完全着色且完全开放;S5(Stage5),衰败但未萎蔫的花。根据葡萄风信子生长时期采集植株的根、鳞茎、叶片及5个发育时期的花(图1),样品用液氮冷冻后存放于-80 ℃冰箱用于后续的试验分析。

图1 葡萄风信子全株、花序及5个花发育时期的花S1-S5,Stage1-5;Bar,1 cm.Fig.1 Total plant,inflorescence and tepals at five developmental stages of M.armeniacum
本氏烟草(Nicotianabenthamiana)种子保存于实验室。种子播种在基质中,在光照培养箱中培养,光周期为14 h/10 h 昼/夜,待植株长至4~6片真叶后用于下一步试验。烟草(N.tabacum‘SR’)种子经消毒后播种于MS培养基上,放置在培养室,光照周期为昼夜14 h/10 h,温度25 ℃。植株生长至4~6片叶时用于遗传转化实验。
1.2 总RNA提取和cDNA合成
将葡萄风信子(M.armeniacum)的根、鳞茎和叶片及5 个时期的花经液氮研磨后,根据Omega Plant RNA kit(美国Omega公司)试剂盒说明书方法提取各组织样品中的总RNA,RNA 质量经过1%的琼脂糖凝胶电泳检测。根据Primer Script Rt reagent Kit with gDNA Eraser(南京诺维赞生物科技有限公司)说明书方法获得相应组织的cDNA,-20 ℃保存。
1.3 MaMYB114 基因克隆
以葡萄风信子(M.armeniacum)花5 个时期的cDNA 等量混合物为模板,利用 Premier 5.0设计基因克隆引物(表1),引物及测序都由上海生物工程有限公司完成。按照KOD-Plus高保真酶(东洋纺生物科技有限公司,上海)说明书方法扩增,获得PCR 产物胶回收后连接pMD-18T 载体,转化大肠杆菌感受态(Top10),挑取单克隆菌斑在LB(Luria-Bertani)液体培养基、37 ℃摇床培养8 h,经菌液PCR 检测送阳性克隆测序。

表1 本研究中所用引物序列Table 1 Primer sequences in this study
1.4 生物信息学分析
利用ExPASy在线软件(https://web.expasy.org/protparam/)对目的基因编码蛋白的理化性质进行预测和分析;分别用SOPMA(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)和SWISS-MODEL(https://swiss-model.expasy.org/)进行蛋白二级结构和三级结构预测;通过Expasy Protscale(https://web.expasy.org/protscale/)进行亲疏水性分析;利用DANMAN9.0软件进行多重序列比对并分析其中的保守结构域。采用MEGA7.0 软件中邻近法(neighbor joining,NJ)构建系统进化树。利用PSORT (https://www.genscript.com/tools/psort),Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)和TargetP 2.0(https://services.healthtech.dtu.dk/service.php?TargetP-2.0)在线工具进行亚细胞定位预测。
1.5 实时荧光定量PCR(qRT-PCR)
实时定量PCR 以葡萄风信子‘亚美尼亚’(M.armeniacum)的根、鳞茎和叶片及5个时期花的cDNA为模板,反应体系和反应程序按AceQ® Universal SYBR qPCR Master Mix(南京诺维赞生物科技有限公司)说明书设置,使用2-ΔΔCT 法计算目的基因的相对表达量[30]。每个样本3 个生物学重复,MaActin作为葡萄风信子的内参基因[29],基因定量引物及内参基因引物见表1。
1.6 亚细胞定位
采用同源重组的方式将MaMYB114基因开封阅读框(open reading frame,ORF)(去除终止密码子)连接到植物表达载体pC2300 的2 个酶切位点KpnⅠ和SalⅠ之间,获得融合GFP的植物表达载体pC2300-MaMYB114-GFP(MaMYB114:GFP),所用引物见表1。参照卢瑶等的方法进行亚细胞定位观察[31]。
1.7 转录激活活性试验
采用同源重组的方法将MaMYB114基因的ORF序列构建到酵母表达载体pGBKT7的2个酶切位点NdeⅠ和BamHⅠ之间,获得酵母表达载体pGBKT7/MaMYB114,所用引物见表1。参照Li等的方法[32]进行酵母转化和阳性菌株的筛选。转化的质粒分别为目的质粒(pGBKT7/MaMYB114)、阳性对照(pGBKT7-53+pGBKT7-T)以及阴性对照(pGBKT7-blam+pGBKT7-T)。观察转化菌斑在SD/-Trp/-Leu、含40 mg/mL X-a-gal的SD/-Trp/-Leu 培养基以及含40 mg/mL X-a-gal 的SD/-Trp/-Leu/-His/-Ade培养基上的生长情况。
1.8 烟草遗传转化
将植物过表达载体pC2300-MaMYB114-GFP和pC2300-GFP 利用叶盘法[27]转化烟草(Nicotianatabacum‘SR’)。将筛选得到的不定芽切下放置于生根培养基上生长,待根生长至2 cm 左右时,对组培苗进行炼苗,然后移至无菌基质中,在温室中进行培养。收集阳性苗种子,使用T1代株系进行基因功能分析。
1.9 花青苷的提取和含量测定
植物材料称量后经液氮充分研磨,用花青苷提取液浸提。花青苷提取液为1%的盐酸甲醇溶液[33]。在4 ℃冰箱中避光静置,每6 h振荡混匀1次,24 h后取上清液,使用酶标仪测量在530 nm 和657 nm 处的吸光度。花青苷含量计算公式:QAnthocyanins=(A530-0.25×A657)×mDW。葡萄风信子所有样品总花青苷的相对含量分别采用单位干重表示。每个试验3个生物学重复。
2 结果与分析
2.1 基因克隆及生物学信息学分析
2.1.1 MaMYB114 基因克隆
通过PCR扩增,从葡萄风信子花瓣中克隆获得到1条714 bp左右的的基因序列(图2),ORF编码237个氨基酸(图3),命名为MaMYB114,将得到的MaMYB114序列提交到GenBank,登录号为OQ615377。

图2 葡萄风信子MaMYB114 基因PCR扩增琼脂糖凝胶电泳M.DL2000 DNA marker;A.The amplification of full-length cDNA of MaMYB114.Fig.2 Agarose gel electrophoresis of PCR amplified products of MaMYB114 from M.armeniacum

图3 葡萄风信子MaMYB114 基因序列全长及其推导氨基酸序列The amino acid sequences marked by black underlinei ndicated the conserved MYB domain (i.e.R2R3 repeats).Fig.3 The full length of cDNA and deduced amino acid sequences of MaMYB114 from M.armeniacum
2.1.2理化性质分析与结构预测
葡萄风信子MaMYB114由237个氨基酸残基组成,在组成该蛋白的氨基酸中,甘氨酸(Leu)所占比例最高,为9.7%,而半胱氨酸(Cys)、甲硫氨酸(Met)、苏氨酸(Thr)所占比例最低,为1.3%。负电荷残基(Asp+Glu)33 个,正电荷残基(Arg+Lys)37个。
MaMYB114的分子式为C1192H1869N353O349S6,理论等电点(pI)为8.87,不稳定指数为41.86,这表明该蛋白为不稳定蛋白。Expasy Protscale显示蛋白总亲水性平均系数(GRAVY)为-0.775,这说明该蛋白是亲水性蛋白(图4)。通过在线软件对MaMYB114蛋白的二、三级结构进行预测,结果(图5)表 明,MaMYB114 蛋白由38.40%的α-螺旋、11.39%的延伸链和50.21%的无规卷曲构成,而三级结构较为简单。

图4 MaMYB114蛋白亲水/疏水性预测分析Fig.4 Prediction of hydrophilic/hydrophobicity for MaMYB114 protein
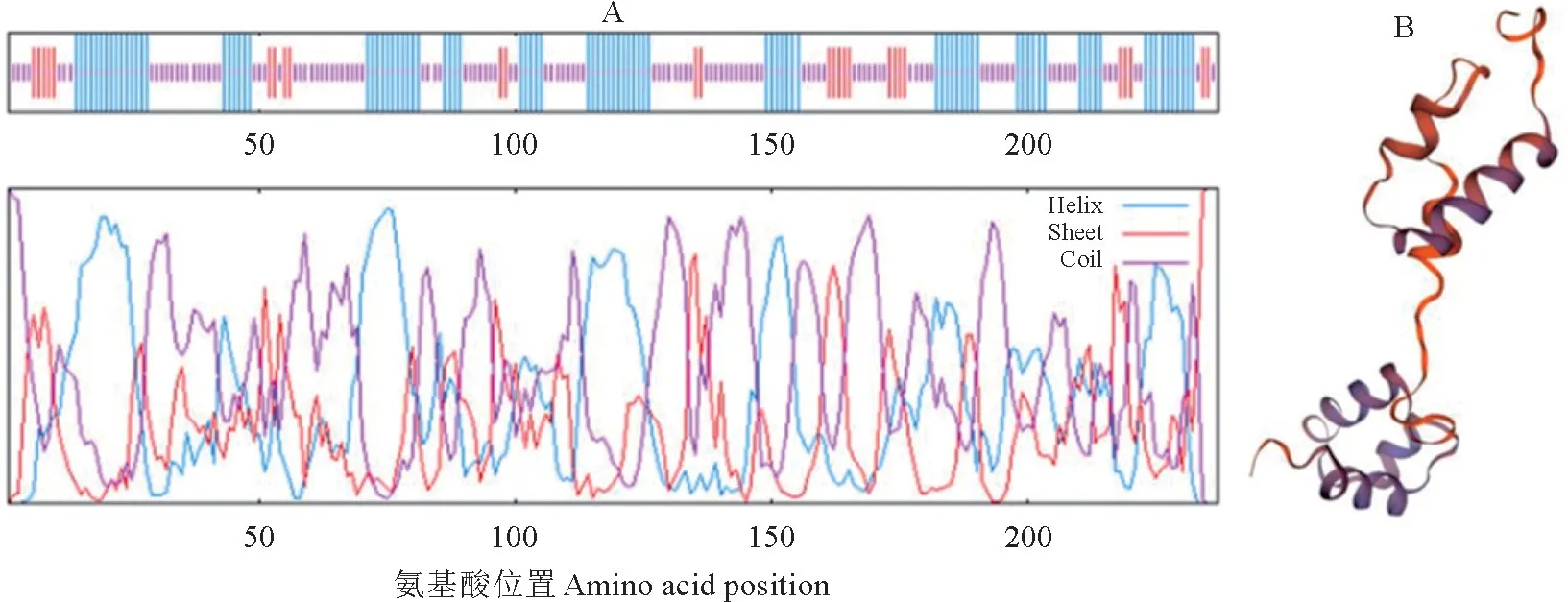
图5 MaMYB114蛋白二、三级结构预测A.Secondary structure,Blue.Alpha helix,Purple.Random coil.Red.Extended strand;B.Tertiary structure.Fig.5 Secondary and tertiary structure prediction of the MaMYB114 protein
2.1.3MaMYB114序列比对及聚类分析
从NCBI数据库下载拟南芥、矮牵牛和金鱼草等花青素生物合成相关的R2R3-MYB氨基酸序列,使用DANMAN9.0 软件将MaMYB114 与其进行多重序列比对。
结果(图6)显示,葡萄风信子MaMYB114蛋白在N 端高度保守,与其他物种R2R3-MYB 同源蛋白一样含有R2和R3 结构域,而在C 端的同源性低,属于R2R3-MYB家族的转录因子。MaMYB114的N 端保守结构域内存在3个双子叶植物花青苷相关R2R3-MYB的保守氨基酸,在图6中用黑色实心圆点标注;在R3结构域中含有与bHLH 蛋白互作的保守基序([D/E]LX2[R/K]X3LX6X3R),在图中用黑色矩形标注。系统进化树(图7)显示,MaMYB114与洋葱AcMYB1的同源性最高,与矮牵牛PhPAP1、拟南芥AtPAP1、PAP2 以及烟草NtAN2等参与花青苷合成调控的R2R3-MYB共同聚为AN2亚组。

图6 葡萄风信子MaMYB114与其他物种R2R3-MYB蛋白序列比对分析The black box,bHLH interacting motif;Black solid dot,conserved amino acids [arginine (R),valine (V),alanine (A)].Fig.6 Sequence alignment analysis of MaMYB114 (M.armeniacum) with R2R3-MYB proteins from other species

图7 葡萄风信子MaMYB114与其他参与花青苷合成相关R2R3-MYB的系统进化分析Fig.7 Phylogenetic analysis of MaMYB114 from M.armeniacum with other R2R3-MYBs involved in the anthocyanin biosynthesis
2.1.4亚细胞定位
网页预测MaMYB114蛋白在细胞中定位于细胞核,为验证预测结果,在本氏烟草中瞬时过表达pC2300-MaMYB114-GFP,以pC2300-GFP 为对照使用激光共聚焦显微镜观察蛋白亚细胞定位情况。结果(图8)表明,对照pC2300-GFP在整个细胞中表达,而融合蛋白MaMYB114-GFP于本氏烟草叶片的细胞核中发出绿色荧光,与DAPI(标示细胞核)的蓝色荧光重合,表明MaMYB114蛋白定位于细胞核。

图8 MaMYB114蛋白亚细胞定位Fig.8 Subcellular localization of MaMYB114
2.1.5MaMYB114转录激活活性试验
在酵母中检验MaMYB114 的转录自激活活性。图9显示,pGBKT7/MaMYB114和pGBKT7-53/pGBKT7-53(阳性对照)能在添加40 mg/mL Xa-gal 的SD/-Trp/-Leu培养基以及含40mg/mL Xa-gal的SD/-Trp/-Leu/-His/-Ade培养基上生长,菌斑呈现蓝色,而pGBKT7-blam/pGBKT7-T(阴性对照)在SD/-Trp/-Leu/X-a-gal培养基上生长但不变蓝,在SD/-Trp/-Leu/-His/-Ade/X-a-gal上不生长,这些结果说明MaMYB114具有转录激活活性。

图9 葡萄风信子MaMYB114转录激活活性分析Positive control.pGBKT7-53 plus pGADT7-T;Negative control.pGBKT7-blam plus pGADT7-T.Fig.9 The transcription activation ability of MaMYB114 from M.armeniacum
2.1.6葡萄风信子总花青苷相对含量测定和MaMYB114转录表达分析
为了探究MaMYB114转录表达与花青苷积累的关系,检测了葡萄风信子根、鳞茎、叶、花中的总花青苷含量(图10,A)及MaMYB114的表达水平(图10,B)。结果表明,花青苷主要在葡萄风信子的花中积累,在5个花发育时期总花青苷含量呈现出先增高后降低的趋势,在未着色的S1时期花青苷的积累极少,随着花发育进程,花青素从开始着色的S2时期开始增加,在完全着色的S3和S4时期高表达,在开始衰败的 S5 时期降低(图10,A)。MaMYB114在葡萄风信子花的5个发育时期的基因表达水平显著高于根、鳞茎和叶片,表达水平具有组织特异性。MaMYB114基因表达水平在花5个发育时期的表达量总体上呈现出先增高后降低的趋势,在S1时期低表达,随着花开始着色,花青苷含量增加,在S2时期快速升高,特别是在S3时期达到最大值,S4和S5时期降低(图10,B),与花青苷积累的趋势相似,呈现极显著的正相关(Pearson相关系数,r=0.793)。

图10 葡萄风信子不同组织器官中总花青素相对含量及MaMYB114 转录表达分析A.The total anthocyanins content of roots,bulbs,and flowers at the five flower developmental stages (S1-S5);B.The expression profiles of MaMYB114 in roots,bulbs,leaves,and five flowers developmental stages of M.armeniacum.MaActin was the reference gene.Each column represents the means±SD from three technical replicates.Fig.10 The total anthocyanins content in roots,bulbs,and flowers of M.armeniacum and the expression profiles of MaMYB114 in these tissues
2.2 MaMYB114在烟草中异源过表达
为了进一步确定葡萄风信子花色相关R2R3-MYB转录因子基因MaMYB114在花青苷合成中的作用,我们将植物过表达载体pC2300-MaMYB114-GFP和空载体pC2300-GFP通过农杆菌介导法转化烟草‘SR’叶盘,以转化空载体(CT)为对照。过量表达MaMYB114(OE-MaMYB14)使烟草(图11)的营养器官和生殖器官积累大量花青苷。过表达MaMYB114的烟草叶片相比转化空载体烟草叶片颜色加深(图11,D);对照组烟草(CT)花冠颜色为粉色,而OE-MaMYB14烟草花冠及花冠筒变为深紫红色(图11,C);此外,种皮、花萼、花药和花丝也呈现出强烈的深紫红色(图11,A,B)。这些结果证明,MaMYB114具有正调控花青苷的功能。

图11 过表达MaMYB114 和空载体基因的烟草表型分析OE-MaMYB114,MaMYB114 overexpress tobacco lines;CT.Transgenic tobacco lines transformed with the empty vector (control).A.Seed;B.Sepal,anther,filament,ovary;C.Petal;D.Whole plant.Fig.11 Tobacco phenotypic analysis of overexpressing MaMYB114 and empty vector genes
3 讨论
MYB转录因子是植物中的转录因子家族之一,其中R2R3-MYB转录因子广泛参与多种植物响应生物及非生物胁迫、生长发育及花青苷合成调控等过程,它们通常在其N 端都具有1个高度保守的DNA 结合区域(即R2R3 repeats),而在其C 端具有1个可变区域[14]。本研究从单子叶植物葡萄风信子的花中克隆获得1个花色相关的R2R3-MYB转录因子基因MaMYB114,它编码的氨基酸序列中含有2个SANT 结构,属于典型的R2R3-MYB。在马铃薯(Solanumtuberosum)中,MYB 转录因子StAN1含有bHLH 互作区,在烟草叶片中瞬时共表达StbHLH1和StAN1时,能够使烟草叶片积累花青素[34];同理,苹果(Malus×domestica)MdbHLH3和MdbHLH3与MdMYB10相互作用参与花青素生物合成的调节[35]。MaMYB114在R3结构域中存在与bHLH 蛋白互作的结合位点,推测其能通过与bHLH形成复合物参与花青苷合成调控。
根据序列同源性可将与花青素合成相关的R2R3-MYB分为AN2亚组和C1亚组,分别对应拟南芥R2R3-MYB的25个亚组中的第6亚组和第5亚组[36]。参与单子叶植物花青苷调控的主要聚为C1亚组,而参与双子叶植物花青苷调控的以AN2亚组为主。也存在属于AN2亚组的调控单子叶植物花青苷的R2R3-MYB,如百合LhMYB6[37],小苍兰FhPAP1[38]以及葡萄风信子MaAN2和MaMybA[27]。基于序列分析和聚类分析结果,初步推测MaMYB114具有调控花青苷合成的能力。
亚细胞定位(图8)及转录激活活性(图9)分析结果表明MaMYB114定位于细胞核且具有转录自激活活性,符合转录因子一般特征。MaMYB114在葡萄风信子的花中优势表达,具组织特异性,且随着花发育进程呈现出先增高后降低的趋势,在S3时期达到极值,在S4时期降低,与花青苷积累的趋势相似,呈现极显著的正相关(Pearson 关系数r=0.793)。这进一步表明在葡萄风信子花发育过程中,MaMYB114可能参与花青苷的合成调控,且在花发育的早期(S2-S3时期)起主要调控作用。
在模式植物中异源过表达目的基因能为基因功能鉴定提供依据,荔枝LcMYB1[38]、杨梅MrMYB1[39]、小苍兰FhMYB5[40]以及百合LhMYB12-Lat[41]在烟草中过表达都能够使花青苷在烟草花瓣、萼片、花丝等部位大量积累从而发生颜色变化。本研究中,在烟草‘SR’中过表达MaMYB114使烟草叶片、花冠、花冠筒、花药、花丝、花萼和种皮均呈现出深紫红色(图11),进一步证明MaMYB114促进花青素的积累。
综上所述,葡萄风信子MaMYB114基因属于调控花青苷合成相关的R2R3-MYB 亚家族中的AN2亚组。在烟草中异源过表达MaMYB114的结果证实其确实具有促进花青苷积累的功能,但具体调控机制需要进一步验证。
