长林小蠹肠道可培养细菌群落的组成和结构1)
2024-01-13王美惠陈焕文解丹项嘉建宇佳迟德富
王美惠 陈焕文 解丹 项嘉建 宇佳 迟德富
(东北林业大学,哈尔滨,150040)
长林小蠹(HylurgusligniperdaFabricius),又名红毛小蠹,隶属于鞘翅目(Coleoptera)象鼻虫科(Curculionidae)林小蠹属(HylurgusLatreille),原产于欧洲南部及非洲北部的地中海沿岸[1],主要以松属(Pinus)植物为食。长林小蠹成虫体长4.0~5.7 mm,入侵能力强[2],很容易通过松树木材的贸易活动进行传播,是全球各国在松树进口木材中截获最多的昆虫之一。近百年来,已先后入侵亚洲、大洋洲、南美洲、北美洲、非洲南部的多个国家[3],2019年在我国山东省泰安市首次诱集到长林小蠹,此后,在山东烟台市也发现了该种的入侵[4]。目前,长林小蠹在我国主要危害黑松(Pinusthunbergia),也可能危害华山松(Pinusarmandii)、赤松(Pinusdensiflora)、油松(Pinustabuliformis)等,长林小蠹已明确在我国定殖并对松属树木造成极其严重的危害[1]。
肠道微生物在与宿主长期进化的过程中,对宿主的生长发育、营养吸收、免疫调节、解毒代谢等多方面都产生了至关重要的作用;宿主昆虫则为肠道微生物提供食物以及生存环境,二者协同进化、互惠互利。此外,肠道微生物在绿色防治害虫方面也具有巨大潜力[5-6]。例如,通过基因改造等手段操纵昆虫肠道内的共生菌[7],或将优势菌株开发为害虫引诱剂等。因此,对于长林小蠹肠道可培养细菌种类的鉴定及种群组成的研究,将有助于探明长林小蠹对寄主的适应机制,为完善长林小蠹的防控体系以及生态控制技术的研发提供科学依据。近年来,对昆虫肠道微生物的研究日益深入,研究表明,昆虫肠道内存在多种多样的微生物,多数昆虫肠道的微生物中,细菌丰度最高,约占90%以上[8],是昆虫肠道微生物的优势菌群。在细菌分类中,昆虫肠道内大部分细菌属于变形菌门。在国外,对长林小蠹伴生真菌的研究居多[9-10],但到目前为止,对其耐受和降解植物防御物质相关的肠道细菌群落了解甚少;在国内,由于长林小蠹定殖中国不久,对该种肠道细菌的研究报道较少,但对于目前我国分布的其他小蠹虫肠道细菌的研究已有一些文献报道。娄哲巧[11]采用传统的微生物培养方法研究了红脂大小蠹(Dendroctonusvalens)成虫和幼虫肠道、蛹的体表及坑道蛀屑可培养细菌的多样性,共同分离得到59种细菌,其中变形菌门的沙雷氏菌属(Serratia)、欧文氏菌属(Erwinia)、假单胞菌属(Pseudomonas)和Rahnella属为优势均属。胡霞[12]采用变性梯度凝胶电泳(DGGE)及基因克隆转化的方法研究了华山松大小蠹(Dendroctonusarmandi)成虫、幼虫和蛹的肠道细菌多样性,发现10个细菌属,其中变形菌门的柠檬酸杆菌属(Citrobacter)、沙雷氏菌属(Serratia)和泛菌属(Pantoea)为优势均属。本研究以采集自山东省烟台市牟平区的长林小蠹为样本,通过传统培养结合形态学及16S rDNA测序对长林小蠹肠道优势可培养细菌进行了初步分离鉴定,为进一步探讨长林小蠹肠道微生物的功能及其生物防治方法奠定基础。
1 材料与方法
供试虫源:采集时间为2022年5月,从位于山东省烟台市牟平区的黑松林场内采集长林小蠹的成虫和幼虫,采集方法为寻找有长林小蠹钻蛀孔的黑松伐桩,将地面上方树干的树皮剥开,沿着坑道可以找到长林小蠹的成虫和幼虫,用镊子小心夹出并放入已打孔且放有从野外收集的黑松韧皮碎屑的塑料盒中带回实验基地。长林小蠹在实验基地内的饲养条件为恒温25 ℃,相对湿度70%,无光照。试验时选择大小一致、健康活跃的昆虫供试。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂粉15~20 g,无菌水1 000 mL,pH=7.0[13]。
NA培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15~25 g,无菌水1 000 mL,pH=7.4~7.6[13]。
厌氧菌琼脂培养基:厌氧菌琼脂(青岛高科技工业园海博生物技术有限公司)58.4 g,无菌水1 000 mL[14]。
1.1 长林小蠹肠道细菌的分离与培养
随机选取30头健康的长林小蠹成虫与30头发育程度相同的幼虫,饥饿处理24 h后,在无菌环境下进行解剖。用无菌水冲洗成虫和幼虫的体表,再用体积分数75%的酒精对虫体体表消毒2 min,最后用无菌水漂洗虫体30 s。在放有5 mL PBS缓冲液的灭菌培养皿中进行解剖,将解剖出的成虫和幼虫肠道分别放在含有1 mL PBS缓冲液的1.5 mL离心管中,用研磨棒彻底研磨至匀浆,用无菌水迅速稀释至研磨液体积分数为10-1~10-44个梯度。采用LB、NA和厌氧菌琼脂3种培养基进行细菌培养。将10-2、10-3、10-43个体积分数进行3种平板稀释涂布,每个梯度涂3个平板,每块平板涂20 μL的匀浆液,兼性厌氧菌的培养放于有厌氧产气袋的厌氧罐中[15],培养箱中25 ℃培养72 h后,挑选出菌落数在 30~300的培养基,用接种环挑取不同生长性状的单菌落进行纯化培养,每个平板至少纯化5次得到纯菌株,纯化后的菌株用液体培养基培养后,加入最终体积分数为30%的甘油于-80 ℃进行保存备用,试验重复3次。
1.2 长林小蠹肠道细菌的形态观察
将分离纯化后得到的细菌菌株采用平板划线法接种于新的LB平板上,在25 ℃下培养24~36 h,待菌落长成后,对菌落进行革兰氏染色[13],并观察菌株的形态,依据《常见细菌系统鉴定手册》的方法对其特征进行描述和鉴定[16]。
1.3 细菌菌株的DNA提取及PCR扩增
本研究采用冻融法提取各细菌基因组的DNA[17],具体操作如下:将纯化后的菌株接种于LB液体培养基中,25 ℃、150 r/min 振荡培养24 h后至菌液浑浊,兼性厌氧菌单菌落接种于厌氧菌肉汤培养基(山东拓普生物工程有限公司)后置于有厌氧产气袋的厌氧罐中,25 ℃静置培养24 h后至菌液浑浊。每个菌株分别取1 mL菌液于1.5 mL离心管中,12 000 r/min 离心1 min,弃上清液,重复上述操作两次,向离心管中加入500 μL的无菌双蒸水,液氮冷冻10 min后,置于水浴锅99 ℃ 20 min,取出后12 000 r/min离心2 min,以上清液作为模板。以细菌16S rDNA通用引物27 F(5’-AGAGTTTGATCCTGGCTC AG-3’)和1492 R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。
PCR反应体系25.0 μL:上、下游引物各1.0 μL、DNA模板1.0 μL、PCR Mix 12.5 μL、dd H2O 9.5 μL。扩增程序:94 ℃预变性5 min;94 ℃ 1 min, 56 ℃ 1 min,72 ℃ 2 min,进行30个循环;72 ℃延伸10 min。
取5.0 μL PCR产物用于1%琼脂糖凝胶进行电泳检测,检测后将PCR产物送至睿博兴科(东北)测序部进行测序。
1.4 肠道细菌的系统发育树构建
将测序结果与GenBank数据库中的序列进行BLAST同源性比对,一般认为序列的相似率>99%为同种, 95%~99%为同属, <95%为同科。选取并下载与菌株同源性最高的序列作为比对菌株的序列,与测序获得的细菌序列一起,运用MEGA11.0软件和国际通用的Neighbor-Joining构建系统发育进化树,用Bootstrap法计算1 000次进行检测,以此判定其分类学地位。
2 结果与分析
2.1 长林小蠹肠道可培养细菌的形态特征
从长林小蠹肠道中共分离获得20株形态、颜色和大小各异的细菌菌株。菌落形态多为圆形,仅有1株为不规则状;从颜色看,有白色、乳白色、浅白色、乳白偏黄、淡黄色;从细菌形态看,有2株为球状,18株为杆状;革兰氏染色结果表明,有3株菌呈阳性,17株菌呈阴性。详细培养性状见表1。

表1 长林小蠹肠道细菌的菌落形态及培养性状
2.2 长林小蠹肠道细菌的16S rDNA序列分析结果
长林小蠹肠道细菌菌株测序后与NCBI数据库比对,分离到的肠道细菌与相应菌株的16S rDNA序列相似度均在98%~100%。从表2看,这20株细菌隶属于2门4纲6目9科15属18种,初步鉴定得到:解蛋白芽孢杆菌(Bacillusproteolyticus)1株,乳酸乳球菌(Lactococcuslactis)1株,布鲁氏菌(Brucellapseudintermedia)1株,热带副伯克霍尔德菌(Paraburkholderiatropica)1株,洋葱伯克氏菌(Burkholderiastagnalis)1株,Pantoeacypripedii1株,成团泛菌(Pantoeaagglomerans)1株,野梧桐欧文氏菌(Erwiniamallotivora)1株,Erwiniaendophytica1株,黏质沙雷氏菌(Serratiamarcescens)1株,蛋白原假单胞菌(Pseudomonasprotegens)2株,罗克西拉席尔瓦菌(Rouxiellasylvae)1株,科萨克尼亚嗜米肠杆菌(Kosakoniaoryziphila)1株,产气克雷伯氏菌(Klebsiellaaerogenes)1株,催产克雷伯菌(Klebsiellaoxytoca)1株,土生拉乌尔菌(Raoultellaterrigena)1株,Raoultellaelectrica1株,赫尔曼亚特兰大杆菌(Atlantibacterhermannii)1株,耐冷哈夫尼菌(Hafniapsychrotoler)2株。
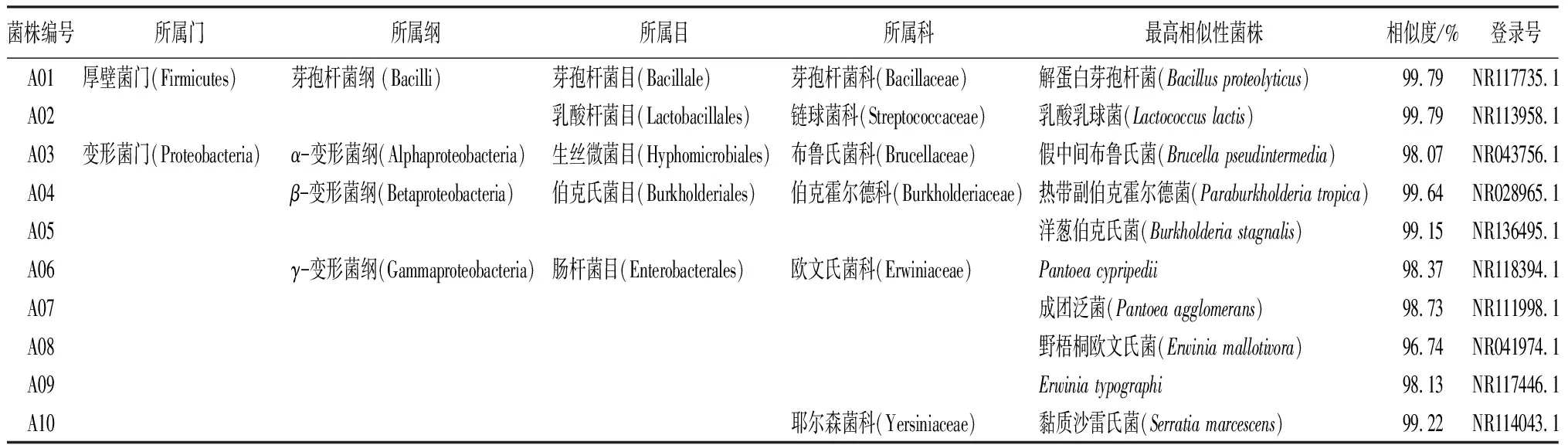
表2 长林小蠹肠道细菌的16S rDNA序列比对
2.3 系统发育树分析结果
图1显示,长林小蠹肠道可培养细菌的系统发育树分为2大枝18小枝,两大枝分别为厚壁菌门和变形菌门,其中厚壁菌门芽孢杆菌属的菌株A01与它的模式菌株Bacillusproteolyticus聚为一类,乳球菌属的菌株A02与它的模式菌株Lactococcuslactis聚为一类,这2小枝又聚在一起合成一大枝,表明这2种细菌的亲缘关系较近;变形菌门布鲁菌属的A03与它的模式菌株Brucellapseudintermedia单独聚为一类;变形菌门帕拉伯克霍尔德氏菌属的菌株A04与它的模式菌株Paraburkholderiatropica聚为一类,伯克霍尔德属的菌株A05与它的模式菌株Burkholderiastagnalis聚为一类,这2小枝又聚在一起合成一大枝,表明这两种细菌的亲缘关系较近;变形菌门假单胞菌属的A19和A20与它的模式菌株Pseudomonasprotegens单独聚为一类;欧文氏菌属的菌株A08与它的模式菌株Erwiniamallotivora聚为一类;泛菌属的菌株A06与它的模式菌株Pantoeacypripedii聚为一类,欧文氏菌属的菌株A09与它的模式菌株Erwiniatypographi聚为一类,这2小枝又聚在一起合成一大枝,表明这2种细菌的亲缘关系较近;Atlantibacter属的菌株A16与它的模式菌株Atlantibacterhermannii聚为一类;科萨克氏菌属的A12与它的模式菌株Kosakoniaoryziphila聚为一类,这2小枝又聚在一起合成一大枝,表明这2种细菌的亲缘关系较近;泛菌属的菌株A07与它的模式菌株Pantoeaagglomerans聚为一类;拉乌尔菌属的菌株A14与它的模式菌株Raoultellaterrigena聚为一类,菌株A15与它的模式菌株Raoultellaelectrica聚为一类,克雷伯氏菌属的菌株A13与它的模式菌株Klebsiellaoxytoca聚为一类,这3小枝又聚在一起合成一大枝,表明这3种细菌的亲缘关系较近;沙雷氏菌属的菌株A10与它的模式菌株Serratiamarcescens聚为一类,哈夫尼亚菌属的A17和A18与它的模式菌株Hafniapsychrotolerans聚为一类,Rouxiella属的菌株A11与它的模式菌株Rouxiellasilvae聚为类,这3小枝又聚在一起合成一大枝,表明这3种细菌的亲缘关系较近。

图1 16S rDNA 序列构建的长林小蠹肠道细菌系统发育树(邻接法)
2.4 长林小蠹成虫和幼虫肠道可培养细菌属种组成
从属的水平上看,长林小蠹成虫肠道中可培养的细菌有10个属,分别为芽孢杆菌属、乳球菌属、泛菌属、欧文氏菌属、沙雷氏菌属、Rouxiella属、科萨克氏菌属、克雷伯氏菌属、拉乌尔菌属、哈夫尼亚菌属。其中,沙雷氏菌属、Rouxiella属和科萨克氏菌属的细菌相对分离率为 32.3%、16.1%和13.9%,均是成虫肠道分离菌株中的优势菌属。幼虫肠道中可培养的细菌有15个属,分别为芽孢杆菌属、乳球菌属、布鲁菌属、帕拉伯克霍尔德氏菌属、伯克霍尔德氏菌属、泛菌属、欧文氏菌属、沙雷氏菌属、Rouxiella属、科萨克氏菌属、克雷伯氏菌属、拉乌尔菌属、Atlantibacter属、哈夫尼亚菌属、假单胞菌属。其中,欧文氏菌属、沙雷氏菌属、克雷伯氏菌属和Rouxiella属的细菌相对分离率为17.6%、23.1%、13.2%和13.2% ,均是幼虫肠道分离菌株中的优势菌属(表3)。
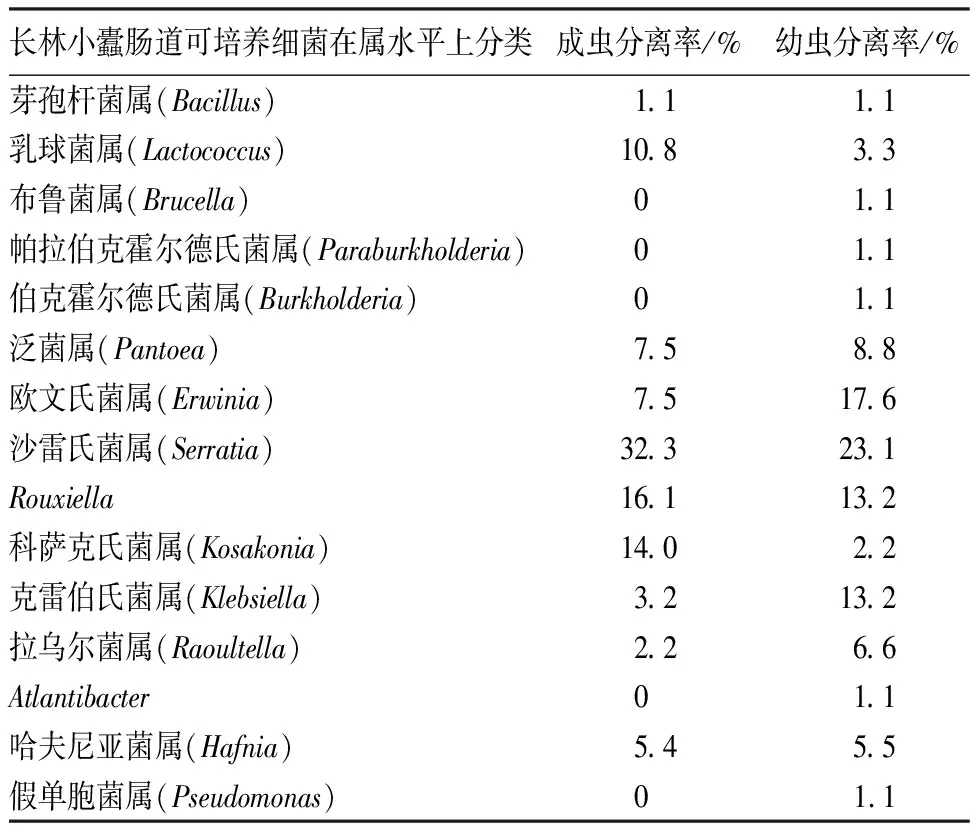
表3 长林小蠹成虫与幼虫肠道可培养细菌在属水平上的组成情况
从种水平上看,长林小蠹成虫肠道中可培养的细菌有 10 种,分别为解蛋白芽孢杆菌、乳酸乳球菌、Pantoeacypripedii、野梧桐欧文氏菌、黏质沙雷氏菌、罗克西拉席尔瓦菌、科萨克尼亚嗜米肠杆菌、催产克雷伯菌、土生拉乌尔菌、耐冷哈夫尼菌。其中,黏质沙雷氏菌、罗克西拉席尔瓦菌和科萨克尼亚嗜米肠杆菌的相对分离率为32.3%、16.1%和13.9%,是成虫肠道分离菌株中的优势菌种。长林小蠹幼虫肠道中可培养的细菌有 18 种,分别为解蛋白芽孢杆菌、乳酸乳球菌、假中间布鲁氏菌、热带副伯克霍尔德菌、洋葱伯克氏菌、Pantoeacypripedii、成团泛菌、野梧桐欧文氏菌、Erwiniatypographi、黏质沙雷氏菌、罗克西拉席尔瓦菌、科萨克尼亚嗜米肠杆菌、催产克雷伯菌、土生拉乌尔菌、Raoultellaelectrica、赫尔曼亚特兰大杆菌、耐冷哈夫尼菌、蛋白原假单胞菌。其中,黏质沙雷氏菌、野梧桐欧文氏菌、罗克西拉席尔瓦菌和催产克雷伯菌的相对分离率为23.1%、16.5%、13.2%和13.2%,是幼虫肠道分离菌株中的优势菌种(表4)。
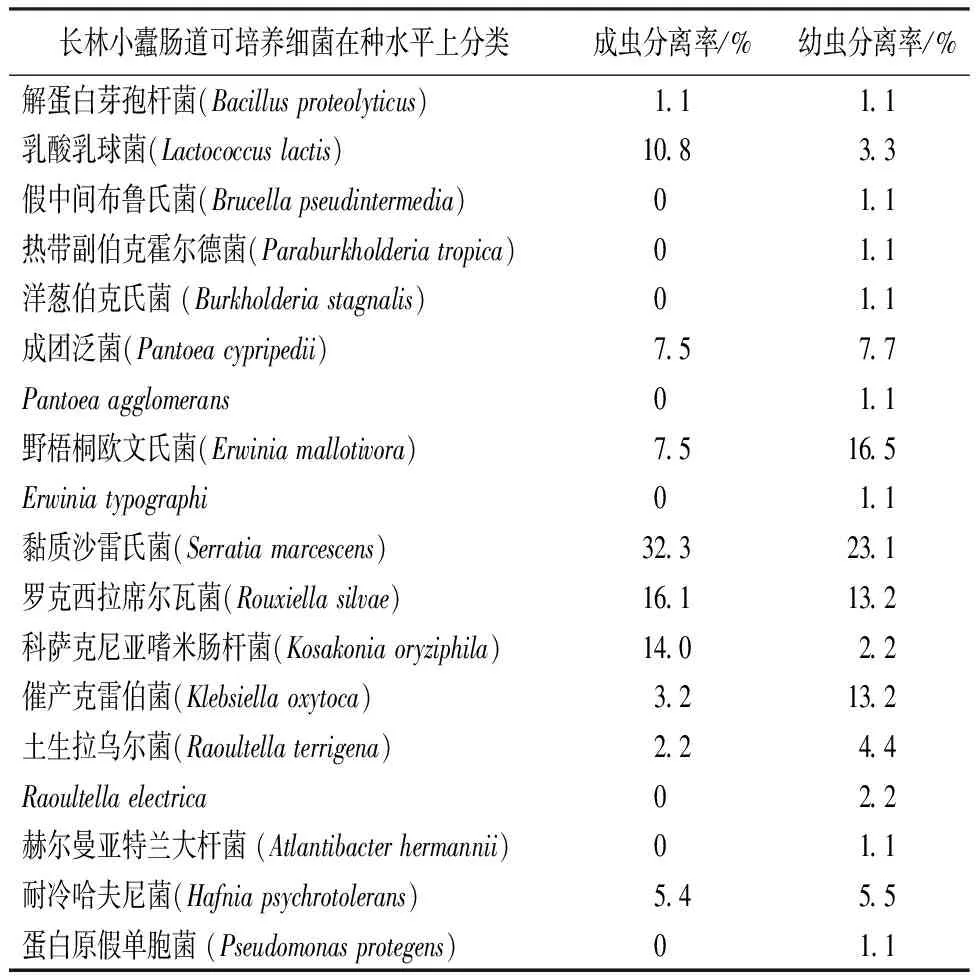
表4 长林小蠹成虫与幼虫肠道可培养细菌在种水平上的组成情况
3 结论与讨论
昆虫肠道内栖息着大量的微生物,在长期协同进化的过程中与寄主发展为密不可分的共生关系,协助寄主适应各种生境[18]。本研究采用传统细菌分离培养法结合形态学及16S rDNA测序技术,对采自山东省烟台市牟平区以黑松为寄主的长林小蠹成虫及幼虫的肠道细菌进行分离培养,共分离到2门4纲6目9科15属18种。从门水平看,成虫和幼虫肠道可培养细菌均以变形菌门为优势菌门,厚壁菌门少量存在,符合昆虫肠道细菌优势菌门的研究结果[19];从科水平看,γ-变形菌纲中的肠杆菌科和欧文氏菌科是优势菌科,与娄巧哲[11]对红脂大小蠹肠道可培养细菌的优势菌科一致;从属水平上看,长林小蠹肠道可培养细菌一共有15个属,分别为芽孢杆菌属、乳球菌属、布鲁菌属、帕拉伯克霍尔德氏菌属、伯克霍尔德氏菌属、泛菌属、欧文氏菌属、沙雷氏菌属、Rouxiella属、科萨克氏菌属、克雷伯氏菌属、拉乌尔菌属、Atlantibacter属、哈夫尼亚菌属、假单胞菌属;其中,成虫肠道细菌优势菌属为沙雷氏菌属、Rouxiella属及科萨科氏菌属,幼虫肠道细菌优势菌属为沙雷氏菌属、欧文氏菌属、Rouxiella属及克雷伯氏菌属,与娄巧哲对红脂大小蠹肠道可培养细菌及胡霞对华松山大小蠹肠道细菌多样性分析的研究报道具有一定的相似性[11-12]。与目前我国分布的其他小蠹虫相比,布鲁氏菌属和Atlantibacter属是长林小蠹肠道可培养细菌所特有的属,假中间布鲁氏菌(Brucellapseudintermedia)和赫尔曼亚特兰大杆菌(Atlantibacterhermannii)是长林小蠹肠道可培养细菌所特有的种。
沙雷氏菌属和Rouxiella属作为长林小蠹肠道可培养细菌的优势菌属,在成虫和幼虫肠道内均处于优势地位。据报道,沙雷氏菌属的细菌通过在寄主肠道中形成免疫反应等方式,如诱导细胞色素P450和谷胱甘肽S-转移酶等解毒酶对萜烯化合物进行降解[20-21],由此推测沙雷氏菌属的细菌提高了长林小蠹对新环境的入侵和适应能力;对于Rouxiella属的细菌报道较少,有研究从树液分泌物中分离出Rouxiella属的细菌[22],推测可能通过长林小蠹的取食和蛀道等行为进入肠道,其功能还需进一步探讨。欧文氏菌属和克雷伯氏菌属作为长林小蠹幼虫肠道可培养细菌的优势菌属,通过产生分解酶的方式降解纤维素[23],协助幼虫的食物消化和营养利用。此外,本研究还发现,幼虫与成虫肠道细菌存在一定的差异,幼虫肠道中存在的布鲁菌属、帕拉伯克霍尔德氏菌属以及Atlantibacter属等,猜测可能与幼虫生长发育的特定需求有关[24],也可能参松属植物防御物质的解毒作用,如代谢萜类化合物及酚类化合物等[25-26]。以上细菌对于长林小蠹生理生化过程的影响,还有待进一步挖掘。
长林小蠹是全球林业重要的害虫,尤其是对松科植物的危害极其严重,对其肠道细菌进行研究,不仅可以补充昆虫肠道共生菌的资源库,还可以据此进一步分析肠道细菌对昆虫生长发育、营养调控以及解毒代谢的影响,最终得到绿色防治长林小蠹的生物制剂,从而降低其危害。
