水热法合成催化氧化高含硫废水的Ni-MnO2/Al2O3制备条件优化
2024-01-13谭文捷尹丽虹李文轩马秀彪孙文珊王永强
谭文捷 尹丽虹 李文轩 马秀彪 孙文珊 王永强
(1.中国石油化工股份有限公司石油勘探开发研究院;2.中国石油大学(华东)化学化工学院)
0 引 言
硫杂质是原油中含量最高的杂质成分,天然气和原油中硫含量约为0.03%~6%[1],在石油天然气开采过程中,采出水及其后续的脱硫除杂工艺会产生大量的含硫污水;此外,制药、造纸以及其他化工行业的某些工艺也会产生含硫污水[2]。污水中的含硫化合物会导致工艺设备和管道的腐蚀,影响生物生长,产生的H2S气体是剧毒物质,对大气环境乃至人身健康造成严重威胁[3-4]。
目前,对于含硫污水的处理有物理法、化学法、生物法等多种方法[5],针对不同成分和浓度的含硫污水应采取相应的处理技术。催化氧化法因操作简单、反应速率快、处理范围广等优点,在油气田含硫污水处理中应用较广[6]。催化氧化法处理废水的关键是高效催化剂的开发,而负载型异相催化剂具有活性高、易于分离的优点,是目前研究的热点。国内外有部分学者已对此开展过相关研究,Lu等[7]利用浸渍法制备的新型Mo/MMS氧化脱硫催化剂,硫离子最高去除率可达97.5%;Rivoira等[8]制备的Ti-CMK-3碳介孔催化剂,在30 min内可以氧化2 000 mg/L硫,极大节约了时间和成本;郭二亮、姜蔚等[9-10]均以γ-Al2O3为载体,利用浸渍法分别制备了MnO2/γ-Al2O3和Mo/γ-Al2O3负载异相催化剂,效果显著且多次循环利用,硫离子去除率无明显降低。负载异相催化剂的研究在不断突破,但以上研究主要适用于含硫浓度低或反应速率慢的含硫废水,无法适用于油气开采过程或其他化工过程中产生的高浓度含硫污水。因此,研究出一种可以快速高效处理高浓度含硫废水的催化剂具有重要意义。
α-MnO2材料具有活性高、比表面积大、毒性低、资源丰富、价格低廉、合成方法多样等优点[11-12],向α-MnO2材料中掺杂Ni、Cu等过渡金属元素改性可以进一步提高其催化性能。水热法因其制得的材料纯度高、分散性好、晶型好、形状可控等优点得到广泛关注[13]。因此本文利用水热法制备了Ni金属助剂的Ni-MnO2/Al2O3催化剂,通过优化制备催化剂时的Ni金属助剂掺杂浓度、水热温度、水热时间、焙烧温度,以确定催化剂的最佳制备条件;并通过BET、XPS等表征手段考察上述制备条件对催化剂活性的影响。
1 实验材料及方法
1.1 试剂和仪器
实验试剂:γ-Al2O3载体(购于巩义市洁之源净水材料有限公司);九水合硫化钠、硫代硫酸钠、碘化钾、可溶性淀粉、硫酸、盐酸、高锰酸钾、硝酸镍(均为AR,购于国药集团化学试剂有限公司);碘、硫酸锰一水合物(均为AR,购于上海麦克林生化科技有限公司)。
实验仪器:电热恒温鼓风干燥箱(FCD-E6000型,上海朗轩实验设备有限公司)、电子分析天平(BT 124S型,梅特利-托利多仪器(上海)有限公司)、X射线衍射仪(XRD-6100型,岛津公司)、场发射扫描电子显微镜(SU-8200型,日立高新技术有限公司)、物理吸附仪(Ipore-400型,理化联科仪器科技有限公司)、X射线光电子能谱仪(ESCALAB 250Xi,美国ThermoFisher)、臭氧发生器(FH-CYJ1510A-Y型,上海枫花光电科技有限公司)、空气泵(LP-20型,上海仁创环境科技有限公司)、循环式真空泵(SHZ-D(Ⅲ)型,巩义市予华仪器有限责任公司)、气体流量计(LZB-3WB型,济南科德仪表科技有限公司)。
1.2 催化剂的制备
取0.55 g KMnO4样品溶解至14 mL去离子水中,然后将KMnO4溶液转移到反应釜中,加入适当的γ-Al2O3小球作为载体。将0.89 g MnSO4·H2O与0.51 g Ni(NO3)2·6H2O溶解至21 mL去离子水中,所得的溶液与0.3 mL浓硫酸逐滴滴加到反应釜中,放入烘箱在110℃下进行水热反应,12 h后取出冷却至室温,分离,在75℃下干燥12 h,制得Ni-MnO2/Al2O3催化剂。
1.3 模拟含硫废水开展催化剂活性评价实验
含硫废水:取22.5 g九水合硫化钠溶于1 L去离子水中,加入盐酸调节pH值至8,得到硫离子浓度为3 000 mg/L的模拟含硫废水。
催化剂活性评价:催化剂活性评价在圆柱形反应器内进行,反应器底部设有进气装置与空气泵连接,在硫离子浓度为3 000 mg/L、催化剂用量为12.5 g/L、曝气量(空气)为0.75 L/min的条件下进行反应。反应开始后每隔一定时间取定量废水按照国标HJ/T 60—2000《水质 硫化物的测定 碘量法》进行分析,硫离子的去除率由公式(1)计算。
(1)
式中:C0为反应开始时废水中硫离子的浓度,mg/L;Ct为反应tmin后废水中硫离子的浓度,mg/L;η为硫离子去除率,%。
2 结果与讨论
2.1 Ni金属掺杂浓度的影响
掺杂的金属助剂浓度会影响催化剂表面化学态、孔结构和比表面积[14]。图1为不同金属助剂浓度下制备催化剂的催化性能。由图1可以看出,镍与锰的摩尔比为2∶10时催化剂的催化性能最强,反应100 min后的硫离子转化率为95.23%。随着镍金属助剂掺杂量的增加,催化剂的催化性能呈先增加后降低的趋势,反应100 min后的硫离子转化率分别为78.56%,95.23%,92.85%,88.68%,这可能是由于催化剂掺入适量的镍金属后,镍锰间的相互作用使得催化剂中的MnO2晶粒尺寸变小,分散度变好,能提供更多的活性位点。
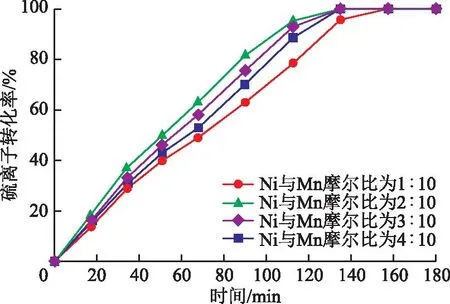
图1 金属助剂浓度对催化剂活性的影响
对不同金属助剂浓度的催化剂进行N2吸脱附表征,结果见表1。
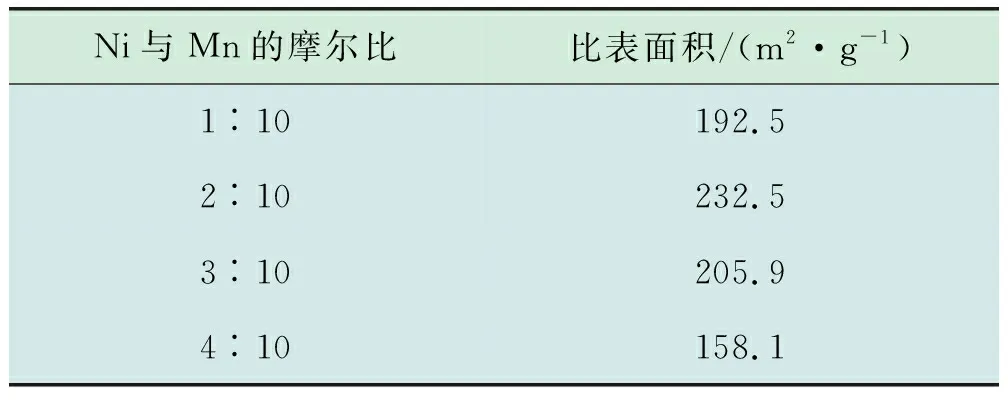
表1 不同金属助剂掺杂浓度催化剂的BET表征结果
由表1可知,当镍与锰摩尔比由1∶10提高至2∶10时,比表面积由192.5 m2/g提高至232.5 m2/g,提高了40 m2/g。而当摩尔比由2∶10提高至4∶10时,比表面积骤降至158.1 m2/g,降低了74.4 m2/g,证明金属助剂浓度对于催化剂比表面积影响较大。催化剂的比表面积随着镍与锰摩尔比的提高呈现先增大后减小的趋势,出现这样趋势的原因可能是金属助剂Ni的适量增加使得催化剂活性组分MnO2分散度提高,比表面积增加,但随着掺杂的金属Ni过量,可能会堵塞了活性组分MnO2的孔道结构,使其比表面积大幅度降低。
对不同Ni金属掺杂浓度下的催化剂进行XPS表征以分析催化剂表面的化学态和氧物种[15],结果如图2和表2所示。由图2可以看出,Mn的2p轨道可分为Mn3+(642.0 eV)和Mn4+(643.1 eV)两个峰,O1s的峰可以分为结合能位于529.7 eV附近的表面晶格氧(Olatt)的峰和位于531.7,533.3 eV附近的表面吸附氧(Oads)的峰,533.3 eV处的峰值与表面吸附的活性基团有关,而531.7 eV处的峰则归因于催化剂表面氧空位吸附的缺陷氧化物或表面氧离子。
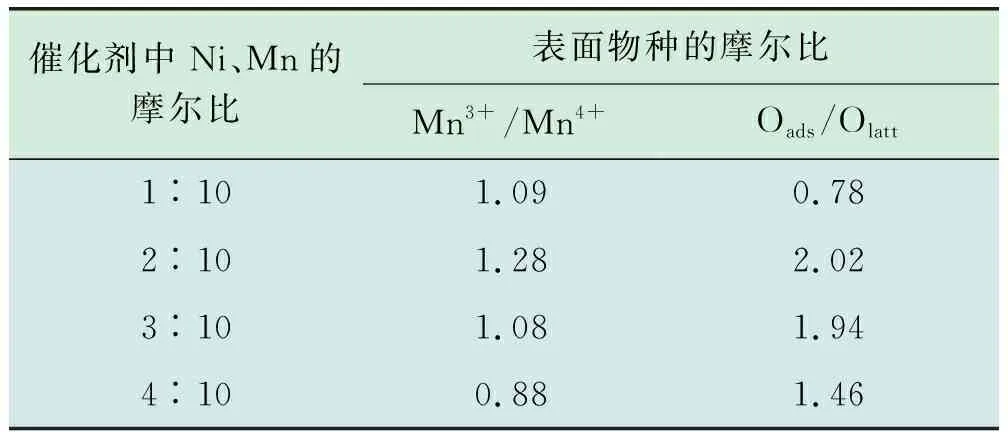
表2 不同金属助剂浓度催化剂的XPS表征结果

图2 不同金属助剂浓度催化剂的Mn2p、O1s轨道的XPS图
对4种催化剂进行表面Mn3+/Mn4+和Oads/Olatt定量分析,结果见表2。由表2可以看出,镍与锰摩尔比为2∶10的催化剂,Mn3+/Mn4+的比值为1.28,高于其余3种催化剂,表明摩尔比为2∶10的催化剂的Mn3+相对含量最高,而Mn3+的存在对MnO2中氧空位的存在有重要作用,反应机理如下:
(2)
式(2)中Ov代表氧空位,故可以得知,较多的Mn3+相对含量表明制备的催化剂中含有较多的氧空位,即镍与锰摩尔比为2∶10的催化剂中的氧空位含量最高。由表2可知,镍与锰摩尔比为2∶10催化剂的Oads/Olatt比值为2.02,高于其余3种催化剂,表明摩尔比为2∶10时催化剂的表面吸附氧相对含量最高。较高的表面吸附氧相对含量和氧空位量对于催化剂的催化活性有着积极影响,在活性实验中证明摩尔比为2∶10时催化剂的催化活性最强。
2.2 水热温度的影响
图3为不同温度下制备催化剂的催化性能。由图3可以看出,在100,110,120,130,140℃下制备的Ni-MnO2/Al2O3,反应90 min后硫离子转化率分别为78.72%,90.81%,85.70%,77.1%,76.44%,催化效果呈现先升高后保持相对平缓的趋势,在水热温度为110℃下制备的Ni-MnO2/Al2O3具有最佳的催化活性。
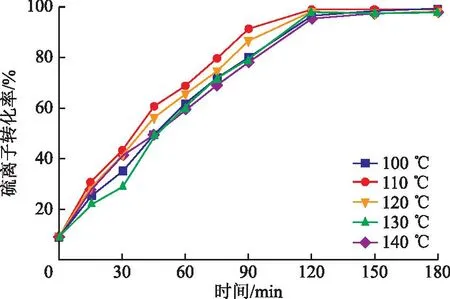
图3 水热温度对催化剂活性的影响
对不同水热温度下制备的催化剂进行N2吸脱附表征,结果见表3。催化剂的比表面积随着水热温度的提高呈现先增大后减小的趋势,在水热温度为110℃时,催化剂的比表面积最大,为232.5 m2/g,比表面积越大,越有利于催化剂表面暴露出更多的活性位点,从而提高催化剂的活性。
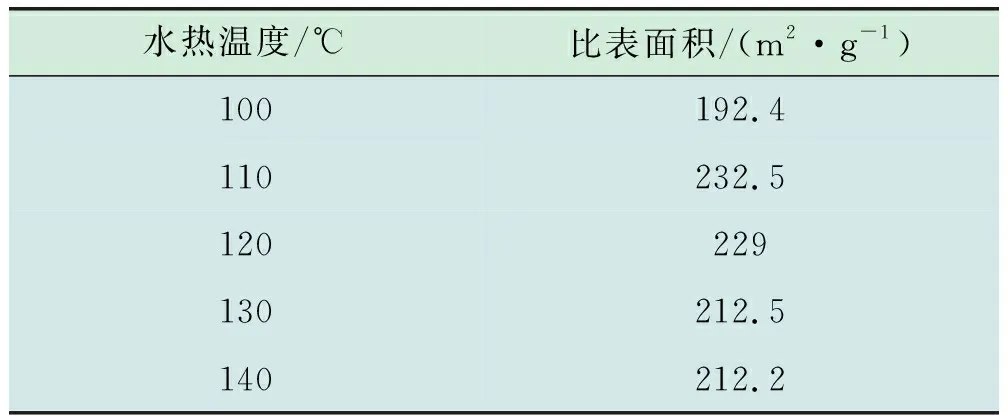
表3 不同水热温度催化剂的BET表征结果
在100℃下制备的催化剂的比表面积最小,为192.4 m2/g,变化幅度较低,表明水热温度对于催化剂的比表面积影响较小。
图4为不同水热温度下制备的催化剂在放大20 000倍后的SEM图。由图4可以看出,在100℃制备的催化剂表面形貌以两头粗细不一的棒状为主。在110℃制备的催化剂表面形貌变为规整的片状结构,片状MnO2相互连接形成孔状结构,从而使得110℃制备的催化剂比表面积显著大于100℃制备的催化剂。而随着水热温度的进一步增加,催化剂表面的片状结构逐渐被破坏,部分孔道结构也被堵塞,这可能是110℃后催化剂比表面积随着水热温度提高而降低的原因。

图4 不同水热温度下制备的Ni-MnO2/Al2O3的SEM图
2.3 水热时间的影响
图5为不同水热时间下制备催化剂的催化性能。由图5可以看出,在水热时间为8,10,12,14,16 h条件下制备的催化剂反应90 min后的硫离子转化率分别为74.56%,71.43%,90.80%,63.34%,53.90%,催化剂的催化效果呈现先升高再降低的趋势,且硫离子转化率变化幅度较大。
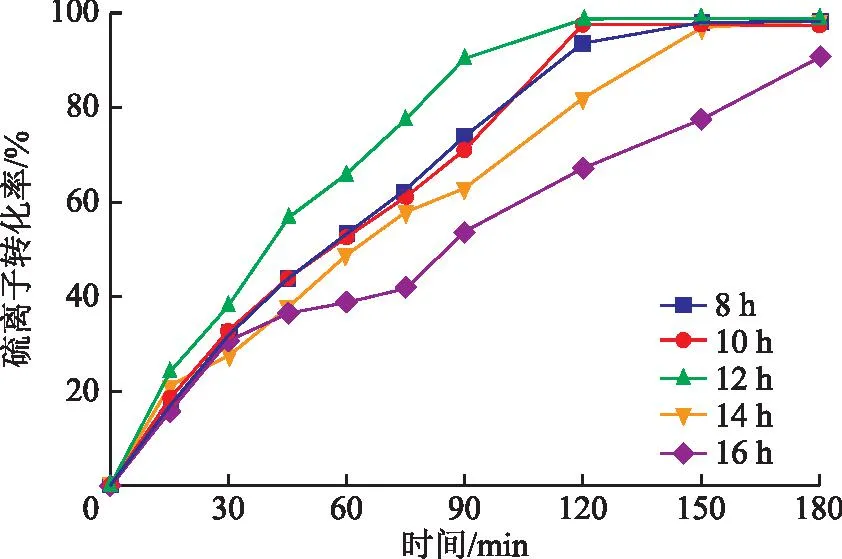
图5 水热时间对催化剂活性的影响
而在8 h下制备的催化剂的比表面积最小,为184.7 m2/g,表明催化剂的比表面积受水热时间的影响要低于金属助剂浓度的影响。
对不同水热时间下制备的催化剂进行N2吸脱附表征,结果见表4。由表4可知,催化剂的比表面积随着水热时间的提高呈现先增大后减小的趋势,在水热时间为12 h时,催化剂的比表面积最大,为232.5 m2/g,这可能是水热时间为12 h时催化剂活性最强的原因之一。
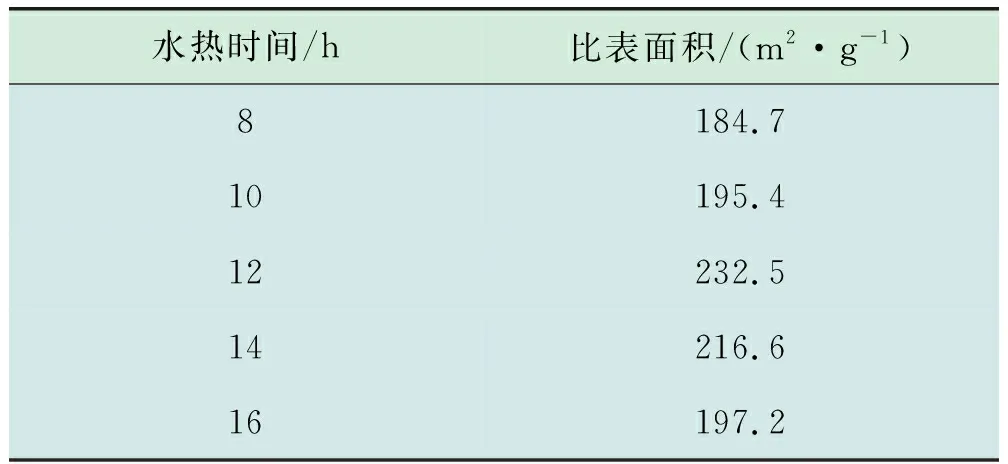
表4 不同水热时间催化剂的BET表征结果
图6为不同水热时间下制备的催化剂在放大20 000倍后的SEM图,可以看出,5种催化剂的表面形貌差别较大。水热时间为8 h时,催化剂表面形貌以短粗且密集的棒状结构为主;水热时间为10 h时,催化剂表面形貌开始出现些许的片状结构,但是片状结构之间呈封闭状态;水热时间为12 h时,催化剂表面形貌为整齐的片状结构,片状MnO2相互连接形成孔状结构;水热时间为14 h时,催化剂表面形貌上的片状结构出现断裂扭曲,部分孔状结构被堵塞;水热时间为16 h时,催化剂表面形貌变为以球状结构为主,且有棒状和片状结构混合。

图6 不同水热时间下制备的Ni-MnO2/Al2O3的SEM图
综合N2吸脱附表征结果,可以证明在12 h下制备的催化剂表面的孔状结构提供了更多的比表面积,有利于暴露出更多的活性位点,从而提高催化剂的催化活性。
2.4 焙烧温度的影响
焙烧催化剂可去除表面的化学结合水和挥发性杂质,并且适当的焙烧温度可以使催化剂的比表面积和孔隙结构得到优化,提高催化剂的强度[16-17]。
图7为不同焙烧温度下制备催化剂的催化性能。由图7可以看出,随着焙烧温度的提高,催化剂的催化效果呈现先增加后保持相对平缓的趋势,在400℃下焙烧的催化剂具有最高的活性,反应90 min后的硫离子转化率为96.6%,这可能是由于适宜的焙烧温度去除了催化剂中的杂质,提高了比表面积。
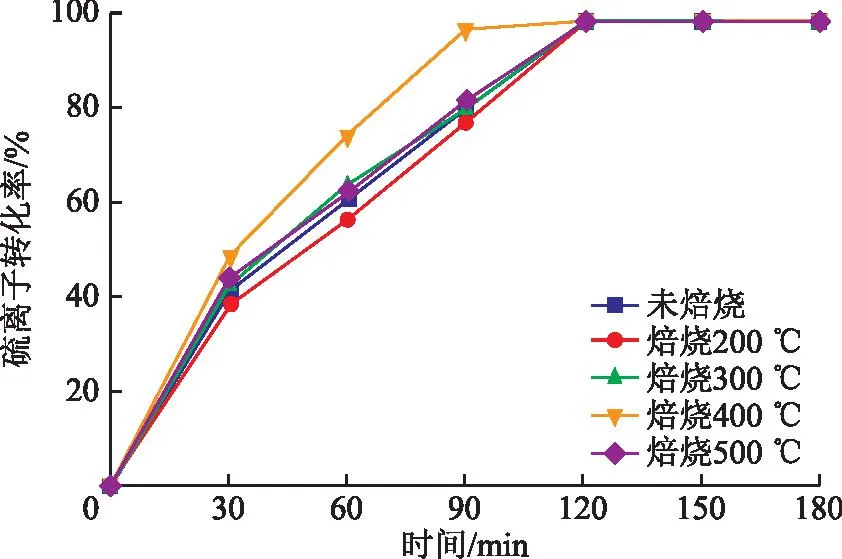
图7 焙烧温度对催化剂活性的影响
对Al2O3载体、Ni-MnO2/Al2O3催化剂及经过400℃焙烧后的Ni-MnO2/Al2O3催化剂进行N2吸脱附表征,结果如表5所示。由表5可以看出,负载活性组分Ni-MnO2后,比表面积由Al2O3载体的265.6 m2/g降低至232.5 m2/g,原因可能是活性组分Ni-MnO2堵塞了Al2O3载体的孔道。经过400℃焙烧后,催化剂的比表面积增加至247.3 m2/g,这可能是由于适当的焙烧温度去除了催化剂中的杂质,优化了孔结构,提高了比表面积,因此,经过400℃焙烧后的催化剂活性最强。

表5 3种材料的BET表征结果
3 结 论
1)通过考察不同条件对催化剂活性的影响,结果表明:在镍与锰的摩尔比为2∶10,在110℃下水热12 h后,再经400℃焙烧2 h的制备条件下制备的催化剂催化活性最佳,在硫化物浓度为3 000 mg/L,催化剂用量为12.5 g/L,曝气量为0.75 L/min的条件下反应90 min后硫离子转化率达到96.6%。
2)催化剂比表面积受Ni金属助剂掺杂浓度的影响最大,其次是水热时间和水热温度。金属助剂浓度对比表面积和表面化学态的影响较大,当Ni与Mn的摩尔比为2∶10时,催化剂具有最大比表面积232.5 m2/g,最多的氧空位和吸附氧相对含量。水热温度和时间会影响催化剂的表面形貌和比表面积,制备条件为110℃和12 h时,催化剂具有最大的比表面积232.5 m2/g,表面形貌以片状和孔道结构为主。
