葛根素调控SLC7A11/GPX4轴抑制高糖诱导的成骨细胞铁死亡
2024-01-12陈涛余良昆陈瑶陈静超周栅刁丽媛
陈涛余良昆陈瑶陈静超周栅刁丽媛*
1.江西中医药大学附属医院,江西 南昌 330006 2.江西中医药大学研究生院,江西 南昌 330004 3.南昌大学第二附属医院,江西 南昌 330006
糖尿病性骨质疏松症(diabetic osteoporosis,DOP)是糖尿病患者发生脆性骨折的主要原因,是一种严重的肌肉骨骼并发症[1]。每年全世界有900多万例骨质疏松性骨折发生,其中大多数与DOP有关[2],这对人们健康构成了重大威胁。在过去的10年中,随着对糖尿病微环境和矿物质稳态的不断深入研究,皮质孔隙度增加、骨代谢不平衡和骨微结构改变已被确定为DOP的3个主要特征[3]。尽管越来越多的临床证据表明,糖尿病微环境对骨代谢具有毁灭性的影响,但DOP潜在的病理生理机制和有效的治疗方法仍有待进一步研究[4-5]。
铁死亡是由铁依赖性的脂质过氧化引起的一种新的程序性细胞死亡[6]。与其他形式的细胞死亡不同,铁死亡具有独特的生物学特征,如铁积累,脂质过氧化物产生增加,谷胱甘肽过氧化物酶4(GPX4)表达下调[7-8]。近年来,越来越多的证据证实了糖脂代谢与铁死亡之间的密切关系[9-10]。DOP的进展总是伴随着糖脂稳态受损和血浆糖脂代谢产物升高,因此,铁死亡可能在DOP的发病机制中起重要作用。然而,对于糖尿病微环境中成骨细胞与铁死亡之间的关系知之甚少。
葛根(radix puerariae,RP)是中国古代广泛使用的一种强效治疗草药[11]。据汉代《神农本草经》记载,它有升阳解肌,透疹止泻,除烦止渴、益阴清热之功效。RP被报道用于治疗糖尿病已有两千年的历史,如玉泉丸、消渴丸、七味白术散等在治疗消渴中的记载也证明了这一点。总体而言,RP对糖尿病及其并发症有较好的疗效。葛根素(Puerarin,PUE)是RP的有效成分,已被证明可以治疗多种疾病,包括心血管病、骨质疏松症、炎症、肝损伤、癌症和糖尿病[12-14]。本研究旨在评估PUE在体外高糖环境下对成骨细胞的作用,并确定PUE是否通过SLC7A11/GPX4途径抑制高糖诱导的铁死亡来保护成骨细胞,为PUE在未来的DOP治疗运用中提供理论基础。
1 材料与方法
1.1 材料
1.1.1实验药物:葛根素(CAS NO.6381-99-0)购自成都德锐可生物科技有限公司。
1.1.2实验试剂:α-MEM培养基、胎牛血清、青霉素/链霉素、葡萄糖购自赛默飞公司;CCK-8试剂盒、ALP活性试剂盒、ALP染色试剂盒、DHE染色试剂、GSH试剂盒、茜素红染色试剂盒、MDA试剂盒、SOD试剂盒购自碧云天公司;RNA提取试剂盒、逆转录试剂盒购自TAKARA公司;GAPDH、SLC7A11、GPX4购自Cell Signaling Technolog公司。
1.1.3实验细胞:成骨细胞MC3T3-E1细胞系购自武汉尚恩生物公司。
1.1.4细胞培养:使用α-MEM完全培养基(含10%胎牛血清,1%双抗)培养MC3T3-E1细胞,置于37℃,5%CO2的培养箱中,每2 d更换一次培养基,当细胞生长汇合至80%时进行传代和种板。
1.2 研究方法
1.2.1CCK-8检测PUE对MC3T3-E1细胞活性的影响:将细胞种于96孔板(每孔3×103个),过夜培养后,使用不同浓度的PUE(0、5、10、25、50、100、200μmol/L)在完全培养基或高糖(葡萄糖25.5 mmol/L)培养基中干预24 h。24 h后,每孔加入10μL CCK-8溶液,置于培养箱中孵育1 h,使用microplate reader在450 nm处检测每孔细胞的OD值。
1.2.2ALP染色及活性检测:将细胞种于24孔板(每孔2×104个),过夜培养后,更换成骨诱导培养基(含10 mmol/L β-甘油磷酸钠、0.1μmol/L地塞米松和50 mg/L VitC 4)进行培养将细胞分为对照组(Control)、高糖模型组(HG)、高糖+PUE低浓度组(HG+PUE 50μmol/L)、高糖+PUE高浓度组(HG+PUE 100μmol/L),干预持续7 d,每2 d更换一次培养基。7 d后去培养基,PBS清洗,多聚甲醛固定细胞10 min,PBS清洗3次。根据试剂盒说明书配置ALP染色工作液,每孔加入500μL,避光孵育30 min后观察拍照。ALP活性根据试剂盒说明书操作,收集细胞,使用细胞裂解液裂解细胞,离心收集上清,配置标准品和样品,加入96孔板中,加入50μL检测缓冲液,37℃孵育10 min,加入100μL反应终止液终止反应,使用microplate reader在405 nm处检测OD值。
1.2.3茜素红染色:将细胞种于24孔板(每孔2×104个),过夜培养后,更换成骨诱导培养基(含10 mmol/L β-甘油磷酸钠、0.1μmol/L地塞米松和50 mg/L VitC 4)进行培养,将细胞分为对照组(Control)、高糖模型组(HG)、高糖+PUE低浓度组(HG+PUE 50μmol/L)、高糖+PUE高浓度组(HG+PUE 100μmol/L)。诱导28 d后,用茜素红染色试剂对MC3T3-E1成骨细胞进行成骨评估。为了定量评估矿化程度,用10%(wt/vol)十六烷基氯化吡啶洗脱茜素红染色剂1 h,并通过microplate reader检测570 nm处OD值。
1.2.4细胞内ROS水平评估:将细胞种于24孔板(每孔2×104个),过夜培养后,将细胞分为对照组(Control)、高糖模型组(HG)、高糖+PUE低浓度组(HG+PUE 50μmol/L)、高糖+PUE高浓度组(HG+PUE 100μmol/L),干预24 h。24 h后用超氧化物阴离子荧光探针(Dihydroethidium,DHE)检测细胞内ROS水平。用无血清α-MEM培养基洗涤细胞,用10μmol/L DHE在37℃避光条件下处理20 min。孵育后,用无血清α-MEM培养基冲洗MC3T3-E1细胞,使用荧光显微镜摄取图像。
为了量化细胞内ROS水平,收集细胞并用PBS冲洗,随后在无血清α-MEM培养基中重悬,最后用10μmol/L DHE在黑暗中37℃处理20 min。孵育后,MC3T3-E1细胞用无血清α-MEM培养基冲洗,随后用FACSCalibur流式细胞仪评估平均荧光强度。
1.2.5GSH、MDA、SOD水平检测:将细胞种于6孔板(每孔2×105个),过夜培养后,将细胞分为对照组(Control)、高糖模型组(HG)、高糖+PUE低浓度组(HG+PUE 50μmol/L)、高糖+PUE高浓度组(HG+PUE 100μmol/L),干预24 h。24 h后分别根据GSH试剂盒、MDA试剂盒和SOD试剂盒检测细胞中GSH、MDA、SOD水平。
1.2.6qRT-PCR:使用MiniBEST Universal RNA Extraction Kit提取总RNA,并使用Primescript RT Master Mix进行反转录。使用SYBR预混剂ex taq Ⅱ试剂盒在LightCycler 480实时PCR系统上进行qRT-PCR。表1中列出了用于扩增ALP、Runx2、COL1A1、OPN和β-actin的引物。扩增条件如下:95℃持续30 s,95℃持续5 s,60℃持续20 s,循环40次。相对mRNA表达量通过比较周期阈值(Ct)进行量化,β-actin作为内对照,实验数据采用2-ΔΔCt方法处理。
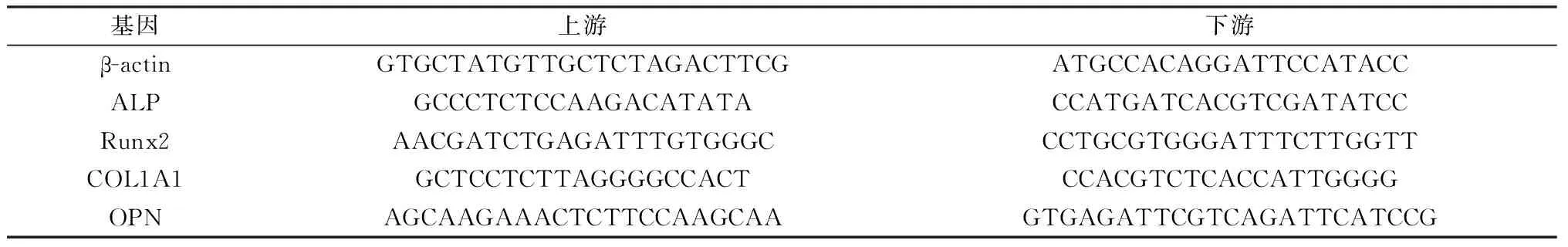
表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.2.7Western blot检测:干预结束后,去除孔内培养基,加入PBS反复洗涤,然后加入RIPA裂解液提取总蛋白,在4℃下以12 000g离心15 min,获得含总蛋白的上清液,蛋白变性后进行电泳和转膜、封闭,置于一抗(稀释比例为1∶1 000)中,4℃过夜。然后将膜小心地移至二抗培养箱中,加入二抗,室温孵育1 h。蛋白带用Western ECL Substrate Kit进行可视化。使用Bio-Rad扫描仪获取图像,并使用数字图像分析软件定量,GAPDH作为内参。
1.3 统计学分析
采用SPSS 25.0和Prism 8.0软件进行数据统计及图表绘制,所有数值资料均以均数±标准差表示。两组间数值数据的差异采用Student’st检验。单向方差分析用于检验多组间的差异,然后进行Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 PUE对MC3T3-E1细胞活性的影响
与对照组相比,100μmol/L以下的PUE对MC3T3-E1细胞无明显毒性作用;200μmol/L 的PUE明显抑制MC3T3-E1细胞增殖(P<0.05)。与对照组相比,HG明显降低了MC3T3-E1细胞活性;然而,PUE处理后明显提高了MC3T3-E1细胞生存率,其中浓度为50、100μmol/L PUE对MC3T3-E1细胞的保护作用最为明显(P<0.05)。见图1。因此,本研究选择了50μmol/L和100μmol/L的PUE进行后续实验。

图1 PUE对MC3T3-E1细胞活性的影响A:PUE化学结构式;B:24 h PUE对MC3T3-E1细胞活性的影响;C:24 h PUE对高糖诱导下MC3T3-E1细胞活性的影响。Fig.1 Effects of PUE on MC3T3-E1 cell activityA: chemical structural formula of PUE; B: effect of PUE on MC3T3-E1 cell activity at 24 h; C: effect of PUE on MC3T3-E1 cell activity induced by high glucose at 24 h.注:与对照组比,****P<0.000 1,###P<0.001;与HG组比,**P<0.01,****P<0.000 1;ns:P>0.05。
2.2 PUE对高糖环境下MC3T3-E1细胞成骨分化能力的影响
MC3T3-E1细胞在进行成骨诱导28 d后,与对照组相比,HG干预后明显降低了ALP染色阳性率以及ALP活性;此外,茜素红染色结果表明HG诱导后明显降低了MC3T3-E1细胞ARS染色阳性率和矿化结节数量。然而,PUE处理后明显提高了ALP和ARS染色阳性率以及ALP活性(P<0.05)。为了进一步研究PUE对HG诱导的成骨细胞成骨分化的影响,通过qRT-PCR方法检测PUE对HG诱导的MC3T3-E1成骨细胞中ALP、Runx2、COL1A1和OPN的表达。结果表明,HG降低了ALP、Runx2、COL1A1和OPN的mRNA表达水平(P<0.05),而PUE则明显增加了ALP、Runx2、COL1A1和OPN的mRNA表达水平(P<0.05)。这些结果表明PUE对HG诱导的成骨细胞成骨分化具有保护作用。见图2。
2.3 PUE通过抑制HG诱导的铁死亡发挥保护作用
细胞铁死亡的特征在于胞内谷胱甘肽(GSH)耗尽,铁依赖性脂质过氧化不断累积,ROS水平升高,从而引起细胞死亡[15]。DHE染色显示,HG诱导24 h后,细胞内红色荧光亮度明显更高,表明ROS生成增加,PUE处理后荧光亮度明显降低,代表着较低的ROS水平。为了定量研究PUE对ROS产生的抑制作用,本研究采用流式细胞术进行检测,结果显示了相似的趋势。PUE抑制HG诱导的ROS生成呈剂量依赖性,其中100μmol/L的PUE对ROS生成的抑制效果最显著(P<0.05)。在脂质过氧化方面,PUE显著降低了HG诱导的脂质过氧化生成,包括GSH和MDA水平,并提高了SOD活性(P<0.05)。见图3。总之,本研究结果表明,铁死亡参与了HG诱导的细胞死亡过程,PUE可能通过抑制HG诱导的铁死亡发挥保护作用。

图3 PUE通过抑制HG诱导的铁死亡发挥保护作用A:DHE染色,红色代表ROS阳性细胞;B~C:流式细胞技术检测PUE对高糖诱导下MC3T3-E1细胞ROS水平的影响;D~F:PUE对高糖诱导下MC3T3-E1细胞GSH、SOD、MDA水平的影响。Fig.3 PUE exerts a protective effect by inhibiting HG-induced ferroptosisA: DHE staining, red colour represents ROS-positive cells; B, C: Effect of PUE on ROS levels in MC3T3-E1 cells induced by high glucose as detected by flow cytometry; D-F: Effect of PUE on GSH, SOD and MDA levels in MC3T3-E1 cells induced by high glucose.注:与对照组比,**P<0.01,***P<0.001,****P<0.000 1;与HG组比,#P<0.05,##P<0.01,###P<0.001,####P<0.000 1。
2.4 PUE通过SLC7A11/GPX4信号通路保护MC3T3-E1细胞抵抗铁死亡
SLC7A11是胱氨酸/谷氨酸转运体系统(cystine/glutamate transporter,Xc-系统)的一个亚基,具有多种功能,包括导入用于合成谷胱甘肽的细胞外半胱氨酸、清除ROS和增强细胞抗氧化活性[16]。SLC7A11/GPX4轴在防止脂质过氧化介导的铁死亡中起关键作用,抑制SLC7A11和GPX4会中断细胞内GSH代谢,促进脂质过氧化和随后的铁死亡[17]。通过Western blot实验发现,HG处理后显著降低了SLC7A11和GPX4的表达水平(P<0.05)。然而,在HG处理的成骨细胞中添加PUE可显著提高SLC7A11和GPX4的表达水平(P<0.05)。见图4。综上所述,本研究证明PUE通过上调SLC7A11/GPX4通路抑制HG诱导成骨细胞铁死亡。
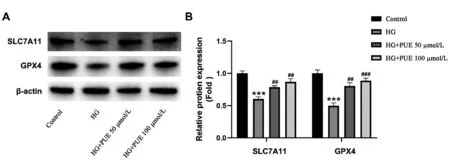
图4 PUE通过SLC7A11/GPX4信号通路保护MC3T3-E1细胞抵抗铁死亡A:SLC7A11蛋白表达情况;B:GPX4蛋白表达情况。Fig.4 PUE protects MC3T3-E1 cells against ferroptosis through SLC7A11/GPX4 signaling pathwayA: Protein expression of SLC7A11; B: Protein expression of GPX4.注:与对照组比,***P<0.001;与HG组比,##P<0.01,###P<0.001。
3 讨论
骨质疏松症被认为是糖尿病的重要并发症之一,目前的治疗方法不足以治疗糖尿病引起的骨质疏松症[18-19]。糖尿病性骨质疏松症的发病机制有待进一步研究,并开发有效的药物治疗方法。本研究使用25.5 mmol/L葡萄糖来模拟体外糖尿病环境下的成骨细胞,发现高糖环境下极大地降低了MC3T3-E1细胞的活性和成骨潜力[20-21]。此外,铁死亡是一种新的细胞死亡模式,在糖尿病性骨质疏松症的发病中起作用。本研究发现PUE通过上调SLC7A11/GPX4通路有效地减少高糖诱导的成骨细胞铁死亡,从而减轻骨质疏松症。笔者认为,PUE可能是治疗糖尿病骨质疏松症的有效方法之一。
葛根素是从中药葛根中提取的主要异黄酮苷。它在降低血压[22]、血糖、血脂[23]和癌症[24]方面的治疗作用已被广泛研究。Shan等[25]的研究发现PUE能够抑制NF-κB信号通路减少骨质丢失。一些研究还表明PUE抑制破骨细胞的生成和骨吸收[26]。例如,最近的一项研究表明,PUE通过抑制自噬反应来抑制破骨细胞的形成[27]。然而,葛根素在糖尿病骨质疏松的作用及机制尚不清楚。因此,本研究利用体外细胞模型研究了葛根素对高糖环境下成骨细胞的保护作用及机制。CCK-8结果表明PUE提高了HG环境下MC3T3-E1细胞生存率,PUE对高糖环境下成骨细胞的保护作用是剂量依赖性的,在浓度为100μmol/L时观察到的保护作用最大(P<0.05)。HG在成骨细胞分化功能障碍中发挥重要作用。Runx2引导成骨前体细胞分化成未成熟成骨细胞,然后引发启动子激活和骨表型蛋白基因的表达,包括COL1A1、ALP和OPN[28]。本研究结果表明,HG明显降低了成骨细胞ALP、ARS染色阳性率以及ALP活性。此外,用HG处理24 h可显著抑制成骨相关基因和蛋白的表达,而PUE以剂量依赖的方式上调Runx2、COL1A1、ALP和OPN的表达(P<0.05)。之前的研究发现铁超载和氧化应激是DOP发病的重要因素[29-30]。铁死亡自2012年首次报道以来,引起了科学家的极大兴趣[31]。本研究发现HG增加了成骨细胞内ROS和MDA水平,降低了细胞内GSH和SOD的水平,促进了脂质氧化物的积累。总之,这些结果表明,HG可诱导成骨细胞铁死亡。然而,PUE显著减少ROS、MDA水平和脂质过氧化生成,并恢复GSH水平以及SOD活性(P<0.05)。
SLC7A11/GPX4通路通过协助细胞内GSH合成和缓解脂质过氧化作用,发挥抵抗铁死亡的防御作用。SLC7A11能够调节细胞内谷氨酸的输出和细胞外胱氨酸的输入[32]。在细胞内吸收后,胱氨酸被还原为半胱氨酸,作为GSH合成的限速前体[33]。在GSH存在的情况下,GPX4介导有毒脂质过氧化物转化为无毒脂质醇,SLC7A11抑制导致GSH耗损,GSH耗损进而下调GPX4,导致铁依赖性脂质过氧化物积累引起细胞损伤[34]。SLC7A11/GPX4轴作为铁死亡的关键抑制通路受到了广泛的关注,被认为是铁死亡相关疾病的潜在治疗靶点。本研究发现HG处理后显著降低了SLC7A11和GPX4的蛋白表达。然而,PUE可显著提高SLC7A11和GPX4的表达水平(P<0.05)。综上所述,本研究证明PUE可能通过上调SLC7A11/GPX4通路抑制HG诱导成骨细胞铁死亡。
本研究发现葛根素通过调节SLC7A11/GPX4轴来改善高糖诱导成骨细胞铁死亡,结果表明,葛根素可能是治疗糖尿病骨质疏松症的潜在药物。在后续研究中将借助动物构建体内实验及相关通路抑制剂对其作用机制进一步研究。
