lncRNA NEAT1/SFPQ/RUNX2轴研究P-15对软骨损伤的保护作用
2024-01-12邓长弓李源力聂君兰李洪
邓长弓 李源力 聂君兰 李洪
1.川北医学院,四川 南充 637000 2.川北医学院附属医院,四川 南充 637000
骨关节炎(Osteoarthritis, OA)是一种以剧烈关节疼痛为主要症状的关节退行性疾病[1-2]。常发于中老年患者,近年来OA的发病率呈上升趋势,对患者的健康造成威胁,故如何治疗并减轻由于OA引起的僵硬、疼痛已成为目前世界所关注的问题。研究显示,在OA的发展过程中常伴随着软骨细胞的异常增殖及凋亡,故对软骨细胞凋亡的抑制有助于缓解OA的症状[3]。P-15是一种人工合成的类似人 Ⅰ 型胶原蛋白 α 链的细胞黏附材料,研究证实,P-15不仅能通过α2β1亚基促进骨细胞和成骨细胞发生迁移、增殖、分化和粘连等作用,而且还具有促进间充质干细胞向软骨细胞分化的作用[4]。长链非编码RNA(lnc RNA)属于非编码RNA,参与细胞内多种调控机制,对疾病的发生、发展和防治至关重要。NEAT1(nuclear-enriched abundant tran1)作为新发现的lncRNA,在多种肿瘤疾病中具有较高表达,而且也通常与肿瘤患者的生存期、肿瘤转移、复发等密切相关[5-6]。研究证实,NEAT1还能通过抑制细胞凋亡,从而抑制骨质疏松症的发生[7]。lncRNA NEAT1能够通过竞争性结合SFPQ,使SFPQ/PTBP2解离,释放PTBP2从而提高RUNX2的翻译水平[8-9]。RUNX2、DKK-1在膝骨关节炎软骨中高表达会造成软骨细胞肥大及外基质分解,从而导致软骨病变[10]。目前,P-15对骨关节炎软骨细胞(HC-OA)的影响及相关机制尚未阐明。本研究基于lncRNA NEAT1/SFPQ/RUNX2轴,通过体外培养软骨细胞,探讨P-15对HC-OA的影响,为OA的治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1细胞:HC-OA细胞购自Cell Applications公司(402OA-05a),用含有10 % FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM/F12完全培养基,在37 ℃、5 % CO2条件下培养。
1.1.2试剂/抗体:P-15(美国Cerapedics公司);胎牛血清、DMEM/F12培养基(美国Gibco公司,批号:1921005PJ、A4192002);LipofectamineTM2000试剂(美国Invitrogen公司,批号:11668019);反转录试剂盒(美国Fermentas公司,批号:K1622);RIPA裂解液(上海碧云天公司,批号:P0013B);蛋白酶抑制剂(北京索莱宝公司,批号:A8260);ECL化学发光试剂盒(上海碧云天公司,批号:P0018AS/ P0018AM);Cytoplasmic &Nuclear RNA Purification Kit(加拿大Norgen Biotek公司,批号:NGB-21000)。RUNX2、SFPQ、P62兔多克隆抗体(英国Abcam公司,批号:ab38148、ab23981、ab91526);Beclin-1(美国Abgent公司,批号:AP1818a);Anti-LC3B兔抗(德国Sigma公司,批号:L7543);小鼠抗β-actin单克隆抗体(上海翌圣生物公司,批号:30101ES);辣根过氧化酶标记的羊抗兔IgG/羊抗鼠IgG(北京索莱宝公司,批号:SE134、SA131)。
1.2 方法
1.2.1细胞培养:将6孔板加入P-15肽,空白对照组不做任何处理;后将生长对数期的HC-OA细胞密度以1×105/孔加入板孔,待细胞密度达到80 %左右时,按照LipofectamineTM2000试剂盒说明书进行转染siRNA NC及siRNA SFPQ。转染后培养24 h,收集细胞用于后续实验。
1.2.2细胞质/细胞核RNA分离:取对数生长期的软骨细胞,根据细胞质/细胞核RNA提取试剂盒操作说明书,从HC-OA细胞的细胞质或细胞核中分离RNA。收集HC-OA细胞并在冰上裂解5 min,然后将细胞以12 000g离心3 min,收集上清液并测量细胞质RNA,同时使用核沉淀法提取核RNA。
1.2.3实时荧光定量PCR检测LncRNA NEAT1表达:用Trizol法提取细胞总RNA,经微量核酸仪检测RNA纯度和浓度后,按照反转录试剂盒操作说明书,反转录为cDNA。以cDNA为模板进行扩增。引物序列:NEAT:F:AGCTGCGTCTATTGAATT GGTAAAGTAA,R:GACAGAAAGATCCCAACGA TAAAAATAA;β-actin:F:GGGAAATCGTGCGTG ACATT,R:GCGGCAGTGGCCATCTC。引物序列由上海生工生物工程有限公司合成。扩增程序:95 ℃预变性10 min,95 ℃变性10 sec,60 ℃退火30 sec,72 ℃延伸30 sec,共35个循环。以β-actin为内参基因,以2-ΔΔCt计算lncRNA NEAT1的相对mRNA水平。
1.2.4流式细胞术检测细胞凋亡:收集Control组、P-15组、P-15+siRNA NC组及P-15+siRNA SFPQ组软骨细胞,PBS清洗后参照Annexin V-FITC/PI试剂盒说明书操作。取1.0×106个细胞,添加400 μL结合缓冲液,加入10 μL Annexin V-FITC,室温避光孵育15 min。再加入5 μL PI染色液,混匀后室温避光孵育5 min。最后再加入100 μL结合缓冲液,混匀后置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡。
1.2.5Western blot检测蛋白表达:收集各组软骨细胞,加入含蛋白酶抑制剂的RIPA裂解液冰上裂解30 min,离心取上清即为提取总蛋白。加入适量5×Loading Buffer,置于沸水中煮10 min,进行SDS-PAGE凝胶电泳。转膜、封闭2 h,一抗分别为RUNX2(稀释度1∶1 000)、SFPQ(稀释度1∶1 000)、Beclin-1(稀释度1∶1 000)、LC3B(稀释度1∶1 000)、P62(稀释度1∶1 000)和细胞内参蛋白β-actin(稀释度1∶3 000),4 ℃孵育过夜。二抗为辣根过氧化酶标记的羊抗兔IgG和羊抗鼠IgG(稀释度1∶3 000),37 ℃孵育1 h。滴加ECL化学发光试剂,在全自动功能成像仪下显影。通过 Image J软件进行灰度值分析。
1.3 统计学处理
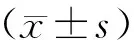
2 结果
2.1 P-15对HC-OA细胞中lncRNA NEAT1表达水平影响
通过RT-qPCR检测P-15对HC-OA细胞中NEAT1表达水平的影响,结果显示(图1A),与Control组相比,在P-15处理的软骨细胞中,lncRNA NEAT1的表达倍数显著降低(P<0.05)。P-15+siRNA NC组细胞NEAT1水平与P-15组差异无统计学意义(P>0.05)。相较于P-15+siRNA NC组,P-15+siRNA SFPQ组敲低SFPQ上调了细胞内游离的lncRNA NEAT1水平,但仍低于Control组(P<0.05)。为了揭示lncRNA NEAT1的定位(图1B),我们分离了HC-OA细胞的胞核、胞质RNA,以GAPDH为胞核Marker,U6为胞质Marker,RT-qPCR结果显示,lncRNA NEAT1同时存在于细胞核和细胞质中,细胞核分布更多。
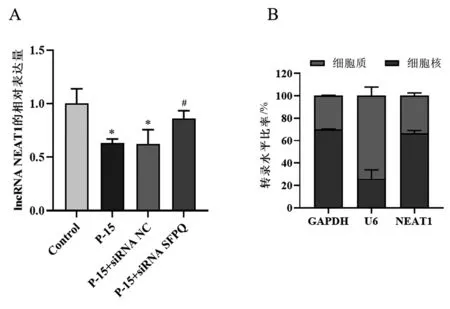
图1 P-15对HC-OA细胞中lncRNA NEAT1表达水平的影响Fig.1 Effect of P-15 on lncRNA NEAT1 expression in HC-OA cells注:A:P-15对HC-OA细胞中lncRNA NEAT1表达水平的影响;B:lncRNA NEAT1在HC-OA细胞核和细胞质中的表达情况。与对照组相比,*P<0.05;与P-15+siRNA NC组相比,#P<0.05。
2.2 P-15通过降低胞内lncRNA NEAT1水平抑制HC-OA细胞凋亡
流式细胞术检测细胞凋亡结果显示(图2),与Control组相比,P-15组软骨细胞凋亡率显著降低(P<0.05)。相较于P-15+siRNA NC组和P-15组,P-15+siRNA SFPQ组细胞凋亡率升高(P<0.05),但仍低于Control组,说明P-15可显著抑制HC-OA细胞的凋亡,而敲低SFPQ可部分恢复由P-15抑制的细胞凋亡。
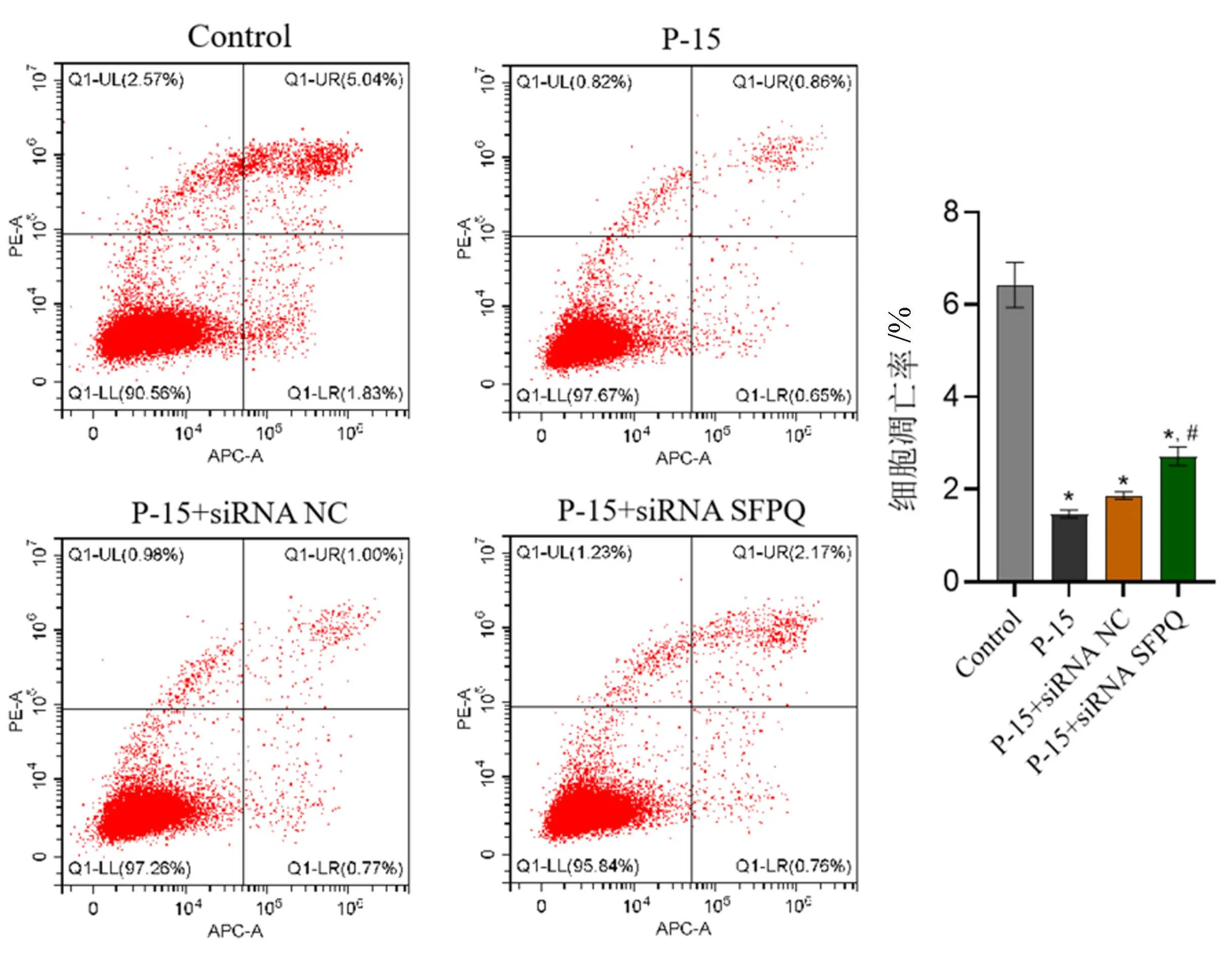
图2 P-15对HC-OA细胞凋亡的影响Fig.2 Effect of P-15 on apoptosis of HC-OA cells注:与对照组比较,*P<0.05;与P-15+siRNA NC组比较,#P<0.05。
2.3 P-15对lncRNA NEAT1/SFPQ/RUNX2通路的影响
通过Western blot检测检测P-15对HC-OA细胞RUNX2和SFPQ的表达的影响。结果显示(图3),与Control组相比,P-15处理后HC-OA细胞内的SFPQ蛋白表达增加,与之相反的是,RUNX2的表达受到明显抑制。siRNA NC不影响P-15对HC-OA细胞RUNX2和SFPQ的表达。相比于P-15+siRNA NC组和P-15组,siRNA SFPQ在可一定程度上促进RUNX2蛋白表达,说明P-15可通过上调SFPQ从而抑制RUNX2表达。
图3 P-15对HC-OA细胞lncRNA NEAT1/SFPQ/RUNX2通路的影响Fig.3 Effects of P-15 on lncRNA NEAT1/SFPQ/RUNX2 pathway in HC-OA cells注:与Control组相比,** P<0.01;与P-15+siRNA NC组相比,##P<0.01。
2.4 P-15通过调控lncRNA NEAT1/SFPQ/RUNX2轴对HC-OA细胞自噬的影响
通过检测P-15对HC-OA细胞中自噬相关蛋白Beclin-1,LC3B和P62等表达的影响。结果发现(图4),与Control组相比,P-15具有促进Beclin-1、LC3B Ⅱ/Ⅰ的表达,抑制P62表达。siRNA NC不影响P-15对HC-OA细胞内这3种自噬相关蛋白的表达。相比于P-15+siRNA NC组和P-15组,siRNA SFPQ可在一定程度上下调P-15诱导的Beclin-1和LC3B Ⅱ/Ⅰ蛋白过表达,并恢复P62的表达。
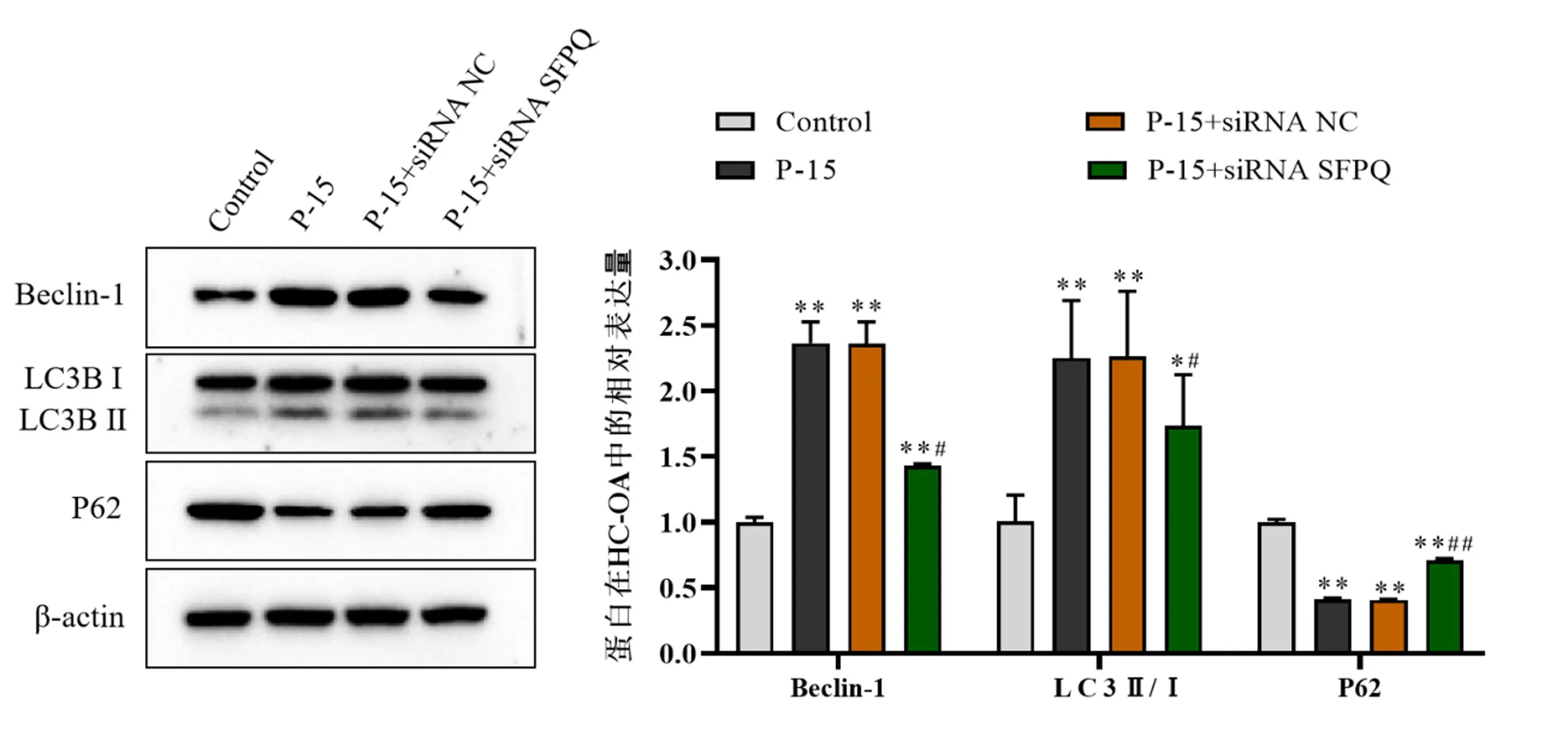
图4 P-15对HC-OA细胞中自噬相关蛋白Beclin-1、LC3II/I和P62的影响Fig.4 Effect of P-15 on Beclin-1, LC3B and P62 in HC-OA cells注:与对照组相比,*P<0.05,**P<0.01;与P-15+siRNA NC组相比,#P<0.05,##P<0.01。
3 讨论
在全球范围内,OA的发病率和死亡率正在上升,一些风险因素包括年龄、肥胖、遗传和关节损伤等都与OA的进展有关[11]。关节软骨中唯一存在的软骨细胞的异常增殖和凋亡在OA的发病过程中具有重要作用[12]。lncRNA RNA是疾病病理研究中的重要调节剂,参与OA中软骨细胞的增殖和凋亡、炎症反应和ECM合成,进而影响关节软骨的合成和分解代谢[13]。越来越多的研究证据表明lncRNA NEAT1在OA软骨中高表达,沉默NEAT1可增强OA-软骨细胞活性,诱导细胞自噬和减少细胞凋亡[14-15]。P-15是包含15个氨基酸序列的合成多肽,可诱导骨细胞和成骨细胞发生黏附、迁移、增殖和分化[16],其作为生物材料吸附于无机骨基质(ABM)促进骨相关融合手术中的骨化在临床应用中已得到验证[17]。然而目前P-15对HC-OA细胞的影响和机制尚不清楚。本研究通过体外培养HC-OA,发现P-15可降低胞内lncRNA NEAT1水平,提示P-15具有成为治疗OA药物的潜在价值。
lncRNA的作用机制与其亚细胞定位密切相关,核内lncRNA主要参与表观遗传和转录水平的基因调控,包括细胞核中的蛋白质调控;胞质内的LncRNA通过转录后调控间接影响基因表达,以及作为ceRNA与microRNA相互作用[18-19]。因此,确定lncRNA的定位是预测其功能的关键。本研究的结果显示,lncRNA NEAT1同时存在于HC-OA细胞质和细胞核中,且更多分布于细胞核,提示lncRNA NEAT1可能参与了蛋白调控。lncRNA NEAT1/SFPQ/RUNX2轴是细胞分子信息传递的途径之一,研究表明NEAT1可通过靶向SFPQ参与细胞调控[9]。因此,本研究进一步探讨lncRNA NEAT1/SFPQ/RUNX2轴是否参与P-15对HC-OA细胞的调控作用。结果显示,P-15处理HC-OA后,上调细胞中的SFPQ蛋白从而抑制RUNX2表达,而敲低SFPQ可部分恢复由P-15介导的RUNX2表达抑制和软骨细胞凋亡抑制,表明P-15可通过lncRNA NEAT1/SFPQ/RUNX2轴负调控RUNX2基因表达,抑制HC-OA细胞凋亡。此外,lncRNA NEAT1还可作为ceRNA靶向miR-543[20]、miR-193a-3p[21]等抑制软骨细胞增殖并促进细胞凋亡。本研究的结果显示lncRNA NEAT1在细胞质中也有分布,因此,P-15对OA软骨细胞损伤的保护作用是否还与NEAT1的ceRNA调控功能相关还有待进一步研究。
自噬(autophagy)是发生于真核细胞中的能够清除胞质内受损的细胞器、代谢产物,减轻细胞损伤[22]。LC3、Beclin-1和P62作为自噬相关蛋白,与自噬的发生发展密切相关[23]。LC3作为自噬的特异性标志性蛋白,自噬发生时LC3I会与磷脂酰乙醇胺(PE)结合而酶解形成LC3II,并使其进入脂膜中而形成自噬体。Beclin-1是对细胞自噬和凋亡均有调节作用的自噬基因,能够与凋亡相关蛋白Bcl-2结合而抑制自噬的发生。已有研究证实,OA的发生过程中常伴随软骨细胞中自噬水平下降,而自噬水平下降往往会造成细胞凋亡及线粒体功能障碍[24]。高久瑜等[25]在大鼠颞下颌关节炎模型中检测到软骨细胞自噬标志蛋白LC3Ⅱ表达减少,凋亡指标Caspase-3表达增多。细胞内适度的自噬利于细胞生存,因此通过提高软骨细胞自噬水平可能为OA治疗靶点之一[26]。已知lncRNA NEAT1能够通过激活自噬缓解OA,但P-15作用于lncRNA NEAT1的效果还尚不清晰[27]。本研究显示,P-15促进Beclin-1和LC3Ⅱ/Ⅰ的相对表达,抑制P62表达;敲低SFPQ可在一定程度上下调P-15诱导的自噬正调控蛋白过表达,并上调P62的表达,提示P-15通过调控lncRNA NEAT1/SFPQ/RUNX2轴诱导HC-OA细胞自噬。
综上所述,P-15可能通过调控lncRNA NEAT1/SFPQ/RUNX2轴,诱导HC-OA细胞自噬,下调细胞凋亡,缓解OA的发展,具有成为治疗骨关节炎药物的潜在价值。
