老年低能量胸腰椎压缩性骨折临床特征和维生素D营养状态分析
2024-01-12陈水绵郭庆昕庄跃玲饶华春郑国良柯晓斌吴志强林小明
陈水绵 郭庆昕* 庄跃玲 饶华春 郑国良 柯晓斌 吴志强 林小明
1.泉州市正骨医院检验科,福建 泉州 362000 2.泉州市正骨医院康复科,福建 泉州 362000 3.泉州市正骨医院脊柱科,福建 泉州 362000
老年人骨密度(bone mineral density,BMD)下降,骨脆性增加,老年脆性骨折发生率也呈逐年上升的趋势,是老年化人群的一个主要医疗问题。脆性骨折是骨质疏松(osteoporosis,OP)最严重的并发症,好发于脊柱、髋关节,其中胸腰椎压缩性骨折已成为老年人高死亡率、高发病率、慢性疼痛、住院和经济成本的主要原因。一项近10年中老年人群OP患病率的荟萃分析显示,我国中老年人OP患病率达19%~26%[1],老年人骨质疏松性椎体压缩性骨折发生率为10%~30%[2]。本研究通过对老年低能量胸腰椎压缩性骨折患者的临床特征和维生素D营养状态进行回顾性分析,为该疾病优势病种和重点学科建设提供支持和依据,同时也为后续指导临床诊疗骨折后的抗骨质疏松和预防骨质疏松性骨折提供有应用价值的参考信息。
1 资料与方法
1.1 研究资料
选取我院2018年1月至2022年12月因低能量(平地摔倒或轻微活动,如咳嗽/抬重物)等损伤,通过诊断性影像检查确诊为胸腰椎压缩性骨折,≥60岁的老年患者1 128例。排除标准:近1年内服用过影响骨代谢的药物(如氟化物、糖皮质激素、活性维生素D等);甲状腺相关疾病;结缔组织病;肿瘤史;合并其他部位骨折;严重肝肾功能异常;体内有金属置物等。根据中国老年学和老年医学学会,≥60岁定义为老年人,本文按年龄段划分为3组:60~69岁、70~79岁、≥80岁。
1.2 研究方法
1.2.125-羟基维生素D[25-hydroxyvitamin D,25(OH)D]测定:胸腰椎压缩性骨折后治疗前空腹抽取静脉血,分离出血清,采用德国罗氏诊断公司Cobas E602电化学发光免疫分析仪及配套试剂检测,使用校准品和质控品进行定标和质控。根据国际共识,血清25(OH)D<20ng/mL为维生素D缺乏,<10ng/mL为严重缺乏,20~30ng/mL为维生素D不足,>30ng/mL为维生素D充足[3]。
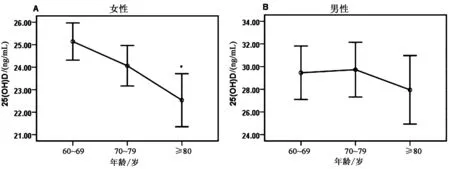
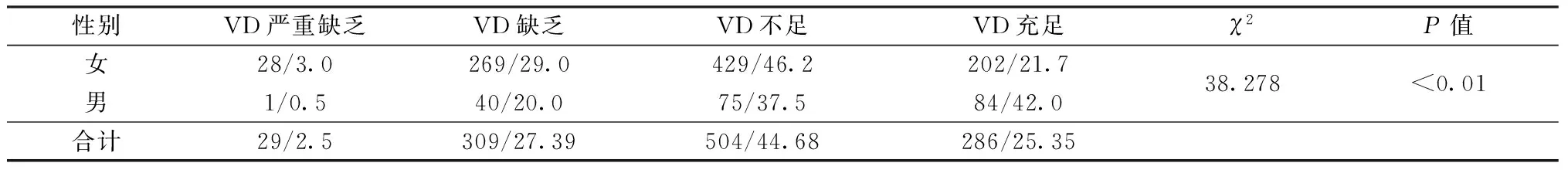
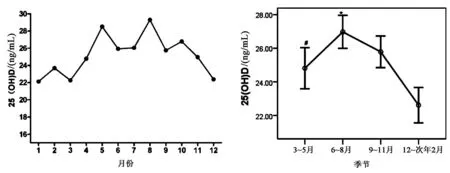
1.2.2BMD测定:采用美国Hologic公司ASY-00409双能X线吸收仪,以双能X线吸收法测定非优势部位股骨颈(femoral neck,FN)和腰椎L1-L4(lumbar spine,LS)BMD。参考WHO推荐的骨质疏松诊断标准:T值≥-1.0为骨量正常,-2.5 采用SPSS 22.0软件进行数据分析处理;计数资料用卡方检验进行分析;计量资料符合正态分布资料,以均数±标准差描述;两组间差异采用独立样本t检验;指定年龄、性别组间的比较采用单因素方差分析,采用曲线估计方法寻找BMD与25(OH)D水平的最佳拟合模型;根据年龄、性别调整,偏相关分析检测两者间的关系,骨质疏松、骨量减少或正常组的25(OH)D水平关系采用GLM方差分析;P<0.05为差异有统计学意义。 2.1.1临床资料:本研究纳入1 128例研究对象,其中男200例(17.73%),女928例(82.27%);平均年龄(72.57±7.75)岁,25(OH)D平均水平为(25.08±9.02)ng/mL,女性患者是男性的4.64倍。单椎体骨折896例(79.43%),多椎体骨折232例(20.57%);骨量正常6例(0.5%),骨量减少150例(13.3%),骨质疏松1 006例(89.18%)。本研究中共计1 475处椎体骨折,最常见为T12和L1,其次为L1、L2、L3、T11、T12,见图1。 图1 老年人胸腰椎压缩性骨折部位分布Fig.1 Distribution of thoracic and lumbar compression fractures in the elderly注:所有部位均包括多椎体骨折部位的拆分累加。 2.1.2不同年龄段胸腰椎压缩性骨折患者的临床特征:本研究结果显示,女性患者中≥80岁的25(OH)D水平与(60~69)岁差异有统计学意义(t=3.567,P=0.001),而男性患者各年龄段则无差异(见图2);随着年龄的增长,25(OH)D水平逐渐降低(F=5.258,P=0.005),而骨质疏松率则逐渐升高(χ2=26.767,P=0.000),见表1。年龄≥80岁患者骨量均发生不同程度的减少(100%)。 表1 不同年龄段胸腰椎压缩性骨折患者临床特征比较Table 1 Comparison of clinical features of patients with thoracic and lumbar compression fractures among different age 图2 不同性别组各年龄段胸腰椎压缩性骨折25(OH)D水平Fig.2 25(OH)D levels in different sex groups and ages with thoracic and lumbar compression fractures注:与60~69岁比较,*P<0.01。 2.2.1不同骨折类型25(OH)D营养情况分析:单椎体骨折与多椎体骨折两组患者的性别构成无显著性差异(χ2=0.981,P=0.337),多椎体骨折患者的年龄高于单椎体骨折患者[(74.36±7.27)岁 vs. (72.34±7.85)岁;t=2.057,P=0.04]。两种骨折类型患者的25(OH)D水平[(24.50±9.39)ng/mL vs. (25.23±8.93)ng/mL;t=1.103,P=0.270]相当。为去除年龄的混杂因素,根据不同年龄分层,两种骨折类型25(OH)D水平差异仍无统计学意义(t=0.409,P=0.683;t=0.556,P=0.578;t=1.596,P=0.111)。 2.2.2研究对象25(OH)D水平的分层比较:本研究中老年女性患者的25(OH)D水平低于男性[(24.18±8.42)ng/mL vs. (29.26±10.47) ng/mL),差异具有统计学意义(t=7.404,P<0.01)。1 128例研究对象中老年女性患者VD充足率只有21.7%(202/928),VD不足的比例达78.2%,其中VD缺乏占32.0%(297/928);VD缺乏的风险老年女性患者是男性的1.47倍,男性患者也有58%(116/200)表现为VD不足。见表2。 表2 老年胸腰椎压缩性骨折患者25(OH)D水平的分层比较(n/%)Table 2 Stratified comparison of 25(OH)D level in elderly patients with thoracic and lumbar compression fractures [n/%] 2.2.325(OH)D营养状态随季节变化的趋势性分析:统计结果显示,不同月份之间患者的性别构成、骨折类型无显著性差异(χ2=8.251,P=0.691;χ2=12.418,P=0.333),25(OH)D水平的差异具有统计学意义(F=6.488,P<0.01)。5年中的1月与4~11月,以及5月与1~4、9~12月,8月与1~4、6~7、9、11、12月之间的差异具有统计学意义(P<0.05)。从季节的划分,不同季节间存在显著性差异(P<0.05),夏季与秋季25(OH)D整体水平相对高,冬季是缺乏的高发季节。见图3。 图3 老年胸腰椎骨折患者25(OH)D营养状态随季节变化曲线Fig.3 Seasonal variation of nutritional status of 25(OH)D in elderly patients with thoracic and lumbar vertebral fractures注:与其他3个季节比较,*P<0.05:与夏季比较,#P<0.05。 在调整年龄、性别的影响因素后,对25(OH)D与BMD的T值进行偏相关性分析显示,25(OH)D与腰椎及股骨颈的T值均呈正相关,其中股骨颈与T值的相关性大于腰椎(r=0.114,P<0.01 vs.r=0.073,P=0.015)。为了更好地描述25(OH)D与BMD的T值之间的关系,本研究采用了曲线估计来选择最佳拟合模型。在适用于包含负值的模型中,即线性模型、二次项模型、三次项模型、对数模型、逆模型,以三次项模型拟合最佳,25(OH)D与腰椎和股骨颈BMD的R2分别为0.012~0.018和0.033~0.040。具有代表性的曲线见图4。 图4 25(OH)D与BMD(T值)立方模型拟合曲线Fig.4 25(OH)D fit curve to BMD (T) cubic model 此外,本研究还根据腰椎和股骨颈的T值,将所有参与者分为骨质疏松组、骨量减少组和正常组,比较了不同亚组与25(OH)D的血清水平。在控制了年龄和性别为协变量后,GLM-方差分析显示,FN不同亚组的25(OH)D水平有显著性差异(P<0.01),且骨质疏松组女性的25(OH)D显著低于正常组。见表3。 表3 骨质疏松、骨量减少或正常组中血清25(OH)D的GLM-方差分析Table 3 Seasonal variation of nutritional status of 25(OH)D in elderly patients with thoracic and lumbar vertebral 维生素D长期以来被认为是骨骼健康的重要评估指标之一,亚洲地区VD的缺乏或不足表现较为明显[4]。骨骼肌是VD的重要靶器官,VD受体主要位于快速收缩肌纤维上;同时,VD减少,骨骼肌细胞摄取Ca2+不足,影响细胞代谢,有研究显示老年的VD缺乏与肌肉无力和跌倒风险增加有关[5]。因此,VD对维持人身体平衡,避免摔倒造成低能量脆性骨折有重要作用。另外,VD缺乏可加重OP,并且会影响抗骨质疏松药物的疗效。25(OH)D是体内VD的主要储存形式,半衰期2~3周,浓度高及稳定,主要来源于皮肤的合成,是骨代谢的重要标志物之一,是客观评价机体VD营养状态的最佳指标。一项目对中国老年人群10 696例大样本研究发现[6],60岁以上老年人25(OH)D水平普遍偏低,VD状况处于严重缺乏。中国老年骨质疏松诊疗指南指出,VD与BMD和骨折有密切相关[7]。 本病例集1 128例≥60岁的老年胸腰椎压缩性骨折患者,以女性患者为主要群体,且女性25(OH)D水平明显低于男性(P<0.01)。本研究结果显示,椎体骨折部位主要集中在L1、L2、L3、T11、T12,与Burns等[8]报道一致。这与脊柱正常生理弯曲,胸腰椎交接处正好是胸椎后凸和腰椎前凸两个相反弧度交汇点,承受折弯及轴向剪式应力大有关。 本研究结果显示,超过3/4(78.2%)的老年女性胸腰椎压缩性骨折存在VD不足,其中VD缺乏占32.0%,男性患者中也有1/2以上(58.0%)的比例存在VD不足。2019年相关流行病学显示[9],我国女性骨质疏松低知晓率(7.0%),且发病率(≥50岁占32.1%)显著高于欧美国家,这与我国女性初潮年龄、绝经时间、妊娠次数等有关[10]。随着年龄的增长,25(OH)D水平逐渐降低(F=5.258,P=0.005),骨质疏松率随之升高(χ2=12.322,P=0.002),与范吉星等[11]研究结论一致。国外文献[12]报道,25(OH)D水平不足≥5年,会增加骨质疏松性骨折的10年风险。 本研究结果显示,多椎体骨折患者的年龄高于单椎体骨折患者,但单椎体和多椎体骨折患者的25(OH)D水平相当。排除年龄因素的影响,根据不同年龄分层,两种骨折类型25(OH)D水平差异仍无统计学意义(t=0.409,P=0.683;t=0.556,P=0.578;t=1.596,P=0.111)。可能本次研究中多椎体与单椎体病例数相差悬殊有关,理论上推断,25(OH)D水平越低,发生多椎体骨折的概率越大。 人体90%以上的VD由皮肤经紫外线照射后合成,其合成效率取决于季节、纬度、日照时间等。本研究显示,福建地区沿海,冬季日照时间短,气温低风大,春节梅雨季节,6~7月高温酷暑,人们户外活动减少;而夏季太阳辐射大,日照时间长,春夏及冬夏交接月份(5月、8月)气候宜人,人们户外活动明显增多。因此,本病例集VD整体水平为夏季>秋季>春季>冬季,其中5、8月VD整体水平明显高于其他月份,而1月份VD缺乏最为明显。提示,对于老年胸腰椎压缩性骨折进行VD的补充,要充分考虑当地的月份、季节,调整个性化的合理剂量并及时监测。 BMD检测被认为是OP脆性骨折的最佳预测指标,但本研究始终基于充分的临床评估和实验室检查。本研究显示,25(OH)D与腰椎及股骨颈BMD的T值均呈正相关,且股骨颈的相关性明显大于腰椎(r=0.114,P<0.01 vs.r=0.073,P=0.015),与张良明等[13]报道一致。同样有研究指出[14],25(OH)D水平与BMD的下降有明确的关系。另外,分析骨质疏松、骨量减少和正常3个不同亚组间25(OH)D水平的差异,FN的不同亚组的25(OH)D有显著性差异(P<0.01),而在LS不同亚组的25(OH)D呈升高趋势,但未出现显著性差异,说明FN部位BMD的T值对VD水平的预测敏感性高于LN部位。老年人腹主动脉钙化进行性加重,腰椎骨质增生退行性改变,导致测量的腰椎BMD偏高,因此强烈推荐同时检测股骨近端[15]。国内外研究也表明[16-17],股骨颈的BMD更能真实地反映老年人骨质情况,髋部骨密度比腰椎更具有预测骨折风险的价值。加拿大一临床实践指南报道[18],≥50岁有髋关节或椎体脆性骨折以及有一次以上脆性骨折均为绝对骨折高风险患者,均应接受药物治疗,同时建议的生化检测除常规的骨代谢标志物外,还包括25(OH)D水平。充足的钙与VD的摄入对于预防OP至关重要,进而降低全身骨折风险[19]。 综上所述,VD在评估个体无论是骨质疏松治疗还是预防骨质疏松、跌倒等和治疗监测方面均具有一定价值。在老年胸腰椎压缩性骨折综合管理中,建议根据BMD评估骨量正常、减少或疏松的类别用于指导治疗方案,再结合季节、年龄、性别等因素差异,调整VD对肌肉、骨骼和其他健康益处的最佳每日剂量,建立个体化的合理治疗方案并进行疗效监测。1.3 统计学分析
2 结果
2.1 胸腰椎压缩性骨折临床特征

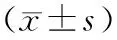
2.2 胸腰椎压缩性骨折25(OH)D营养情况分析
2.3 25(OH)D与BMD之间的关系

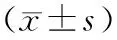
3 讨论
