基于孟德尔随机化分析肠道菌群与骨密度的因果关系
2024-01-12马玮玮陈虹谷李彤彤熊勇李瑛
马玮玮 陈虹谷 李彤彤 熊勇 李瑛*
1.湖北中医药大学,湖北 武汉 430061 2.江苏大学附属医院,江苏 镇江 212000
骨质疏松症(osteoporosis,OP)是一种以骨量减少、骨小梁缓慢流失和骨密度损失为特征的全身性代谢骨疾病[1]。流行病学调查研究显示,目前全球有超过2亿人受到OP的困扰,中国50岁以上人群中OP患病率高达19.20%[2],预计随着全球人口老龄化的加重,未来这一数字将继续扩大[3]。肠道菌群(gut microbiota,GM)作为人体内重要的微生态系统,与人体健康息息相关。随着肠道菌群在骨代谢领域研究的深入,有学者提出“肠-骨”轴理论[4-5],指出肠道菌群在人体骨代谢过程中发挥重要作用。近年来的研究表明肠道菌群通过调节激素和免疫功能影响人体营养物质的吸收与代谢,从而对人体骨代谢进行调节[6-7]。基于肠道菌群相关研究,饮食干预、益生菌补充和微生物群移植被用于OP的治疗[8-9]。但上述研究多是临床观察性研究的结果,可能受到各种偏倚和混杂因素的影响以及反向因果的干扰。
孟德尔随机化(mendelian randomization analysis,MR)是利用遗传变异作为工具变量来识别危险因素与疾病之间因果关系的有效方法[10-11]。孟德尔的独立分配法则表明遗传变异是彼此独立的,它们通常不受其他因素或混杂变量的影响。因此,MR研究中的关联性比随机化临床试验(randomized clinical trial,RCT)结果更可靠[12]。本研究利用来自全基因组关联研究数据(genome-wide association studies,GWAS)的公共数据进行双样本MR分析以探讨GM与骨密度(bone mineral density,BMD)之间的关系。
1 资料与方法
1.1 研究设计
本研究选择GM作为暴露因素,选择与GM相关的单核苷酸多态性(single nucleotide polymorphism,SNPs)作为工具变量(instrumental variables,IVs)。骨密度在临床实践中被广泛用作骨质流失的可测量和强预测指标,被用作结果变量。使用双样本MR分析的方法对GM与BMD进行孟德尔随机化分析,并利用Cochran’s Q与MR Egger法检验评估异质性与水平多效性,最后进行敏感度分析来验证结果的稳定性。
MR分析需要满足3个条件假设[13]:①IVs与暴露因素之间存在很强的关联性;②IVs在暴露和结果的关联性上不存在混合因素,即不存在遗传多态性;③IVs对结果没有直接影响,只能通过暴露因素影响结果。见图1。
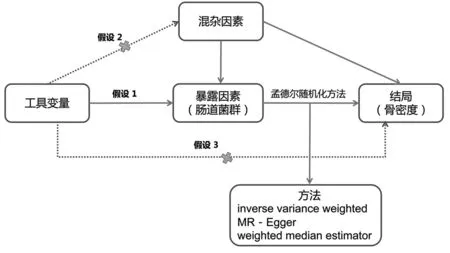
图1 两样本孟德尔随机化模型示意图Fig.1 Schematic diagram of two sample Mendelian randomization models
1.2 数据来源
本研究通过英国布里斯托尔大学(University of Bristol) 的IEU GWAS数据库 (https://gwas.mrcieu.ac.uk/terms/)分别获取GM和BMD的GWAS。其中GM数据来自于MiBioGen联合会的一项研究,分析了18 340名参与者的宿主基因型和16S粪便菌群rRNA基因测序剖面[14]。在这项GWAS研究中检查了211个GM分类群(从属到门级别),最终确定了与9个门、16个纲、20个目、35个科和131个属相关联的肠道菌群遗传变异[14]。本研究使用的BMD数据来自于一项大规模GWAS荟萃分析的总体水平数据,该分析中包括30个项目研究和66 628名参与者(其中56 284名参与者为欧洲血统),其中全身骨密度(total body BMD,TB-BMD)通过DXA进行测量(以g/cm2为单位)[15]。TB-BMD的SNPs已经通过线性回归模型进行协变量校正(年龄、体重、身高等)[15]。
1.3 工具变量选择
为了满足第一个关键假设,即相关性假设,IVs应该与暴露因素具有显著相关[16]。本研究通过GWAS数据集在全基因组水平(P<1×10-8)上确定与GM相关的SNPs[17]。随后,通过连锁不平衡(linkage disequilibrium,LD)聚类获得暴露的独立SNPs,聚类阈值为R2<0.1,等位基因距离大于500 kb[18]。然后从GWAS数据集中提取与BMD相关的SNPs及其相应的统计数据,同时排除MAF低于0.01的SNPs[19]。仅考虑分析中具有关联估计的遗传变体,未使用代理变量。此外,通过删除所有回文SNP,数据得到协调[20]。为了满足第二个MR假设,即独立性假设,笔者使用PhenoScannerV2数据库(http://www.phenoscanner.medschl.cam.ac.uk/)研究每个IV及其代理特征,并在R2>0.80的阈值上去除和混杂因素相关的SNPs[21]。
1.4 孟德尔随机化分析
本研究中主要采用逆方差加权法(inverse variance weighted,IVW)、MR-Egger回归和加权中位数法(weighted median estimator,WME)进行MR分析。在满足所有SNP都是有效的工具变量的假设下,IVW方法能提供最为准确的效应估计值[22]。MR-Egger回归可以检测和调整多效性,但这种方法产生的估计精度非常低[23]。加权中位数基于至少50%的IVs是有效的假设,给出准确的估计结果[24]。由于IVW法比其他两种方法检验效能更高,因此本研究采取IVW法作为主效分析[24]。
1.5 敏感性分析
留一法通过逐个剔除某个工具变量来探讨是否存在单个SNPs驱动因果关联,如果剔除单个SNPs后对MR分析影响较大,则表明MR分析受单个工具变量的干扰。其次,MR-Egger截距用于评估IVs与其他潜在混杂因素间的多效性关系,确保选择的IVs不会通过除暴露因素以外的途径影响结局变量。若MR-Egger截距分析表明存在明显的统计学意义(P<0.05),则表明存在水平多效性[25]。最后,本研究还使用Cochran’s Q 统计量来进行异质性检验。若Cochran’s Q 统计量检验具有统计学意义(P<0.05),则证明分析结果具有显著的异质性[26]。
1.6 统计学分析
本研究使用RStudio软件中的TwoSampleMR包进行数据分析,结果用β值以及相应的95%置信区间(confidence interval,CI)来解释GM对BMD的影响,P<0.05表示差异有统计学意义。
2 结果
2.1 孟德尔随机化结果
首先,确定与肠道菌群在门、纲、目、科和属水平上相关的SNPs,经过一系列的质控步骤,选出的IVs进行孟德尔随机化研究,IVW结果表明巴氏杆菌属(OR=1.07,95%CI:1.02~1.13,P=0.01)、乳链球菌属(OR=1.04,95%CI:1~1.08,P=0.01)、瘤胃球菌科UCG002(OR=1.06,95%CI:1~1.13,P=0.03)和瘤胃球菌科UCG005(OR=1.06,95%CI:1~1.12,P=0.03)可能是骨密度的保护性因素。但戈登氏杆菌属(OR=0.96,95%CI:0.93~0.99,P=0.01)、草酸梭菌属(OR=0.96,95%CI:0.92~0.99,P=0.01)和泰瑟氏菌属(OR=0.95,95%CI:0.92~0.99,P=0.02)可能为骨密度潜在危险性因素,同时可能存在未知肠道菌群对骨密度造成潜在威胁(OR=0.94,95%CI:0.92~1.00,P=0.002),见图2。同时也运用MR-Egger回归和加权中位数法对肠道菌群与骨密度之间的关系进行分析,见表1。
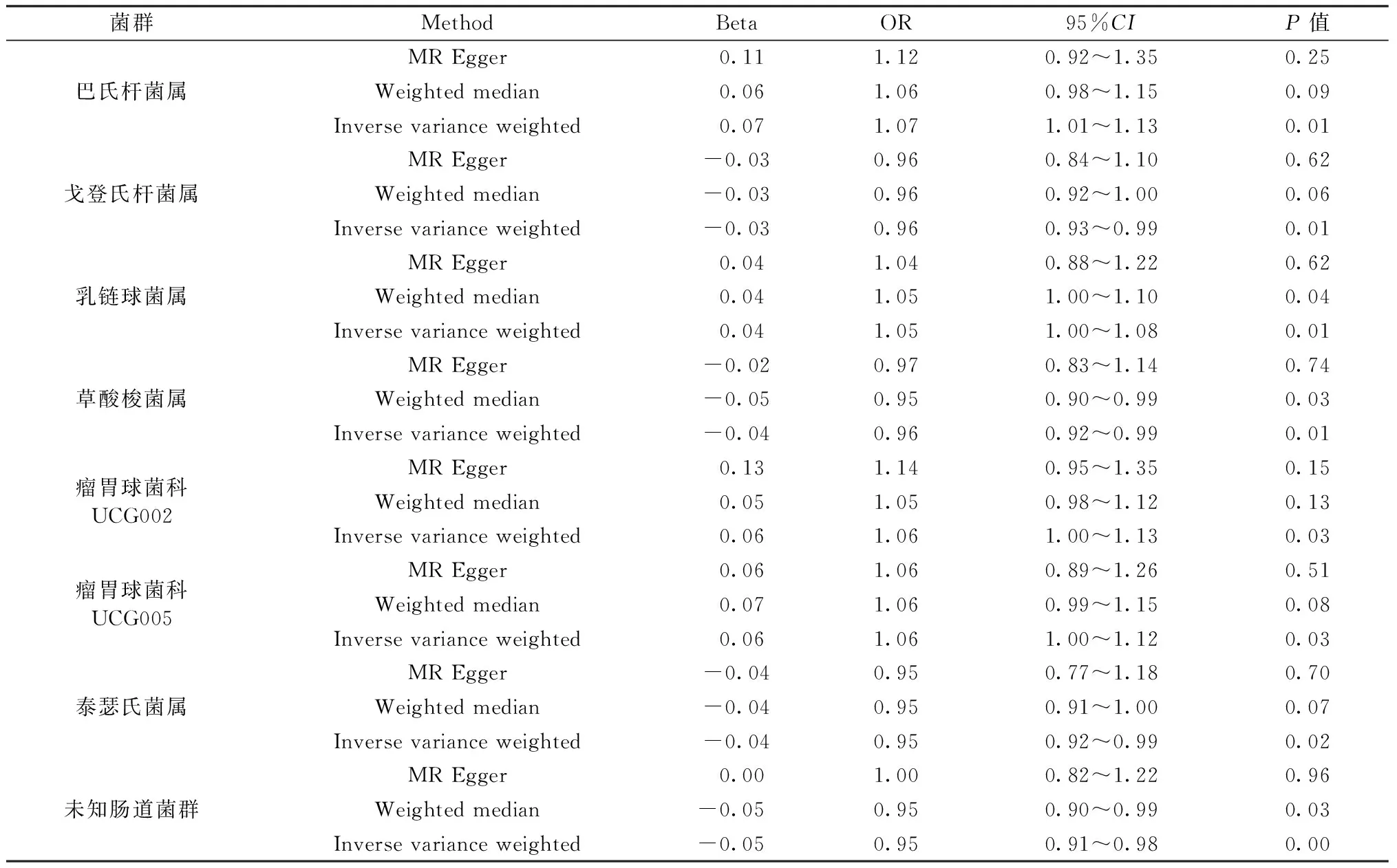
表1 与BMD具有显著相关性的肠道菌群MR效应值Table 1 MR effect values of gut microbiota with significant correlation with BMD
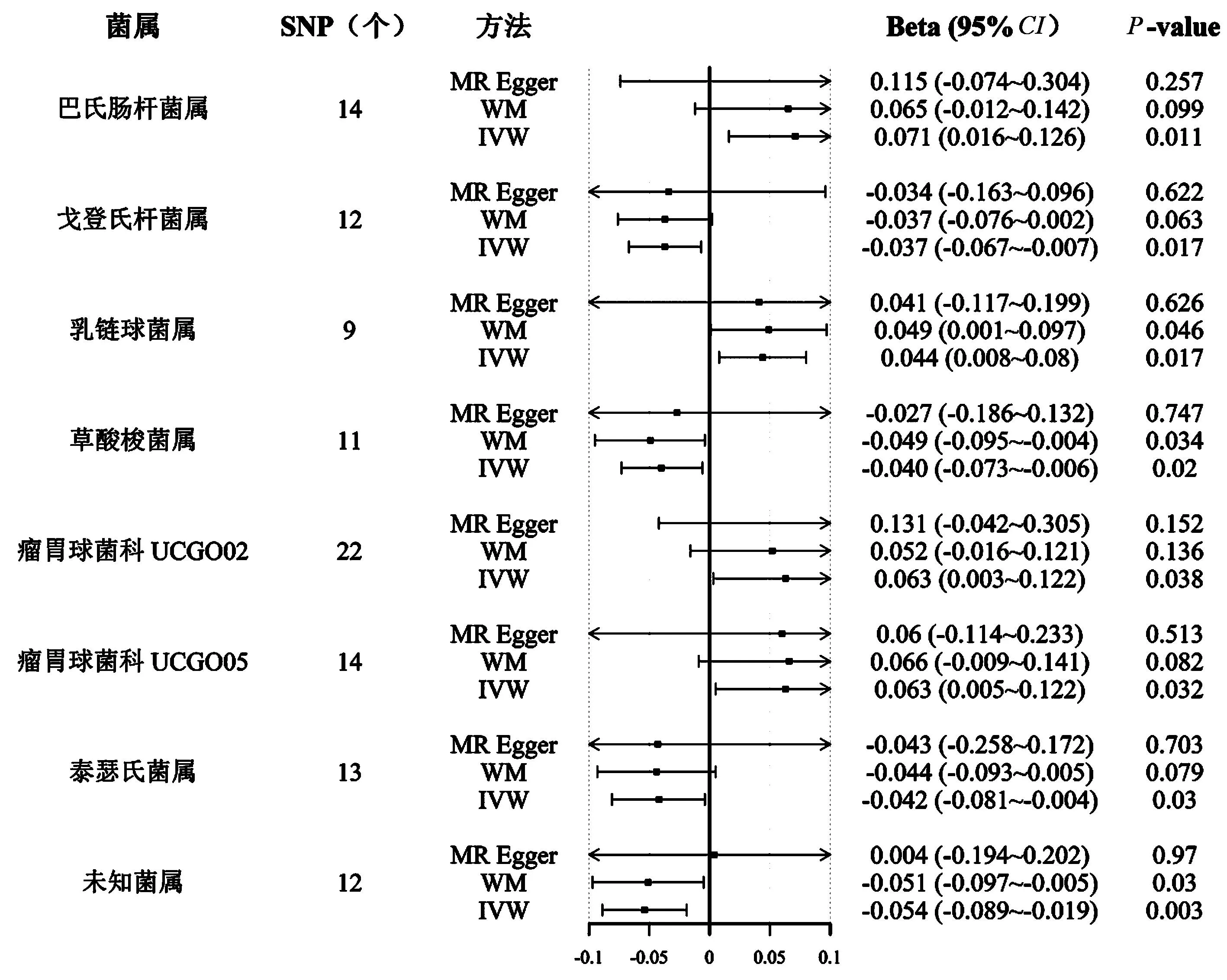
图2 与BMD具有因果联系的肠道菌群效应值森林图Fig.2 Forest map of gut microbiota effect values with causal relationship with BMD
2.2 敏感性分析
Cochran’s Q和MR-Egger回归法结果表明本研究不存在显著的异质性和多效性(表2)。留一法结果显示在逐一剔除SNP后,结果并没有发生改变。这些分析在一定程度上证明了本研究结果的稳健性。
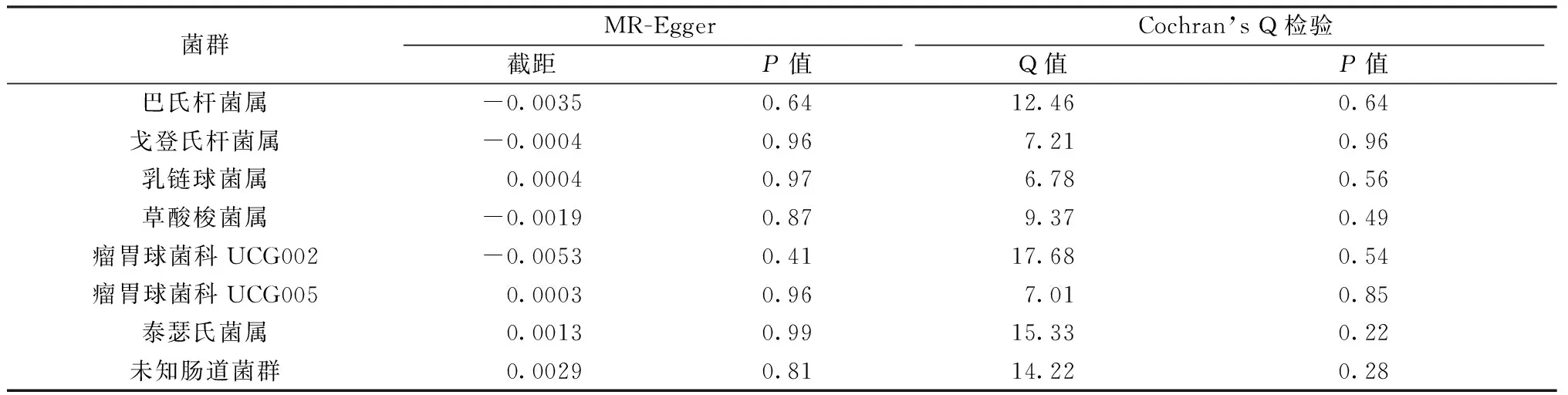
表2 敏感性分析结果Table 2 Sensitivity analysis results
3 讨论
本研究旨在探讨肠道菌群是否与骨密度之间存在因果联系,通过孟德尔随机化全面评估了211种肠道菌群(从门到属的级别)对骨密度的因果效应,结果显示某些肠道菌群与骨密度之间存在因果联系,这些结果表明肠道菌群可能是骨密度的重要影响因素,同时也意味着肠道菌群在骨质疏松症发病过程中发挥了重要作用。
大量的临床观察性研究表明GM同BMD之间存在联系,这与本研究结果是一致的[27-31]。在人体中肠道菌群主要为厚壁菌门和拟杆菌门,占肠道菌群相对丰度的90%以上,其次是放线菌门、变形菌门、联合菌门、梭菌门等[32]。骨骼是一个不断进行骨形成和骨吸收的动态器官,这两个过程是骨代谢的主要活动。骨细胞在体内进行新陈代谢,参与各种骨骼组织的生理和病理过程。在细胞层面,骨细胞之间的相互作用对于骨骼的形态起着关键作用。破骨细胞和成骨细胞是骨代谢的关键组成部分,而骨代谢失衡可引发骨质疏松症。因此,骨稳态需要保持骨代谢的平衡。平衡的骨代谢对于维持钙、磷等矿物质的代谢平衡以及骨密度和骨强度具有重要的积极作用。随着对肠道菌群研究的不断深入,其与骨代谢的关系也得到了更多关注。
目前研究还没有完全确定GM与BMD之间的作用机制,但以往的一些研究探讨了GM和BMD之间可能存在的几种机制:①肠道菌群可以影响雌激素代谢调控骨代谢。正常情况下,雌激素作为肠肝循环产物需要经肠道菌群作用后才能重新进入内循环。当肠道菌群失衡时,肠肝循环减弱,机体内雌激素重吸收能力下降,加速体内骨质的流失与骨质疏松症的病程[33-34]。②肠道菌群通过炎症因子影响骨代谢。炎症反应引起局部的免疫细胞浸润,释放多种炎症因子,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-17(interleukin-17,IL-17)等,这些炎症因子可通过多种机制影响骨细胞的代谢和功能[35-36]。当人体内肠道菌群失衡后可刺激肠道内的炎症反应,导致IL-6和TNF-α等炎性因子大量释放,在促进破骨细胞活性的同时也抑制成骨细胞的形成和功能,最终加剧骨代谢的失衡。③肠道菌群可以通过改善肠道健康来促进钙的吸收和利用。维生素D是维持骨内稳态的重要物质之一[37],当体内钙摄入不足时,肠道菌群中的细菌可以产生活性维生素D,从而促进肠道对钙的吸收[38]。肠道菌群对于肠道黏膜的健康和完整性至关重要,它们可以帮助维持肠道屏障的完整性,预防肠道炎症和渗漏。当肠道屏障受损时,会导致肠道对钙的吸收和利用降低,从而影响骨内稳态[39]。
尽管有大量临床研究表明肠道菌群失调与骨质流失存在相关性,但这可能只是骨质疏松患者的临床体征,并不能表明肠道菌群与骨密度之间存在因联系。首先,正如前文所说RCT可能受到混杂因素和反向因果等因素影响,同时部分研究结果是通过动物实验获得的,与人体内肠道菌群的构成存在差异,这些影响结果的可信度。其次,由于不同研究中受试者性别比例、环境、种族和饮食结构的不一致,可能导致肠道菌群的组成存在差异而影响到研究结果的准确性。最后,尽管有研究表明骨质疏松症患者存在肠道菌群失衡的表型,但对于特定菌株变化的结果并不一致。这些不确定因素的存在阻碍对肠道菌群与骨质疏松症风险之间因果关系的推断。本研究与以往观察性研究不同的是利用孟德尔随机化研究为证明“肠-骨”轴理论提供了一种新的方法。一方面,孟德尔随机化研究减少了混杂因素与反向因果的影响,极大地提高了研究结果的准确性;另一方面,在研究者方面笔者主要使用欧洲人群数据,将研究参与者限制为欧洲血统,能够最大程度减少环境、种族和饮食结构等差异造成的结果偏倚。最重要的是,肠道微生物群的遗传变异是从最大的可用GWAS荟萃分析中获得的,这种大样本量优势确保了MR分析中IVs的强度以及研究结果的稳健性。
虽然本研究提供了有价值的见解,但这项研究也存在一些局限性,在解释结果时应注意。首先,孟德尔随机化通常仅考虑一个或两个变量。但实际情况往往非常复杂,还可能有其他变量或交互作用会影响实验结果。其次,本研究使用的全基因组关联研究汇总数据库并缺乏个体层面数据,限制了进行按年龄、性别、疾病持续时间、治疗和疾病类型等变量进行亚组分析的能力。这使得在亚组之间比较因果效应的差异变得困难。因此,孟德尔随机化虽然是一种常用的实验设计方法,但也有其局限性。在实际应用中,需要结合实际情况,综合考虑多种因素,以确保实验结果的可靠性。
综上所述,本研究采用了孟德尔随机化分析来探讨肠道菌群与骨密度之间的因果关系。研究结果显示二者存在因果联系,提示在临床骨质疏松症治疗中需关注对肠道菌群的调节。
