淫羊藿总黄酮联合骨营养剂抗骨质疏松作用探讨
2024-01-12张冬雪曲帅王明月苏丽丽徐晨阚鸿董凯
张冬雪 曲帅 王明月 苏丽丽 徐晨 阚鸿* 董凯*
1.吉林农业大学中药材学院,吉林 长春 130118 2.吉林省生物研究所药用真菌研究室,吉林 长春 130012
骨质疏松症是一种代谢性骨骼疾病,其特征是骨密度降低和微观结构破坏导致骨折风险增加[1]。常见的骨质疏松症类型包括原发性、继发性和老年性[2]。原发性骨质疏松症又称绝经后骨质疏松症,可能由雌激素缺乏引起破骨细胞活性增强,同时骨形成与骨吸收之间不平衡导致骨质流失[3]。激素疗法一直用于预防和治疗绝经后骨质疏松症[4]。然而,长期服用激素会增加心血管疾病和静脉血栓栓塞的风险[5]。因此,从天然植物中挖掘安全高效的功能性组分改善骨质疏松已成为当前重要的研究方向。
骨营养剂氨基葡萄糖和硫酸软骨素具有软骨保护作用,可以预防和改善关节损伤,但两者联用治疗骨质疏松时,存在起效较慢、用药剂量大、服用周期长等问题[6]。淫羊藿总黄酮能够刺激成骨细胞骨形成和减少破骨细胞骨吸收,激活骨重建,是预防或治疗与雌激素缺乏相关的骨质疏松症的有效药物[7-9],氨基葡萄糖-硫酸软骨素组合与淫羊藿总黄酮在治疗骨质疏松方面是否存在协同增效作用,尚未见报道。
研究发现,骨质疏松的发生发展受多种通路影响,其中PI3K/AKT信号通路是参与炎症反应、细胞增殖、分化、凋亡及调控骨代谢过程的关键通路[10-11]。Toll样受体4(TLR4)是PI3K/AKT信号通路的上游因子,能够介导骨髓细胞产生炎症因子作用于骨代谢[12]。本研究通过建立骨质疏松大鼠模型探讨骨营养剂氨基葡萄糖-硫酸软骨素与淫羊藿总黄酮是否可以通过激活TLR4/PI3K/AKT信号通路发挥协同治疗作用。
1 材料与方法
1.1 材料
40只雌性SD大鼠,质量180~220 g,购自长春亿斯实验动物有限公司,动物许可证号:SCXK(吉)-2020-0001,符合吉林农业大学实验动物伦理委员会规定;淫羊藿原药材购于长白山淫羊藿种植基地;氨基葡萄糖(M-AT-1904020),浙江金壳药业有限公司;硫酸软骨素(HS1904270),嘉兴恒杰生物制药有限公司;注射用青霉素钠(F9027101),华北制药股份有限公司;戊酸雌二醇片(469A);三溴乙醇(LAT20220815),北京莱艾特科技发展有限公司;血清Ca测试盒(N802280G)、血清P测试盒(N802280P),上海酶联生物科技有限公司;碱性磷酸酶(alkaline phosphatase,ALP)、骨保护素(osteoprotegerin,OPG)、骨钙素(osteocalcin,BGP)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)、肿瘤坏死因子-α(TNF-α)和白介素10(IL-10)检测试剂盒(11/2022),上海纪宁实业有限公司。
1.2 实验方法
1.2.1淫羊藿总黄酮提取物的制备:参照文献[13]中的提取工艺,取淫羊藿叶50 g,加入15倍量的60%乙醇,预浸30 min,70℃回流提取2次,合并滤液,使用大孔树脂D100对提取液进行纯化,调整上样液浓度为1 mg/mL,6倍柱体积(BV)水除去糖类,5 BV 25%乙醇除去非黄酮类杂质,4 BV 60%乙醇洗脱黄酮类化合物,流速为3 BV/h。洗脱液冻干后得淫羊藿总黄酮提取物干粉,经紫外分光光度法在270 nm波长处测定吸光度值,测得淫羊藿总黄酮含量为80%。
1.2.2造模、给药及处理:实验大鼠Sham组仅切除腹腔少量脂肪,其余各组大鼠切除双侧卵巢。术后腹腔注射青霉素预防感染。药物溶解在0.5%羧甲基纤维素钠中配成混悬液。Sham组和OVX组灌胃生理盐水;T组给药500 mg/kg[14],EV组给药0.1 mg/kg[15],TG组给药硫酸软骨素125 mg/kg,氨基葡萄糖150 mg/kg,淫羊藿总黄酮250 mg/kg(给药量按人体推荐剂量的10倍折算);灌胃体积10 mL/(kg·d)。每周称量体重并按体重调整灌胃量,连续给药8周。实验结束后,麻醉后颈脱位对所有大鼠进行安乐死,收集股骨和血液样本。
1.2.3血清生化指标:采用ELISA试剂盒检测血清ALP、TRAP、OPG、BGP、TNF-α和IL-10水平,微量法测定血清Ca和血清P浓度。
1.2.4骨密度测定:采用Micro-CT仪器对大鼠左侧股骨进行扫描,并定量分析骨小梁指标参数。主要测量参数指标包括骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)、骨小梁数(Tb.N)、骨表面积密度(BV/TV)和骨质疏松指数(SMI)。
1.2.5骨生物力学测定:采用万能材料力学试验机检测左胫骨,记录受试骨组织断裂前的最大弯曲力及最大弯曲变形,计算弯曲刚度,弹性模量及弯曲应力参数。
1.2.6骨组织病理学检查:对大鼠右股骨进行苏木精-伊红染色(HE)和抗酒石酸酸性磷酸酶(TRAP)染色,观察股骨的病理学变化和破骨细胞生成情况。
1.2.7免疫组织化学分析:取右股骨进行TLR4、PI3K及AKT免疫组化染色观察。图像结果采集后使用Image-J软件对阳性染色的细胞进行定量,用光密度(AOD)表示。
1.2.8实时荧光定量PCR技术(qRT-PCR)检测蛋白mRNA相对表达水平:取100 mg股骨组织,首先使用Trizol法提取总RNA,逆转录获得c DNA,并以c DNA为模板进行PCR扩增。反应体系(共20 μL):SYBR荧光染料10μL,上、下游引物各2μL,c DNA模板4μL,无核酸酶水2μL。反应条件:93℃预变性5 min,95℃变性2 min,75℃退火40 s,60℃延伸60 s,循环45次,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用2-△△Ct法计算各目标基因mRNA相对表达水平。引物序列见表1。

表1 引物序列信息Table 1 Primer sequence information
1.3 统计学分析
实验结果以平均值±标准差表示,用 Graphpad prism 8.0统计分析软件进行数据处理,通过单因素方差分析评估各组间的平均差异,P<0.05代表差异具有统计学意义。
2 结果
2.1 大鼠体重和子宫湿重分析
卵巢摘除能够导致体内的雌激素水平下降。与Sham组相比,手术摘除卵巢的各组大鼠血清中雌二醇水平明显降低(P<0.05),见图1A。与Sham组相比,所有处理组的大鼠体重均明显升高,这是因为卵巢摘除导致大鼠腹部形成脂肪堆积,引起体重增长,而EV组、T组和TG组大鼠体重均小于OVX组,见图1B。此外,与 Sham 组相比,各实验组大鼠子宫明显变小,重量减轻4倍以上(P<0.05);与OVX组相比,给药后大鼠子宫有所改善,子宫湿重明显增加(P<0.05);与T组相比,TG组子宫湿重增加显著(P<0.05),见图1C。
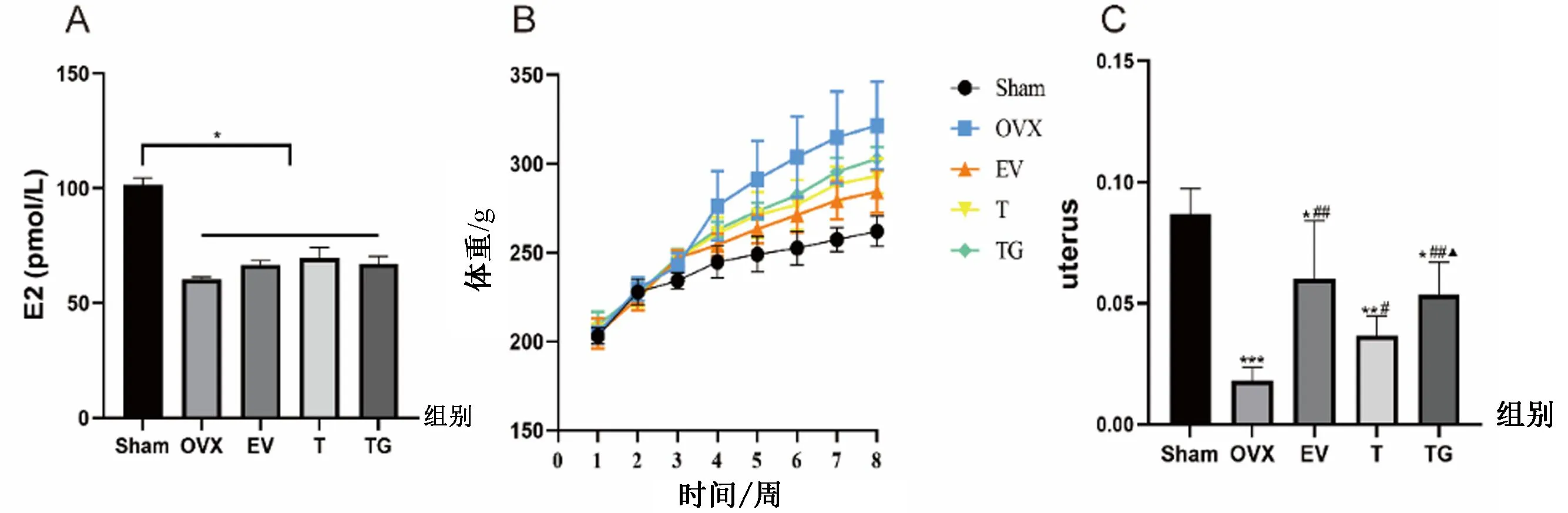
图1 各组大鼠血清雌二醇(A)、体重(B)、子宫湿重(C)变化Fig.1 Changes of serum estradiol (A), Weight changes (B), Changes of wet weight of the uterus (C) in rats in each group注:与Sham组相比,***P<0.001,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
2.2 血清生化指标
2.2.1大鼠血清矿物质水平比较:由图2可知,与Sham组相比,OVX组血清P浓度显著升高(P<0.001),血清Ca浓度显著降低(P<0.001);与OVX组相比,EV组、T组和TG组血清P浓度明显降低(P<0.05),Ca浓度明显升高(P<0.05);与T组相比,TG组血清Ca和P浓度呈显著性变化(P<0.05)。

图2 各组大鼠血清矿物质P (A)、Ca(B)水平变化(n=7)Fig.2 Changes of serum mineral P (A) and Ca (B) levels in rats of each group (n=7)注:与Sham组相比,***P<0.001,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
2.2.2大鼠骨代谢指标水平比较:由图3可知,与Sham 组相比,OVX 组大鼠血清中BGP和OPG含量显著下降(P<0.01),ALP和TRAP含量显著升高(P<0.01)。经过8周药物治疗可以缓解各项指标因骨质疏松导致的异常变化,与OVX 组相比,EV组、T组和TG组血清中OPG和BGP含量均有明显升高(P<0.05),血清ALP和TRAP含量显著降低(P<0.05)。与T组相比,TG组血清BGP含量明显升高(P<0.05)。OPG呈上升趋势,但差异不显著(P>0.05),ALP和TRAP含量均明显降低(P<0.05)。
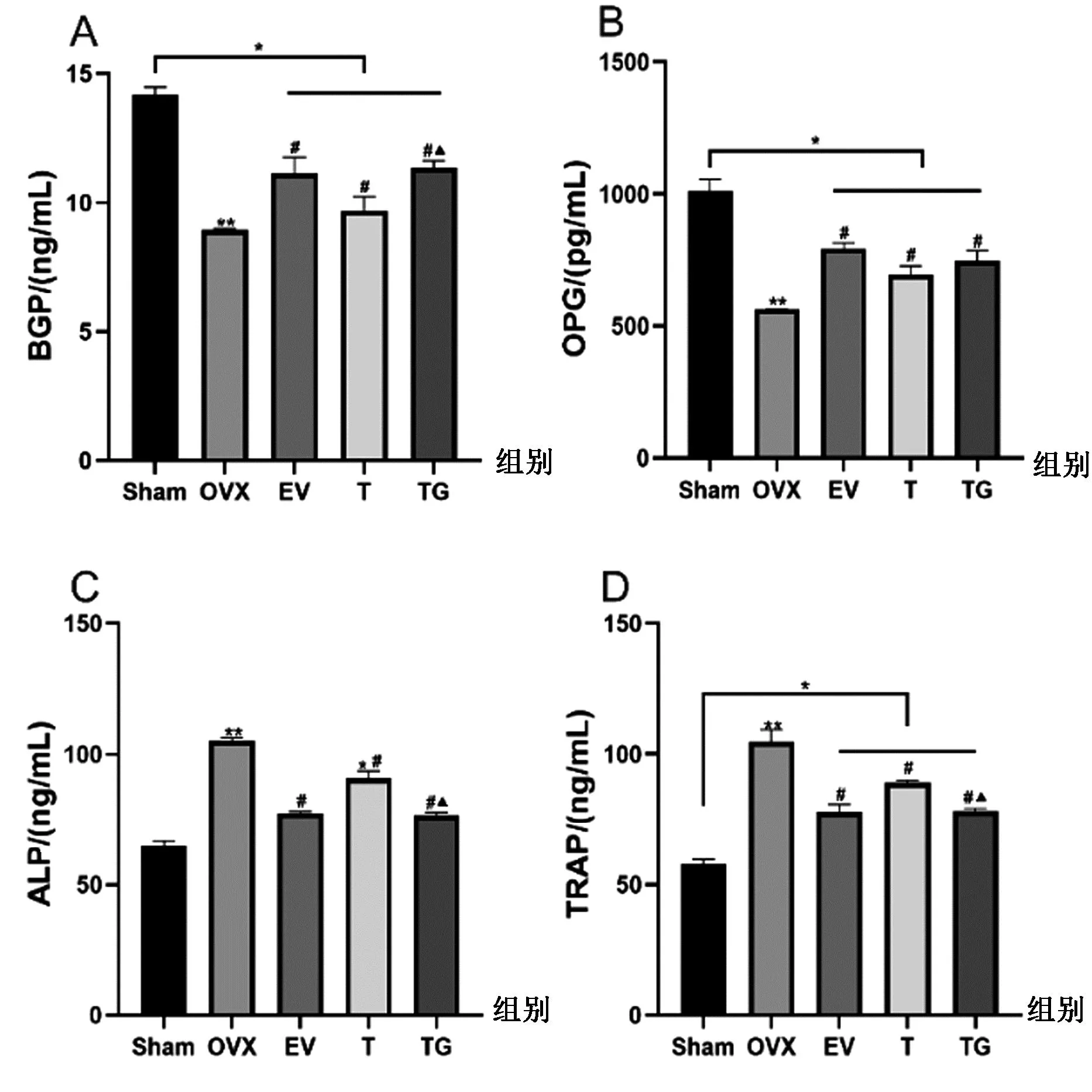
图3 各组大鼠骨代谢指标BGP(A)、OPG(B)、ALP(C)、TRAP(D)变化(n=7)Fig.3 Changes of bone metabolism indexes BGP (A), OPG (B), ALP (C), and TRAP (D) in rats in each group (n=7)注:与Sham组相比,**P<0.01,*P<0.05;与OVX组相比,#P<0.05;与T组相比,▲P<0.05。
2.2.3大鼠炎症因子水平比较:由图4可知,与 Sham 组相比,OVX组IL-10的含量明显下降(P<0.05),而TNF-α的含量升高2倍以上(P<0.001)。与 OVX 组相比,各给药组血清IL-10含量明显升高(P<0.05),TNF-α含量明显降低(P<0.05)。与T组相比,TG组对炎症的改善效果更显著(P<0.05)。
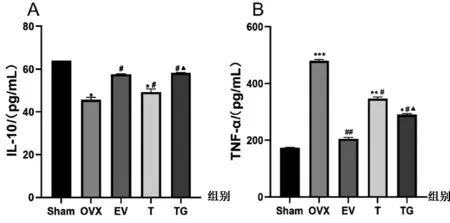
图4 各组大鼠血清炎症因子IL-10(A)、TNF-α(B)水平变化(n=7)Fig.4 Changes of serum inflammatory factors IL-10(A) and TNF-α(B) in rats of each group (n=7)注:与Sham组相比,***P<0.001,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
2.3 骨密度分析
如图5所示,切除卵巢后,大鼠小梁骨的微结构显著恶化,骨量有明显减少,经药物治疗后骨量及骨小梁密度有所增加,其中TG组的效果最显著。骨微结构参数显示(图6),与Sham组相比,OVX组的Tb.N、BV/TV和Tb.Th均明显降低(P<0.05),SMI和Tb.Sp明显升高(P<0.05)。与OVX组相比,各给药组中Tb.N、BV/TV、Tb.Th均明显升高(P<0.05),SMI和Tb.Sp均明显降低(P<0.05)。
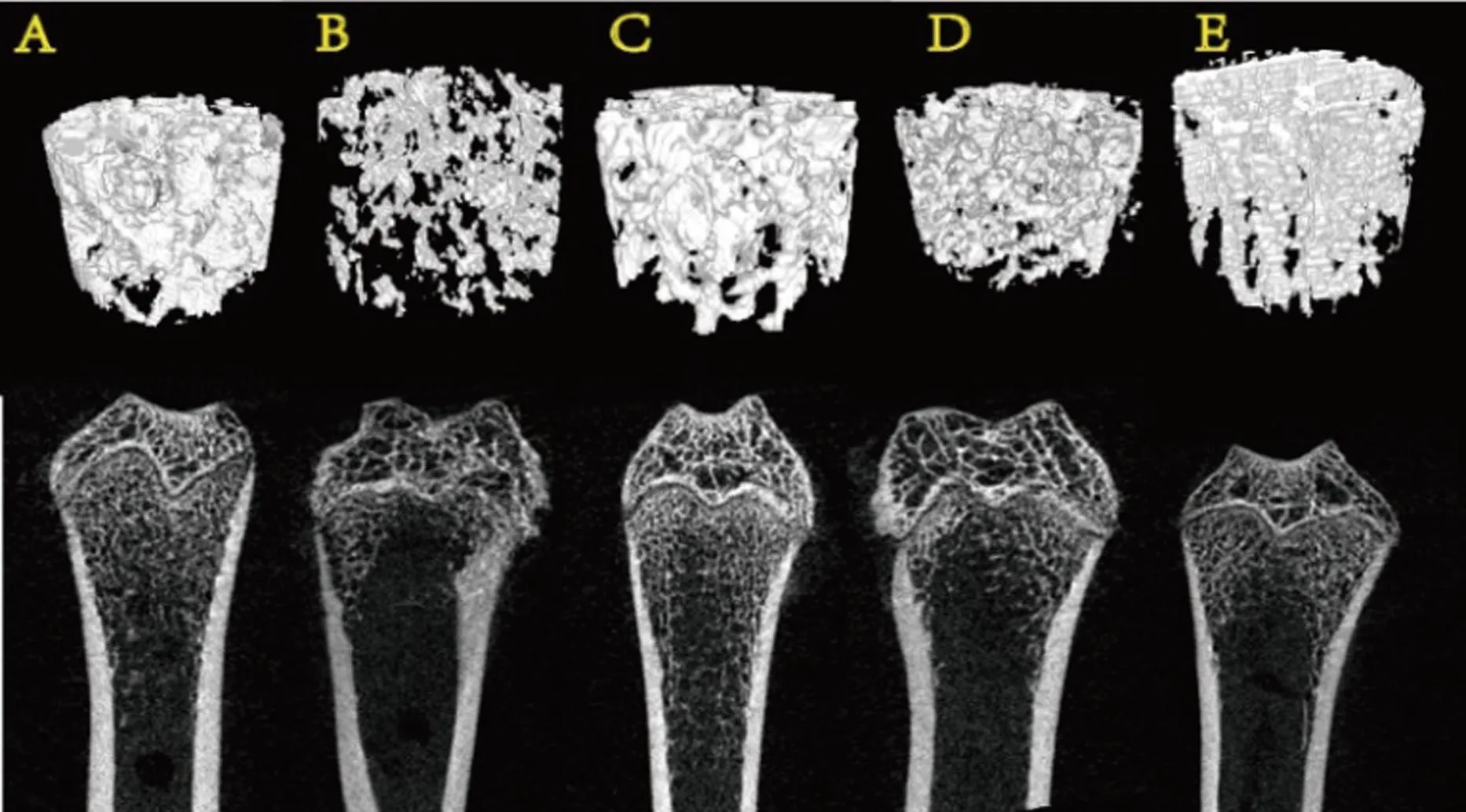
图5 各组大鼠股骨干骺端骨小梁微结构CT图(n=7)注:A:Sham组;B:OVX组;C:EV组;D:T组;E:TG组。Fig.5 CT images of trabecular microstructure in the metaphyseal bone of rats in each group (n=7)A: Sham group; B: OVX group; C: EV group; D: T group; E: TG group.
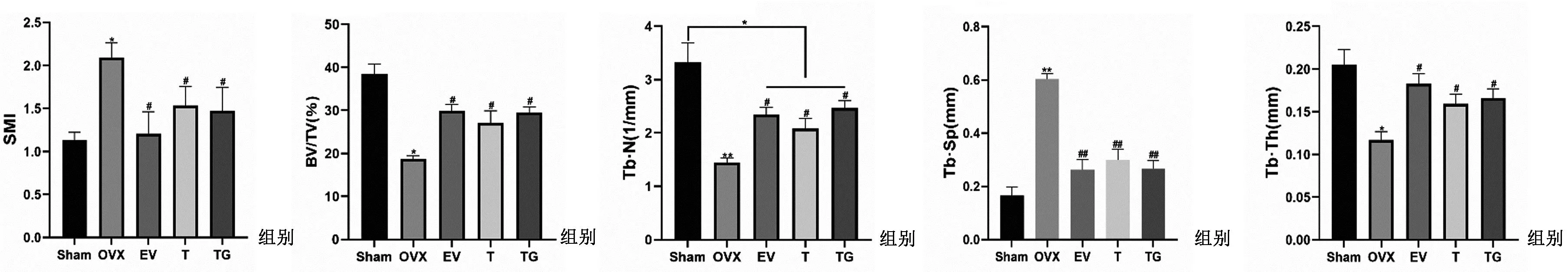
图6 各组大鼠骨微结构参数变化(n=7)Fig.6 Changes in bone microstructural parameters in various groups of rats (n=7)注:与Sham组相比,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05。
2.4 骨生物力学指标分析
如图7所示,OVX组、EV组、T组和TG组胫骨极限负荷、刚度和弹性模量参数较Sham组显著降低(P<0.05)。与OVX组相比,药物处理组骨力学参数水平明显升高(P<0.05)。与T组相比,TG组生物力学指标改善更显著(P<0.05)。
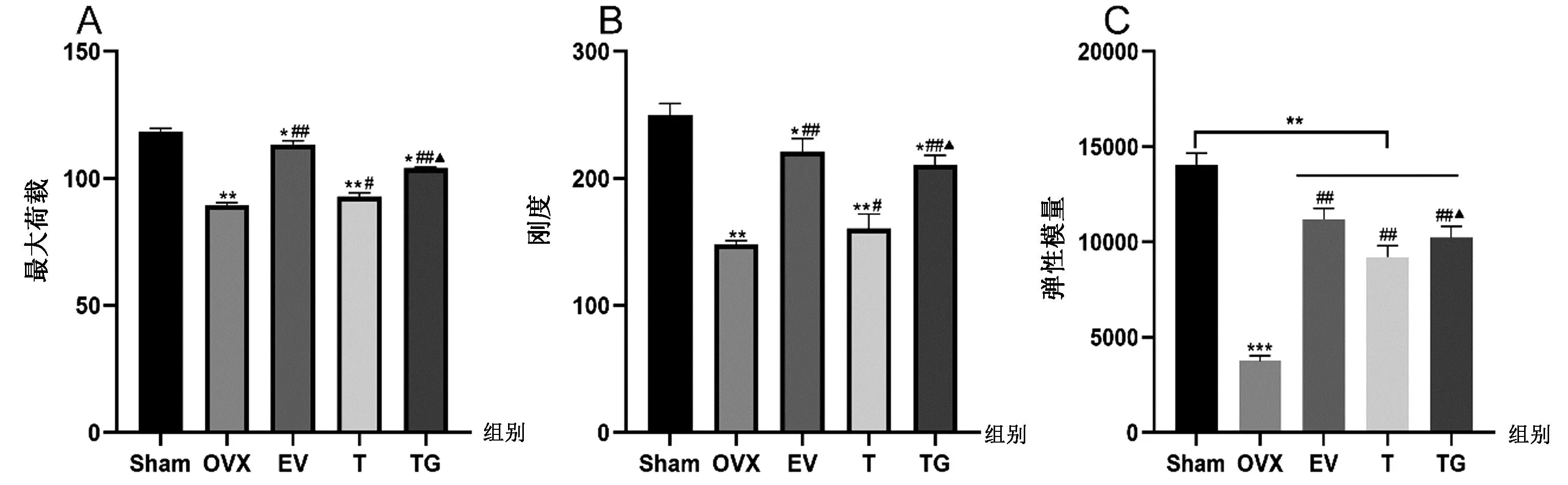
图7 各组大鼠生物力学指标最大荷载(A)、刚度(B)、弹性模量(C)水平比较(n=7)Fig.7 Comparison of biomechanical indexes of rats in each group: maximum load (A), stiffness (B) and elastic modulus (C) (n=7)注:与Sham组相比,***P<0.01,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
2.5 骨组织病理学评价
2.5.1HE染色:如图8所示,Sham组大鼠骨小梁致密,连续性好,排列整齐;OVX组大鼠骨小梁稀疏,结构紊乱,骨髓孔洞增大,有较多空隙;与OVX组相比,EV组、T组、TG组的股骨骨小梁变粗变密,连接有所增加,骨组织形态呈现好转。
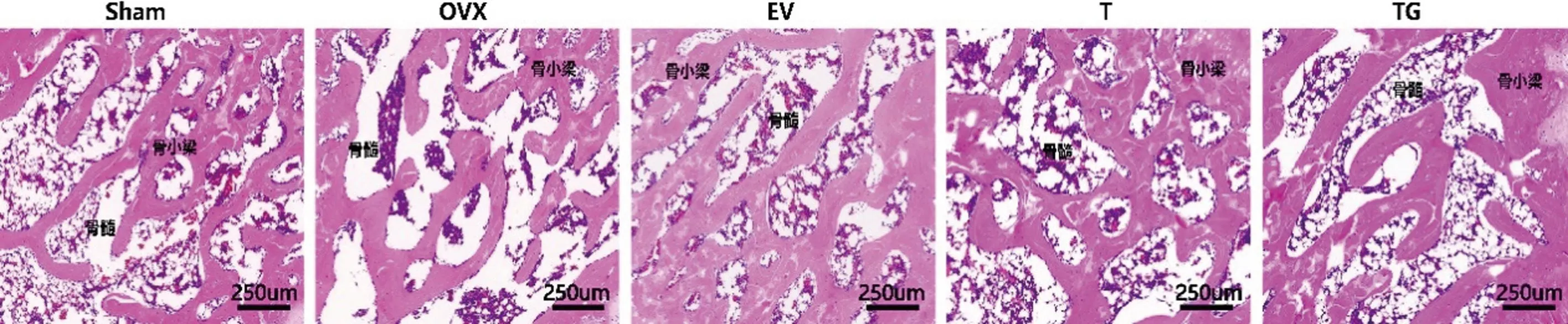
图8 各组大鼠骨组织形态学观察(HE染色×100,n=3)Fig.8 Morphological observation of bone tissue of rats in each group (HE staining×100, n=3)
2.5.2TRAP染色:与Sham组相比,OVX组、EV组、T组和TG组破骨细胞(箭头)数量显著升高(P<0.05);与OVX组比,给药组均可不同程度抑制阳性破骨细胞的形成(P<0.05);与T组相比,TG组破骨细胞数量明显减少(P<0.05)(图9)。

图9 各组TRAP染色,箭头表示TRAP阳性多核细胞的区域(A),TRAP阳性细胞的定量 (B)(TRAP染色×400,n=3)Fig.9 TRAP staining in each group. The black arrow shows the region of TRAP-positive multinucleated cells (A). Quantification of TRAP-positive cells (B) (TRAP staining×400, n=3)注:与Sham组相比,***P<0.001,**P<0.01,*P<0.05;与OVX组相比,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
2.6 免疫组化分析
如图10所示,与Sham组相比,OVX组TLR4阳性表达显著升高(P<0.01),PI3K和AKT阳性表达显著降低(P<0.01)。与OVX组相比较,EV组和TG组TLR4阳性表达明显降低(P<0.05),PI3K和AKT阳性表达明显升高(P<0.05),而T组中各基因表达不显著(P>0.05)。
2.7 qRT-PCR 检测股骨中TLR4/PI3K/AKT信号通路mRNA的表达
与Sham组比较,OVX组的PI3K、AKT mRNA相对表达量均明显降低(P<0.05),TLR4 mRNA相对表达量显著升高(P<0.01);与OVX组比较,各给药组的PI3K、AKT mRNA相对表达量均显著升高(P<0.05),TLR4 mRNA相对表达量显著降低(P<0.05);与T组比较,TG组TLR4 mRNA相对表达量显著降低(P<0.05),PI3K mRNA相对表达量显著升高(P<0.05),AKT mRNA表达水平也有所升高但不显著(图11)。
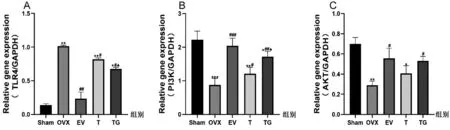
图11 相关基因TLR4(A)、PI3K(B)、AKT(C) mRNA表达(n=3)Fig.11 mRNA expressions of related genes TLR4 (A), PI3K (B), AKT (C) (n=3)注:与Sham组相比,***P<0.001,**P<0.01,*P<0.05;与OVX组相比,###P<0.001,##P<0.01,#P<0.05;与T组相比,▲P<0.05。
3 讨论
绝经后雌激素水平低,会致使骨量下降和骨组织结构退化[16]。在骨代谢指标中,骨形成标志物BGP和OPG均参与骨吸收的调节;ALP与骨基质矿化相关,抑制ALP活性有利于骨形成;TRAP由成熟的破骨细胞在骨吸收过程中分泌,反映骨吸收速率;骨基质中钙磷代谢也参与调控骨质疏松,血清Ca和血清P浓度呈负相关,当低磷高钙稳态被打破时,会导致骨重建紊乱[17]。相关研究还发现,TNF-α可作用于骨代谢,诱发破骨细胞前体细胞的分化、成熟,IL-10则具有抑制破骨细胞的重聚和活化,激活免疫调节作用,可以改善大鼠关节炎症,防治骨破坏[18-19]。大量研究表明,PI3K/AKT信号通路参与调节骨形成,进而控制骨密度平衡[20-21]。TLR4是一种先天免疫应答的模式识别受体,可以干扰骨细胞的正常功能,是加重骨质疏松症的上调因素[22]。雌激素缺失会激活上游TLR4信号通路,造成免疫级联效应,过度的激活可诱发破骨细胞大量增殖,而下游PI3K/AKT信号通路的活化可改善骨丢失,TLR4与PI3K/AKT通路呈现负相关[23-24]。
硫酸软骨素是关节软骨细胞外基质的主要成分,具有改善软骨基质的合成与分解平衡作用[25]。氨基葡萄糖可刺激糖胺聚糖合成,具有增加成骨细胞的活性和促进新骨形成的作用[26]。二者被广泛用于恢复软骨功能,缩小关节间隙和缓解症状[27]。淫羊藿总黄酮能够显著降低骨小梁的分离度、增加骨密度和改善骨微结构[28-29]。本研究结果显示,OVX组大鼠骨密度低于Sham组,表明大鼠去卵巢后雌激素缺乏进而导致骨量丢失,而给药处理后大鼠骨密度增加。与Sham组相比,OVX组大鼠血清P、ALP、TRAP和TNF-α水平明显升高,血清Ca、BGP、OPG和IL-10水平明显降低,表明去势大鼠会增加破骨细胞活性,影响成骨细胞生成,而给药治疗后骨形成与骨吸收之间的平衡得到改善,联合给药效果更佳。此外,淫羊藿总黄酮联用骨营养剂可以减弱TLR4 mRNA的表达,并减弱相应基因的表达,增强PI3K和AKT mRNA的表达,进而改善骨代谢。
综上,淫羊藿总黄酮与骨营养剂氨基葡萄糖-硫酸软骨素联合使用可以提高去卵巢骨质疏松大鼠骨密度,改善骨代谢,并通过激活TLR4/PI3K/AKT信号通路发挥协同治疗骨质疏松的作用。
