ERK/Smad信号通路影响固本增骨方对去势大鼠骨代谢的研究
2024-01-12宋敏胡阳李凯刘路李金益
宋敏 胡阳 李凯 刘路 李金益
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃中医药大学附属医院,甘肃 兰州 730000
骨质疏松症(osteoporosis, OP)是临床常见的慢性、退行性、骨代谢疾病,呈现出基数大、预后差、不可逆性等特点,多发生于绝经后女性,严重影响患者生活质量[1]。OP前期无明显症状,疾病发生发展常不易察觉,诊断率低;OP中后期会出现明显的临床表现,如全身疼痛、乏力及肌肉痉挛,劳累后加重,严重者可造成脆性骨折[2]。临床治疗OP的常用药物包括双膦酸盐、雌激素、甲状旁腺素和降钙素,然而上述药物可能会引起许多副作用,如胃肠道不良反应、关节疼痛和腿部痉挛,长期疗效欠佳[3]。因此,寻找潜在的药物治疗OP,刺激骨形成,是一个亟待解决的问题。
传统中药及复方由于其多成分和多靶点的特性,在促进骨形成方面具有独特的优势[4]。本课题组基于理论基础和多年临床经验,认为“脾肾虚弱、气虚血瘀”是本病发生的关键病机,并拟定防治OP经验方固本增骨方,其具有补益脾肾、益气活血的功效,临床治疗安全有效[5-6]。前期研究发现,固本增骨方可通过调节肠道菌群,发挥类雌激素作用改善骨质疏松,对OP模型大鼠的骨代谢指标及骨密度有所提升[7-8]。固本增骨方也通过Wnt/β-catenin、Notch、BMP-Smads等通路调控成骨细胞的分化及增殖,但对于ERK/Smad通路的实验研究还未涉及[9-11]。ERK和Smad信号传导间的串扰联系之前就有描述[12-13],最近的研究显示,ERK活性增加可促进Smad介导的转录,减少骨流失[14]。其他研究表明,ERK抑制剂可以下调Smad相关蛋白的表达并影响骨形成[15]。补肾固本方在预防SAMP6大鼠骨丢失,还增加了成骨特异性因子Runx2的表达,改善骨小梁结构,与激活ERK/Smad信号通路调控骨代谢平衡有关[16]。
因此,本研究通过观察固本增骨方对去卵巢OP模型大鼠干预效果,探讨固本增骨方与ERK/Smad信号通路之间的联系,揭示其防治骨质疏松症的药理学效应,为固本增骨方的基础研究与临床应用提供参考资料。
1 材料与方法
1.1 材料
1.1.1实验动物:SPF级Wister雌性大鼠60只,12周龄,体重(200±20)g,由甘肃中医药大学动物实验中心[SCXK(甘)2020-0001]提供。在甘肃中医药大学实验动物管理中心SPF级实验环境进行饲养与实验,温度22 ℃~26 ℃,空气湿度 50 %~60 %,每笼6只,光照时间:12 h为一循环,自由进食和饮水。实验项目已通过甘肃中医药大学实验动物伦理审查,文件批号:2021-061。
1.1.2实验药物与试剂:固本增骨方:当归12 g (批号:21047501)、炙黄芪30 g (批号:21037851)、熟地黄12 g (批号:21018581)、烫狗脊12 g (批号:21007931)、乌药9 g (批号:22005371)、党参12 g (批号:21037991)、鹿角胶 6 g (批号:21007721)、炙淫羊藿9 g (批号:22017911)、盐补骨脂12 g (批号:21039252)、酒肉苁蓉12 g (批号:21036901)、土鳖虫6 g (批号:1090803),由甘肃中医药大学附属医院药物制剂中心提供;戊酸雌二醇(美国拜耳医药保健公司,693A);BALP的ELISA试剂盒(江苏酶免实业有限公司,批号:MM-0619R)、TRACP-5b的ELISA试剂盒(江苏酶免,批号:MM-0406R);ERK抗体(1∶5 000,武汉三鹰生物技术有限公司,11257-1-AP);p-ERK抗体(1∶1 000,武汉三鹰生物技术有限公司,28733-1-AP);p-ERK抗体(1∶1 000,武汉三鹰生物技术有限公司,10231-1-AP)。
1.1.3实验仪器:双能X线骨密度仪(美国,GE Lunar,iDXA)、台式电热恒温鼓风干燥箱(天津市泰斯特仪器,WGL-30B)、化学发光成像仪(北京赛智科技,MiniChemi 610)、恒温培养箱(上海精宏实验设备,GNP9160)、酶标仪(无锡华卫德朗仪器,DR-200Bs)、实时定量PCR仪(美国,Life Technologies,QuantStudio 6 FlexSystem)、PCR仪(杭州博日科技,基因扩增仪TC-XP)、NanoDrop核酸浓度测量仪(美国塞默飞,L30000118)。
1.2 方法
1.2.1动物分组与处理:将60只SPF 级12周龄雌性Wister大鼠适应性喂养1周后,随机分为假手术组、模型组、雌二醇组、固本增骨方低剂量组、固本增骨方中剂量组、固本增骨方高剂量组,每组10只。造模组、假手术组大鼠术前禁食、不禁水24 h后,向大鼠腹腔内推注2 %戊巴比妥钠溶液(0.2 mL/kg)进行麻醉,除假手术组外,其余各组均摘除大鼠双侧卵巢建立骨质疏松模型[17];术后伤口涂抹青霉素软膏防止感染。采用双能X射线骨密度仪检测造模后8周的模型大鼠,骨密度(bone mineral density, BMD)峰值减少≥2.5 SD (标准差),提示造模成功。参考《中药药理研究方法学》,将固本增骨方按照成人剂量(体重为70 kg)换算为大鼠等效剂量[18],固本增骨方制成浓度为1.13 g/mL的混悬液,按照体表面积法换算(10 mL/kg药液)后对固本增骨各组大鼠按2.26 g/kg进行灌胃,假手术组和造模组用等体积生理盐水灌胃,每日1次,每次2 mL,连续灌胃12周,最后一次给药2 h后,用2%戊巴比妥钠进行腹腔注射麻醉,心脏穿刺采血,静置30 min后,离心机3 000 r/m,37℃离心15 min,分离上层血清液,转移至冻存管分组标记,置于-20 ℃冰箱保存。
1.2.2骨质量与骨密度检测:分别于治疗前后称重,并采用双能X线骨密度仪检测大鼠股骨近端、L4~6腰椎骨密度,取平均值。
1.2.3骨代谢检测:采用ELISA法检测大鼠心脏动脉血血清中BALP和TARP-5b值。
1.2.4骨组织结构变化检测:大鼠采血完成后予颈椎脱臼法处死,取实验大鼠股骨组织,常规固定、脱钙、浸蜡包埋、切片、苏木精-伊红分别染色,待不同梯度乙醇脱水后,固定封片后镜检。
1.2.5骨组织ERK1、ERK2、Smad4 mRNA检测:将股骨组织加入液氮研磨,提取总RNA,进行反转录及扩增,运用实时荧光定量PCR法检测ERK1、ERK2、Smad4的 mRNA表达。引物详见表1。DNA扩增条件:95 ℃预变性30 s后进入PCR循环,95 ℃变性15 s,58 ℃退火30 s, 延伸30 s,共40个循环。待反应结束后,数据利用 2-△△CT法计算结果,分析各组样本mRNA的含量。

表1 引物序列Table 1 Primer Sequences
1.2.6Westbern Blot检测骨组织ERK、p-ERK、Smad4的蛋白表达:将股骨组织加入液氮研磨,BCA法蛋白定量,电泳分离后转移至PVDF膜,加入5 %脱脂奶粉中封闭,室温条件下封闭60 min。加入Smad4(1∶1 000)、EKR(1∶5 000)、p-ERK(1∶1 000)蛋白一抗的稀释液中,4 ℃环境下过夜。TBST缓冲液洗涤3次,加入二抗(1:10 000),室温孵育30 min,漂洗。滴加新鲜ECL,暗室中曝光,显影定影,AlphaEaseFC软件处理系统分析目标带的光密度值。
1.3 统计学分析
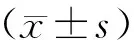
2 结果
2.1 大鼠造模前后情况变化
摘除卵巢后,各组大鼠整体状况稳定,在饲养笼内自由活动、摄食饮水,造模手术伤口在术后1周左右恢复。术后假手术组大鼠恢复良好,精神欠佳,活动量减少,饮食及水量减少,反应灵敏,有抵触应激反应,适应期过后可缓解。造模组大鼠伤口恢复良好,但精神状态变差,活动能力减弱,饮食及水量减少,伤口愈合后出现体重增加,反应迟钝,皮肤毛发色泽暗淡,激怒及其他行为活动减少。经固本增骨方及戊酸雌二醇灌胃后,大鼠精神状态、活动情况改善,饮食及水量正常,反应灵敏,皮肤毛发色泽光亮,无激怒及异常行为。
2.2 大鼠体重及骨密度检测结果
与假手术组大鼠相比,模型组的骨密度显著降低(P<0.01);与模型组比较,固本增骨各剂量组及雌二醇组的骨密度显著增加(P<0.01),骨密度随固本增骨剂量增加而明显增加,以高剂量组最为显著;与高剂量组相比,低剂量组和中剂量组骨密度明显降低(P<0.01,P<0.05),雌二醇组与高剂量组之间无明显差异(P>0.05),如表2所示。
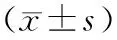
表2 各组大鼠干预完成后BMD的变化Table 2 Changes in BMD of rats in each group after intervention completion
2.3 固本增骨方对骨质疏松大鼠骨代谢标志物的影响
与假手术组相比,模型组中血清骨源性碱性磷酸酶(BALP)含量显著降低,差异具有统计学意义(P<0.01);与模型组比较,固本增骨各剂量组及雌二醇组BLAP含量明显上升 (P<0.01,P<0.05);与高剂量组相比,低剂量组、中剂量组中BALP水平降低(P<0.05),雌二醇组血清中BALP的水平无明显差异(P>0.05) ,抗酒石酸酸性磷酸酶-5b(TRACP-5b)与之相反,见表3。
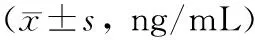
表3 血清中BALP及TRACP-5b水平Table 3 Levels of BALP and TRACP-5b in serum ng/mL)
2.4 固本增骨方对骨质疏松骨结构的影响
假手术组股骨下骨小梁结构良好,骨骺下骨小梁数目多,骨小梁宽度和排列性好,骨小梁之间互联成网状;模型组镜下骨骺下骨小梁呈现排列结构错乱,骨小梁厚度变细、数目减少,且骨小梁之间小梁间隙扩大,出现断裂及不规则断端,周围骨母细胞增生及破骨细胞增生,髓腔内脂肪滴明显增多,骨质疏松改变的典型图像。与模型组对比,低剂量组与中剂量组基本大致相同,骨小梁结构厚度变宽,周围骨细胞的数目变多,骨小梁之间连接不完整,排列趋于完善;高剂量组的骨小梁数目增多,厚度增加,骨小梁之间形成网状结构,髓腔内脂肪滴减少;雌二醇组的骨小梁呈现排列结构正常,数目明显增加,结构稳定。见图1。
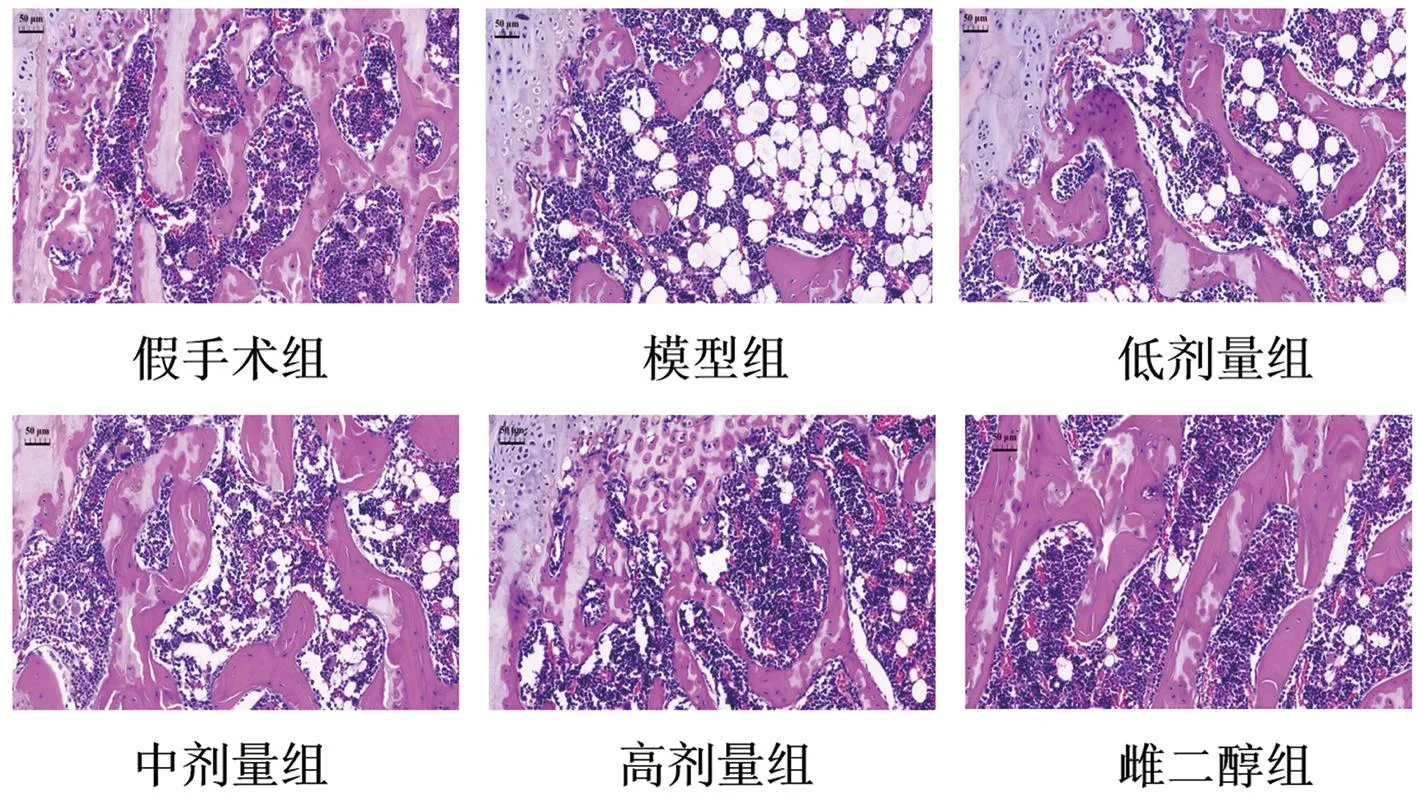
图1 HE染色股骨切片(×200)Fig.1 HE staining of femoral slices(×200)
2.5 固本增骨方对骨质疏松大鼠骨组织ERK1、ERK2、Smad4表达情况
通过RT-PCR检测股骨组织ERK1、ERK2、Smad4的表达,假手术组中ERK1、ERK2、Smad4的mRNA的表达,均高于各实验组,差异有统计学意义(P<0.01)。与模型组对比,雌二醇组、固本增骨各剂量组的ERK1、ERK2、Smad4的mRNA表达明显上调(P<0.05);与高剂量组相比较,中剂量组、低剂量组ERK1、ERK2、Smad4的mRNA明显下降(P<0.05);高剂量组与雌二醇组之间无明显差异(P>0.05)。见图2。
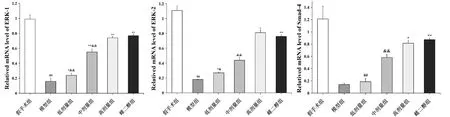
图2 各组ERK1、ERK2、Smad4基因表达Fig.2 Expression of ERK1, ERK2, and Smad4 mRNA in each group注:与假手术组相比,##P<0.01;与模型组比较,**P<0.01;与高剂量组比较,&&P<0.01。
2.6 固本增骨方对骨质疏松大鼠骨组织ERK、p-ERK、Smad4蛋白表达情况
与假手术组相比较,模型组、固本增骨方各剂量组及雌二醇组ERK、p-ERK、Smad4蛋白水平显著降低(P<0.01);与模型组相比较,雌二醇组、固本增骨各剂量组ERK、p-ERK、Smad4表达显著增加(P<0.05);与高剂量组相比较,中剂量组、低剂量组ERK、p-ERK、Smad4蛋白表达显著降低(P<0.05),浓度呈依赖性上升;高剂量组与雌二醇组之间无差异(P>0.05)。见图3。
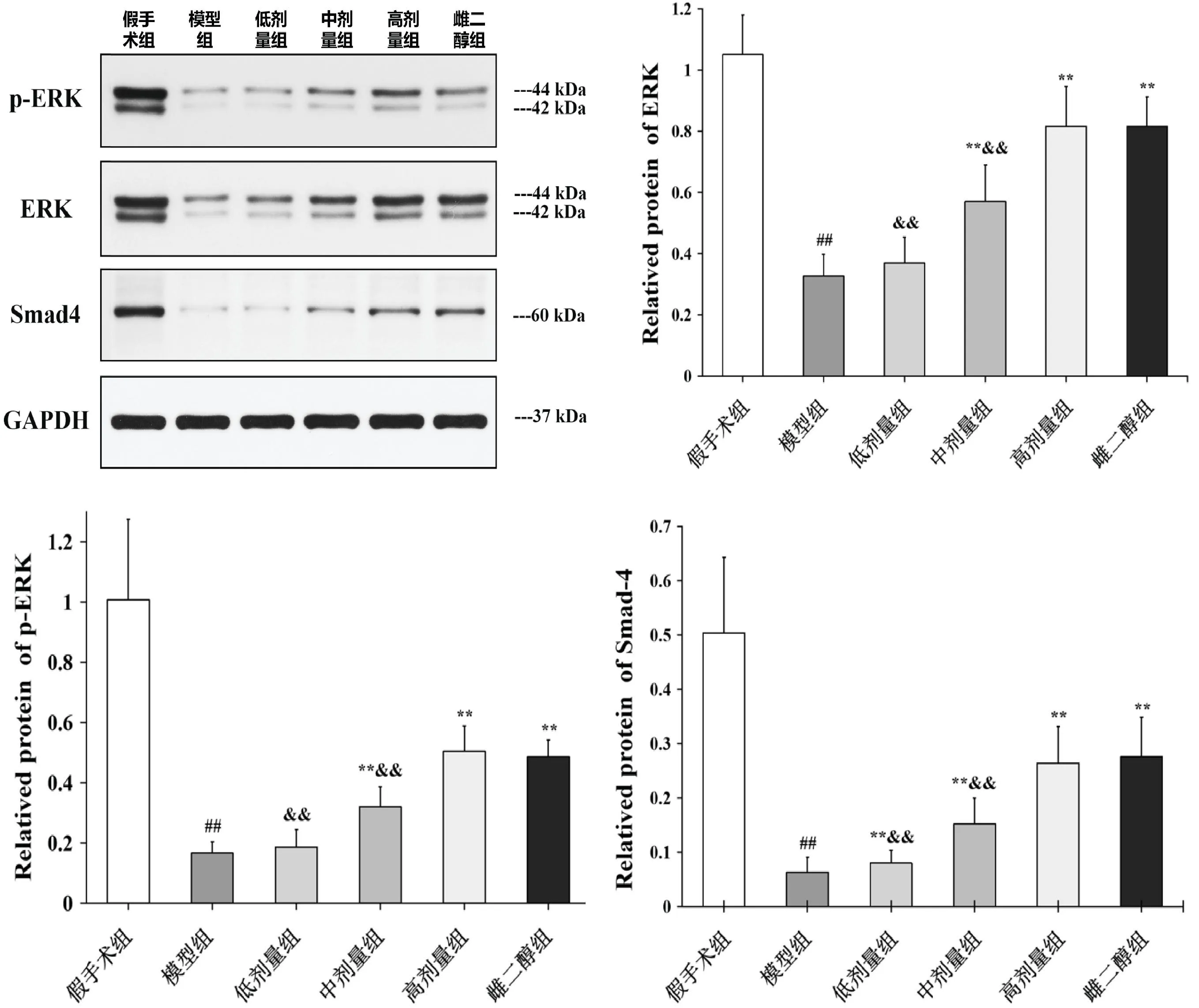
图3 各组ERK、p-ERK、Smad4蛋白表达Fig.3 Expression of ERK, p-ERK, and Smad4 proteins in each group注:与假手术组相比,##P<0.01;与模型组比较,**P<0.01;与高剂量组比较,&&P<0.01。
3 讨论
根据古代医籍记载和临床表现,OP被归属为“骨痿”“骨枯”等范畴,中医认为该病发生与肾密切相关,肾、肝、脾三脏的虚损会导致OP发生,瘀血是发病的契机[19]。固本增骨方是以西北特色道地药材为主药相配伍,起着温补脾肾,益气活血通经的功效[20]。基础研究证实,固本增骨方可抑制血清中破骨标志物的表达,增加成骨标志物的表达,改善因雌激素减少引起的骨质疏松,对骨量丢失具有治疗效果[21-22]。大量研究表明,ERK、Smad4都参与了OP的发生,它们的激活促进了成骨分化[23-24]。细胞外调节激酶(ERK)1/2通路是MAPK通路中重要信号通路之一,通过各种生长因子、过氧化氢等因素影响磷酸化,与细胞增殖及分化,骨骼的成长密切相关[25]。在维甲酸培养的MC3T3-E1细胞中诱导成骨分化,p-ERK和p-SMAD1的表达降低,成骨增殖减少;而加入褪黑素后可激活ERK途径可促进成骨细胞中的Runx2,BMP-2和OCN成骨相关基因及蛋白的表达,促进骨形成,防治骨质疏松症[26]。研究发现,激活ERK信号通路可增加骨密度,上调成骨基因表达、促成骨细胞的增殖与分化;反之,抑制该途径则引起成骨基因及蛋白下降,骨形成受到抑制,表明ERK/Smad通路的激活可正向调控成骨细胞[27]。SMAD蛋白是转化生长因子-β(TGF-β)和骨形态发生蛋白(BMP)信号通路的关键内效应物,起转录因子的作用[28]。Smad通过TGF-β / BMP途径直接参与诱导OB和OC的形成和分化,其在骨代谢调节中起着不可或缺的作用[29]。据报道,Smad4已被证明是调节成骨形成的转录因子,Smad4与其他激活的Smad蛋白形成复合体,然后这些复合体移位到细胞核并调节其靶基因的转录[30]。BMP-2/Smad/Runx2/Osterix轴在骨代谢研究中上调Osterix、CollagenⅠ的表达,进一步增强成骨细胞增殖并诱导骨再生的能力[31]。此外,Smad4是转化生长因子-β信号通路中的关键基因,已被证明调节成骨细胞分化和诱导异位骨形成[32]。研究发现上调Smad4、Runx2的mRNA及蛋白表达,可改善骨质疏松,减少骨丢失[33]。
本研究结果显示,骨质疏松模型组大鼠股骨的骨密度降低、骨小梁数目减少、相对骨体积变小、骨小梁平均厚度降低、骨小梁分离度上升,而经治疗后可以改善这一现象。这说明固本增骨方可改善大鼠股骨的骨量减少和骨微结构破坏,对骨质疏松具有治疗作用。骨转换标志物作为骨重塑过程中产生的代谢物,可在尿液或血清中检测出,并提示骨转换率的变化,是疾病发生早期及时、明显的指标[34]。骨特异性碱性磷酸酶 (BALP)在成骨细胞中分泌,是骨形成的特异性标志物。TRACP-5b来源于破骨细胞,当TRACP-5b释放到骨吸收间隙时,有利于破骨细胞迁移,并且在降解I型骨基质胶原方面起作用,是骨吸收的特异性标志物[35-36]。结果表明,固本增骨方呈剂量依赖性调控血清中骨重塑标志物BALP的表达,抑制骨吸收标志物TRACP-5b表达,尤其以固本增骨高剂量治疗效果最好,促进成骨细胞的增殖,有效修复骨小梁结构,改善骨质量。Liu等[37]研究证实未羧基化骨钙素通过上调成骨特异性基因Osx、Runx 2、ALP和COLI的表达以及增加ALP活性、COLI产生和钙化结节形成来促进BMSCs的成骨分化。未羧基化骨钙素防治骨丢失机制:一方面,可激活ERK通路,ERK抑制GSK-3β活性,然后上调β-catenin,最终促进成骨分化;另一方面,其可激活ERK,上调Smad活性,最终促进骨髓间充质干细胞成骨分化。孙凯等[38]实验发现补骨生髓方上调ERK及Smad4的基因及蛋白表达,从而促进去卵巢大鼠骨形成,补骨生髓方促进骨代谢机制可能与ERK和Smad4信号通路密切相关,通过增加ERK蛋白磷酸化而促进ERK/Smad通路激活而防治骨丢失。本实验结果得出,固本增骨方可通过对ERK-1、ERK-2及Smad4 基因及ERK、p-ERK及Smad4蛋白表达影响而促进成骨增殖,改善骨质疏松,其中以固本增骨方高剂量干预去势大鼠最为明显。
综上所述,固本增骨方可促进成骨细胞形成,提升骨质量,上调ERK及Smad4基因表达,增加ERK、p-ERK及Smad4蛋白表达,调节骨吸收与骨形成的动态平衡从而防治OP,其作用机制可能与干预ERK/Smad系统密切相关。
