利格列汀通过激活AMPK/PGC-1α/TFAM通路改善糖尿病肾脏疾病线粒体生物合成
2024-01-12钱宇池倪文静卢宇欣陈卫东
万 璐,钱宇池,3,倪文静,2,卢宇欣,李 巍,潘 艳,陈卫东
蚌埠医科大学1第一附属医院肾内科,2临床检验诊断实验室,3基础医学机能学综合实验室,安徽 蚌埠233000
据国际糖尿病联盟估计,2045年糖尿病患者人数将增至6.3亿[1]。糖尿病肾脏疾病(DKD)作为糖尿病的微血管并发症之一,已经是许多国家终末期肾脏病的主要原因。DKD发病机制错综复杂,但近年来,越来越多的研究表明线粒体稳态失衡在DKD的发生发展中具有重要作用[2-6]。线粒体生物合成在线粒体稳态中具有重要作用,其主要与AMPK、PGC-1α的激活有关。PGC-1α蛋白可以促进其下游核呼吸因子1 及核呼吸因子2的表达,从而促使线粒体中TFAM 的生成增加。研究表明,AMPK/PGC-1α/TFAM 通路是线粒体合成的关键通路[7,8]。
利格列汀是临床上被广泛运用的二肽基肽酶-4(DPP-4)抑制剂之一,在糖尿病患者的血糖控制、肾脏和心血管系统的保护中都具有不错的效果[9,10]。已有文献报道,利格列汀可以通过激活AMPK/SIRT1/PGC-1α通路达到减轻醋酸诱导的大鼠结肠炎的效果[11]。利格列汀通过激活AMPK通路,进而缓解内毒素诱导的肾损伤[12]。而利格列汀在DKD中能否通过激活AMPK/PGC-1α/TFAM通路,促进线粒体生物合成,缓解线粒体功能紊乱,进而改善肾脏损伤,还需进一步验证。本实验旨在探讨利格列汀对DKD线粒体生物合成的影响,并从AMPK/PGC-1α/TFAM通路的角度探究其可能的作用机制。
1 材料和方法
1.1 主要材料
1.1.1 主要试剂与仪器 兔抗AMPK多克隆抗体、兔抗TFAM 多克隆抗体、鼠抗PGC-1α 单克隆抗体(Proteintech),兔抗P-AMPK 抗体(Cell Signaling Technology),HRP 标记的山羊抗兔IgG(H+L)(Invitrogen),山羊抗鼠IgG HRP(白鲨);利格列汀、羧甲基纤维素钠(麦克林);STZ(北京索莱宝);组织线粒体分离试剂盒、ATP检测试剂盒、线粒体膜电位检测试剂盒(JC-1)(碧云天);多聚甲醛固定液(赛维尔);二氨基联苯胺显色试剂盒(Zsbio);CX43 荧光显微镜(Olympus);EnSigh多功能酶标仪(PerkinElmer)。
1.1.2 动物 SPF 级雄性SD 大鼠24 只,体质量160~180 g,由安徽医科大学提供,动物合格证编号SYXK(苏)2021-0049,实验动物及饲养条件符合《实验动物管理条例》要求,并依照蚌埠医科大学伦理审查委员会规定(批准号:2020-227)进行科学研究。在12 h光照/12 h黑暗循环中,所有大鼠于受控温度22±1 ℃和相对湿度(55±5)%的笼子中自由食用实验室提供的食物和水。
1.2 方法
1.2.1 建立DKD模型 适应性喂养1周后,随机抽选6只大鼠为正常对照组(NC组)喂养普通饲料,抽选18只大鼠予以4周高脂高糖饮食+45 mg/kg 1%STZ腹腔注射法造模。注射72 h后至少连续3 d尾静脉检测血糖。以连续3次血糖>16.7 mmol/L,尿量>原尿量150%,尿蛋白排泄>30 mg/24 h为造模成功标准。最终死亡1只,未成功1只,总计成功16只。将其随机分为DKD模型组(DKD组)、利格列汀干预组(DKD+Linagliptin组),每组8只,继续予以高脂高糖饲料喂养。DKD+Linagliptin组用5g/L羧甲基纤维素钠配置2 mg/mL的利格列汀5 mg/(kg·d)给予大鼠灌胃12周;NC组、DKD组大鼠给予等量羧甲基纤维素钠灌胃。给药期间不给予其他药物,并观察大鼠精神状态、毛发柔顺度、饮食、尿量。
1.2.2 测量大鼠体质量、肾指数 药物干预12周后,用100 mL/L水合氯醛麻醉大鼠(0.5 mL/kg)加腹主动脉取血的方式处死大鼠。处死前测量大鼠体质量。处死后取双肾于4 ℃PBS溶液中冲洗,滤纸吸干表面水分后电子天平称量双侧肾脏质量,计算肾指数。
1.2.3 检测大鼠血糖、肾功能和肝功能情况 药物干预12周末收集大鼠24 h尿液,并计算总量,留取部分尿液4℃1000 r/min离心5 min,取适量上清于全自动生化分析仪检测尿微量白蛋白,试剂盒检测尿蛋白。尽可能多的抽取大鼠的腹主动脉血液于抗凝管中,使用全自动生化分析仪检测大鼠腹主动脉血清中血糖(Glu)、血清肌酐(SCR)、血尿素氮(BUN)、尿酸(UA)、白蛋白(ALB)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血清总胆固醇(TC)、甘油三酯(TG)的含量变化。
1.2.4 肾脏组织病理学检测 取一个肾脏的1/4,用PBS冲洗滤纸擦干后,用40 g/L多聚甲醛固定液固定,并制作石蜡切片,行HE、PAS、Masson、天狼猩红染色。取一小块肾脏组织快速投入预冷的戊二醛固定液中,固定漂洗至第2天,接着再用饿酸固定,梯度脱水,浸泡,环氧树脂包埋后进行超薄切片染色,透射电镜观察拍片。光镜及电镜观察大鼠肾小球体积,肾小球细胞数量,肾小球内皮细胞、系膜细胞、系膜基质、基底膜,肾脏组织纤维化程度,肾小管上皮细胞损害及恢复程度。
1.2.5 检测线粒体损伤相关指标 取20 mg肾组织,在处死大鼠1 h内提取新鲜线粒体,并用线粒体膜电位检测试剂盒(JC-1)、ATP检测试剂盒测量肾脏组织中ATP含量、线粒体膜电位(ΔψM)变化。
1.2.6 Western blot方法检测大鼠肾脏AMPK/PGC-1α/TFAM通路蛋白含量变化 取20 mg肾组织,加入200 μL RIPA 裂解液后匀浆,并置于冰上裂解30 min。接着12 000g离心15 min 后取上清,按BCA法测定浓度。用10、7.5%SDS-PAGE分离50 μg蛋白上样电泳,湿转到0.45 PVDF膜上。使用快速封闭液封闭40 min后,将膜条与抗AMPK(1∶1000),p-AMPK(1∶1000),PGC-1α(1∶5000),TFAM(1∶5000)和β-actin(1∶1000)抗体共同孵育,4 ℃过夜。第2天,蛋白条带与HRP结合抗体孵育2 h后,曝光显影,并用Image J软件半定量分析。
1.2.7 免疫组织化学法检测纤维化相关蛋白的含量变化 肾脏组织切片用抗TGF-β1 抗体、抗FN 抗体和抗COLⅠ抗体在4 ℃冰箱中孵育过夜。然后加入辣根过氧化物酶标记的二抗孵育50 min,细胞核用二氨基联苯胺复染。切片在400倍放大镜下分析,使用Image J软件进行进一步分析。
1.3 统计学分析
数据用GraphPad prism 6.0进行分析并绘图,符合正态分布的计量资料均数±标准差来表示,两组计量资料比较采取t检验,多组计量资料比较用单因素方差分析,组间比较采用Tukey's检验,方差不齐用秩和检验,当P<0.05认为差异具有统计学意义。
2 结果
2.1 利格列汀可以改善DKD大鼠相关指标
与NC组相比,DKD组大鼠表现出尿量、饮水进食量增加的特点,毛发发黄,精神不振,DKD+Linagliptin组上述症状减轻。治疗前DKD、DKD+Linagliptin组大鼠体质量较NC组明显减轻,12周后DKD组体质量下降,DKD+Linagliptin组和NC组体质量增加,NC组增幅更加明显,差异有统计学意义(P<0.05,表1)。与NC组和DKD+Linagliptin组相比,DKD组肾指数、24 h尿量、24 h尿蛋白、24 h尿微量白蛋白、血糖、ALT、AST、BUN、Cr均明显增加,差异具有统计学意义(P<0.05,表2、3)。

表1 治疗前后各组体质量的变化Tab.1 Changes of body weight after treatment in different groups(g,Mean±SD,n=6)
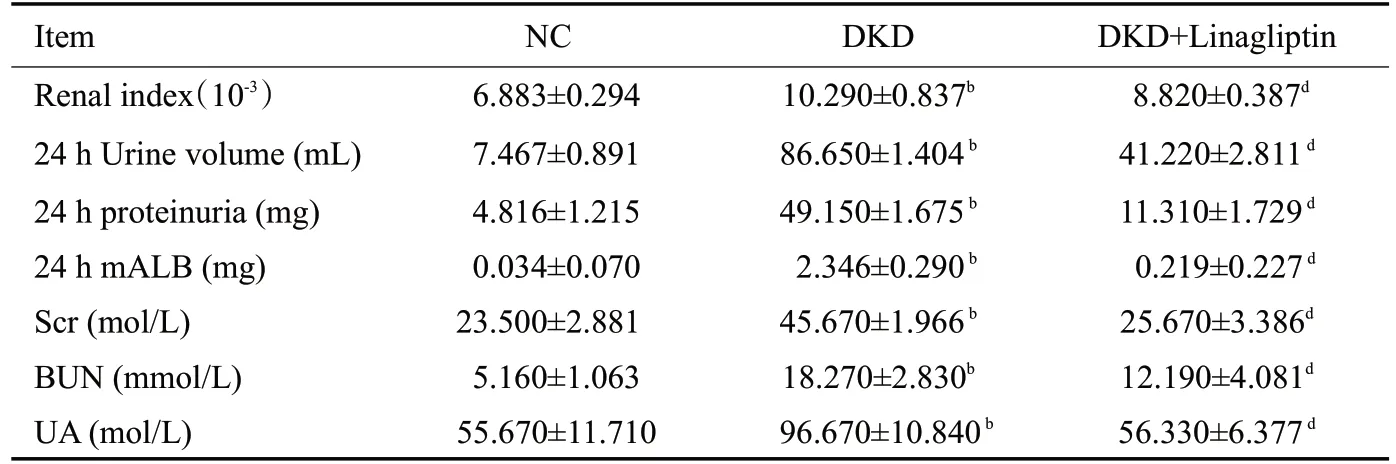
表2 各组大鼠肾功能指标Tab.2 Comparison of renal function in the rats(Mean±SD,n=6)
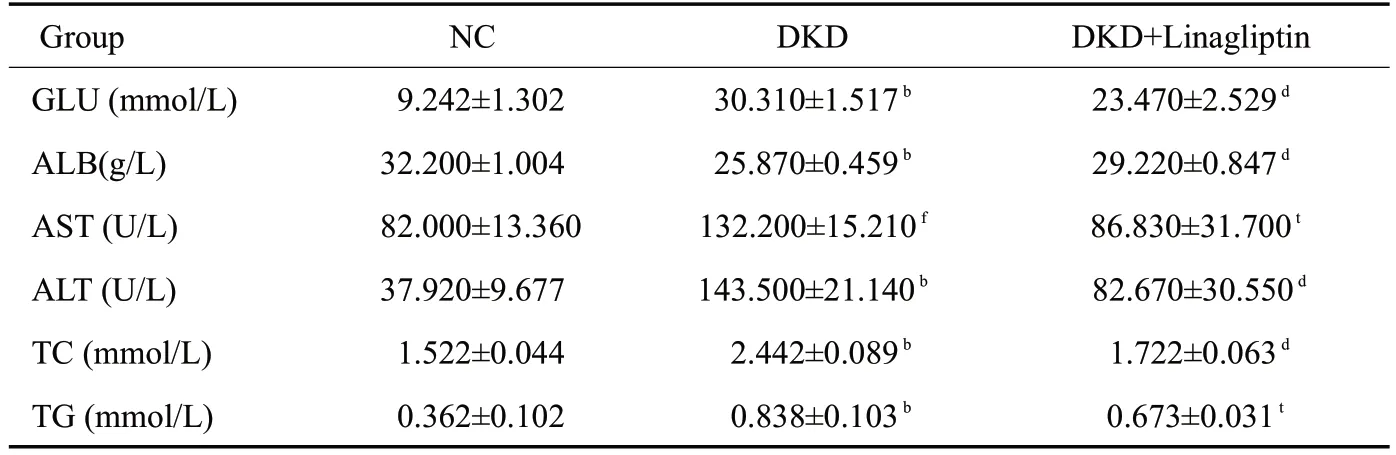
表3 各组大鼠血糖水平、肝功能、脂代谢指标Tab.3 Glucose level,lipid metabolism and liver function in the rats(Mean±SD,n=6)
2.2 利格列汀可以改善DKD大鼠肾脏损伤
HE染色显示DKD组肾小球毛细血管袢肥大,肾小囊腔狭窄呈裂隙状,基底膜轻度增厚,系膜增生,无Kimmelstiel-Wilson(K-W)结节生成。PAS 染色显示DKD组基底膜增厚,肾小球肥大。Masson染色显示的肾间质蓝色条索状物质明显及天狼猩红染色显示的红色条索状物增加,提示DKD组肾组织纤维化增加(图1)。免疫组织化学法也检测到与纤维化相关的TGF-β1、FN、COLⅠ的表达在DKD组(图2、3)明显增加,而这些情况在DKD+Linagliptin组减轻(P<0.05)。

图1 各组大鼠肾脏病理结构变化情况Fig.1 Renal pathology in rats in each group(Original magnification:×400).A:HE staining of the renal tissues.B:Masson staining of the renal tissues.C:PAS staining of the renal tissue.D:Sirius scarlet staining of the renal tissues.
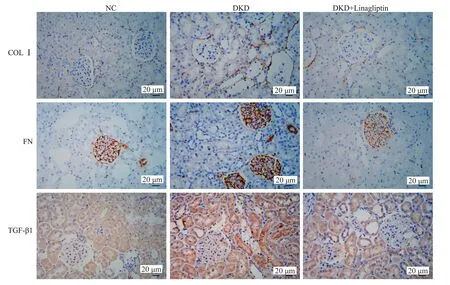
图2 纤维化蛋白在各组大鼠肾脏的表达情况Fig.2 Expression of fibrotic protein in the kidneys of rats in each group detected by immunohistochemistry(×400).

图3 纤维化蛋白在各组大鼠肾脏的表达情况分析Fig.3 Expressions of fibrotic protein in the kidneys of rats in each group.A: COLⅠexpression.B: FN expression.C: TGF-β1 expression.****P<0.0001,***P<0.001,**P<0.01 vs NC,####P<0.0001,###P<0.001,##P<0.01 vs DKD(n=6).
电镜观察到DKD组基底膜增厚,肾小球系膜基质增多,足细胞足突广泛融合,用利格列汀干预后有所缓解。从各组的近端肾小管上皮细胞的电镜图片中看出,NC组线粒体为细长椭圆形,形态清楚,内部嵴突规则完整。DKD组线粒体数量明显减少,线粒体形态遭到破坏,线粒体嵴减少,线粒体中出现空泡,变为棒状或者其他不规则形状,用利格列汀干预后有所缓解,线粒体数量明显增加(图4B、C)。
2.3 利格列汀干预能够有效改善DKD肾脏细胞的线粒体功能紊乱
JC-1测线粒体膜电位和肾脏组织ATP含量测定结果显示,DKD 组膜电位和ATP 含量均低于NC 组(P<0.0001,图5),而利格列汀干预之后则增加。
2.4 利格列汀对AMPK/PGC-1α/TFAM通路的影响
Western blot结果显示AMPK的表达在3组中没有明显差异(P>0.05)。与NC组相比,P-AMPK的表达在DKD组和DKD+Linagliptin组中更低(P<0.05),但是在后两组之间差异,没有统计学意义(P>0.05)。而PAMPK/AMPK 的表达在3 组之间差异明显,NC 组最多,DKD+Linagliptin 组其次,DKD 组最低(P<0.05)。除此之外,相比NC 组,DKD 组中的PGC-1α、TFAM的表达更低,而DKD+Linagliptin组的含量较DKD组高(图6、7)。
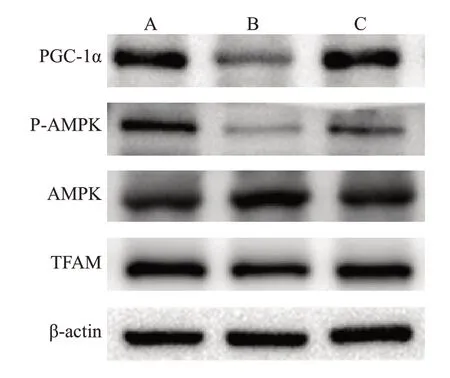
图6 各组大鼠AMPK/PGC-1α/TFAM通道蛋白表达情况Fig.6 Expressions of AMPK/PGC-1α/TFAM in rat kidney tissues detected by Western blotting.A: NC group;B:DKD group;C:DKD+Linagliptin group.

图7 分析各组大鼠AMPK/PGC-1α/TFAM通道蛋白表达Fig.7 Quantitative analysis of Western blotting results of the protein expressions in each group.A-E:Quantitative analysis of AMPK,p-AMPK,p-AMPK/AMPK,PGC-1α and TFAM expressions respectively.NC vs DKD: ****P<0.0001,***P<0.001,**P<0.01,*P<0.05;DKD vs DKD+Linagliptin:###P<0.001,##P<0.01,#P<0.05.
3 讨论
近年来DKD患病率在全球范围内上升,带来的危害大。目前关于DKD发病机制的研究主要集中于过度氧化应激、持续的炎症反应、糖脂代谢异常、肾素-血管紧张素-醛固酮系统激活[13]。然而,当前对DKD肾脏损伤的治疗方法仍然存在局限性,研究糖尿病导致肾脏损伤的机制和探索新的治疗方法尤为重要。在本项研究中,我们通过喂食SD大鼠高脂高糖饮食4周+腹腔内注射STZ+持续高脂高糖饮食12周的方式构建DKD模型后,观察到DKD组与NC组相比肾功能受损,蛋白尿及尿微量白蛋白增加。同时,肾脏病理检查显示肾小球毛细血管袢肥大,肾小囊腔狭窄呈裂隙状,基底膜轻度增厚,系膜增生,肾间质纤维化明显。电镜观察细微结构发现DKD组基底膜增厚,肾小球系膜基质增多,足细胞足突广泛融合并失去其正常结构。这些结果表明糖尿病严重损害了肾脏组织结构及功能,而在DKD+Linagliptin组,上述情况均有所改善,提示利格列汀一方面能够通过降低血糖,改善糖尿病带来的糖脂代谢紊乱,间接改善DKD肾脏损害,另一方面可能通过降低尿蛋白及尿微量白蛋白,减慢DKD的进展。目前已有许多动物实验证明利格列汀在DKD中还具有抗氧化、抗炎、抗纤维化及减轻白蛋白尿的额外肾脏保护作用[14-16]。利格列汀对T2DM大鼠早期具有明显肾保护作用,主要体现在缓解肾小管损伤标记物KIM-1、NGAL、Vanin-1 和尿NAG的增加,防止由肾脏葡萄糖过载引起的氧化、炎症、纤维化和凋亡过程[17]。除此之外,利格列汀还可以在体外及体内实验中改善由游离脂肪酸诱导的近端肾小管上皮细胞中炎症因子MCP-1、IL-6、TNF-α以及纤维化因子PAI-1 mRNA表达水平的增加[18]。在随机临床试验中,利格列汀也被证实能够缓解白蛋白尿增多[19-21]。
肾脏是一个具有极高能量和氧需求器官,肾脏功能与线粒体稳态密切相关[22,23]。近年来,越来越多的研究表明线粒体功能紊乱在DKD的发生发展中扮演重要角色[2-4,24]。代谢组学确定了较低的PGC-1α 基因表达与线粒体生物合成受损有关,也是线粒体功能障碍的重要原因[25,26]。在DKD中,线粒体分裂活跃,呈细小碎裂样分布,而线粒体破裂后其内细胞色素c的释放会促进肾脏细胞凋亡[2];mtDNA的释放会导致cGAS/STING通路的激活,并导致近端肾小管上皮细胞凋亡、炎症、纤维化的发生[27];线粒体活性氧的释放会加重细胞的氧化应激反应,造成进一步损伤[28]。为了探究利格列汀改善DKD肾脏损伤是否与改善线粒体功能相关,我们检测了肾皮质组织细胞的线粒体膜电位变化和ATP含量变化,并且通过透射电镜观察近端肾小管上皮细胞细微结构以及线粒体形态变化。我们观察到,与NC组相比,DKD组膜电位和ATP含量均降低,超微结构显示DKD组近端肾小管上皮细胞中线粒体数量明显减少,线粒体形态遭到破坏,线粒体嵴减少,利格列汀干预后可改善。而已有研究表明肾近端肾小管上皮细胞富含丰富的线粒体,并且由线粒体功能失调导致的肾小管间质纤维化已经是DKD进展为终末期肾脏病的重要决定因素[29,30]。与之相对应的,我们也观察到与NC组相比,DKD组的Masson、天狼猩红染色结果和电镜显示肾间质纤维化明显,免疫组化法显示近端肾小管上皮细胞区域TGF-β1、肾小球上皮细胞区域FN、肾间质区域COLⅠ的表达均明显增加。有趣的是,在DKD+Linagliptin组,上述情况均有所改善。结合相关研究结果,我们推测利格列汀改善DKD肾脏损害的机制可能靶向调节线粒体功能紊乱缓解肾脏纤维化,并且对肾小管上皮细胞功能的改善更加明显。
线粒体常处于动态变化之中,依靠生物合成、融合、分裂、自噬等一系列变化来维持对机体能量的供应。线粒体生物合成是一个依据现存的线粒体,再生成功能齐全的线粒体的过程[31]。其主要与AMPK、PGC-1α 的激活有关。当细胞处于低能量状态即AMP:ATP比值升高时,肾脏中刺激分解代谢的营养传感器——AMPK被激活,AMPK通过促进编码PGC-1α的基因转录蛋白磷酸化以增加其活性,进而诱导线粒体的生物合成[29,32]。PGC-1α蛋白通过上调核呼吸因子1及核呼吸因子2的表达,从而促使线粒体TFAM的生成增加。值得注意的是,TFAM 作为重要的转录因子可以诱导mtDNA 复制、转录以及多种线粒体蛋白的合成,对线粒体生物合成具有重要作用[7,8]。已有研究表明上调PGC-1α、TFAM的表达可以促进近端肾小管上皮细胞线粒体的生物合成和功能,对DKD具有改善作用[33-35]。与之相对的,下调系膜细胞中AMPK/SIRT-1/PGC-1α信号通路,则能够抑制DKD线粒体的生物合成和功能[36]。为了探寻利格列汀对线粒体功能改善的具体途径,我们行Western blot 检测线粒体生物合成相关的蛋白,结果表明与NC组相比,DKD组的P-AMPK/AMPK、PGC-1α、TFAM表达更低,DKD+Linagliptin组的含量较DKD组高。提示DKD组利格列汀可以上调AMPK/PGC-1α/TFAM通路蛋白的表达。结合所有结果推测利格列汀改善DKD可能与该通路有关。
本研究中,我们揭示了线粒体功能紊乱在DKD发病机制中的作用,以及利格列汀调节线粒体功能的可能机制是激活AMPK/PGC-1α/TFAM通路,从而促进近端肾小管上皮细胞中线粒体生物合成,减轻肾脏纤维化,对DKD发挥保护作用。接下来我们将进行体外实验,利用该通路抑制剂及利格列汀干预,验证利格列汀对近端肾小管上皮细胞的具体作用及机制。
