雷帕霉素增强RSL3对睾丸癌细胞I-10的增殖、侵袭与迁移的抑制作用
2024-01-12侯凤伟杜家如童旭辉
李 彬,汪 越,侯凤伟,杜家如,童旭辉
蚌埠医学院药学院/安徽省生化药物工程技术研究中心,安徽 蚌埠233030
睾丸癌是青年人群中最常见的恶性肿瘤[1]。西方国家发病率在过去20年中上升,手术和以顺铂为基础的化学疗法的结合使得睾丸癌患者的治愈率大于90%[2]。尽管如此,10%~20%患有转移性疾病的睾丸癌患者不能通过基于顺铂的化疗治愈[3]。因此,探索治疗睾丸肿瘤的新方法具有研究价值。
铁死亡是一种铁依赖形式的非凋亡细胞死亡,其特征是脂质ROS的积累[4]。在细胞和小鼠中进行的遗传学研究确定硒酶谷胱甘肽过氧化物酶(GPX4)是这种形式的细胞死亡的关键调节因子。GPX4将脂质氢过氧化物转化为脂质醇,这一过程阻止了铁(Fe2+)依赖的有毒脂质活性氧(ROS)的形成。GPX4功能的抑制导致脂质过氧化,并可诱导铁死亡[5,6]。近年来,人们在设计和开发基于铁死亡诱导的抗癌药物方面做了大量工作,在癌症治疗中引入铁死亡具有很好的治疗潜力[7]。RSL3是一种常用的铁死亡诱导剂,通过抑制谷胱甘肽过氧化物酶4(GPX4)造成细胞脂质过氧化物堆积导致铁死亡[8]。在晚期前列腺癌、肝癌以及胶质母细胞瘤中,RSL3可以通过诱导铁死亡的发生发挥较好的肿瘤细胞杀伤作用[9-11]。然而,RSL3能否在睾丸癌细胞I-10中触发铁死亡尚未见报道。
大多数睾丸肿瘤的特征是PTEN的缺失,PTEN是一种负性调节PI3K信号的肿瘤抑制因子,因此睾丸肿瘤中PI3K/AKT/mTOR通路活性异常增强,睾丸肿瘤模型也显示异常增强的PI3K/AKT/mTOR通路[3]。PTEN功能缺失在人类肿瘤中较为多见,肿瘤细胞表现为对铁死亡的抵抗性,抑制PI3K/AKT/mTOR信号轴能使癌细胞对铁死亡诱导敏感[12]。有研究发现mTOR有助于保护心肌细胞免受铁死亡和过量铁的影响[13],雷帕霉素衍生物依维莫司联合RSL3/Erastin在肾细胞癌中表现出协同作用,促进铁死亡[14]。以上研究提示,靶向mTOR结合诱发铁死亡对于睾丸癌的治疗具有一定的临床意义。雷帕霉素是雷帕霉素复合物1(mTORC1)机制靶点的抑制剂,其通过结合FKBP12发挥抑制mTORC1的作用[15,16]。因此,雷帕霉素可能通过抑制mTOR促进RSL3诱导的铁死亡,提高睾丸癌细胞对RSL3的敏感性。为此,本文旨在研究雷帕霉素是否提高RSL3对睾丸癌I-10细胞的抑制作用,并探讨雷帕霉素对RSL3抗睾丸癌I-10细胞活性的影响及其作用机制,为睾丸癌的治疗方法提供新的思路。
1 材料和方法
1.1 主要试剂
RPMI 1640培养基(Biosharp);胎牛血清(杭州四季青);雷帕霉素(RAPA)(MCE);RSL3(Type II)(MCE);谷胱甘肽(GSH)检测试剂盒(南京建成生物有限公司);丙二醛(MDA)检测试剂盒(南京建成生物有限公司);GPX4 抗体(Proteintech);C11 BODIPY 581/591 荧光探针(赛默飞);GAPDH(Proteintech);胰酶(Biosharp)、细胞裂解液(上海碧云天);其他常用试剂均为国产分析级。
1.2 细胞株与细胞培养
小鼠间质瘤细胞株I-10来源于ATCC(Manassas,VA,USA),细胞在含5%CO2的37 ℃恒温细胞培养箱中培养,培养基为RPMI 1640,含10%胎牛血清和1%青霉素-链霉素。
1.3 MTT法检测细胞活力
取对数生长期细胞I-10,以5×104/mL 密度接种于96孔板,待细胞生长至约60%后,更换含药培养液。实验分为单用RSL3组和与雷帕霉素合用组,RSL3浓度分别为0、1、2、4、8、16 μmol/L,雷帕霉素浓度为16 μmol/L。培养24 h 后,添加5 mg/mL MTT 溶液(10µL/孔),在37 ℃的黑暗条件下孵育4 h。弃去培养液后每孔加入100 μL DMSO置于37 ℃烘箱中孵育30 min,酶标仪检测A490值。样品检测全程避光操作。根据公式计算细胞存活率。
1.4 集落克隆形成实验
将细胞以500个/孔接种于六孔板,待细胞紧贴壁以后,用含药培养液培养10 d,药物分组为:Control组、雷帕霉素(16 μmol/L)、RSL3(2 μmol/L)组、雷帕霉素合用RSL3组;显微镜下观察集落数大于50,弃培养液,用PBS清洗2遍,4%多聚甲醛室温固定30 min后,再用0.1%结晶紫室温染色30 min,并拍照。
1.5 划痕实验
将细胞以2×105/孔铺种于6孔板,待细胞生长至约80%时,用200 μL枪头沿每孔中央划一条直线,用PBS清洗去除漂浮细胞,每孔加入2 mL含药无血清培养基继续培养,药物分组为:Control组、雷帕霉素(16 μmol/L)组、RSL3(2 μmol/L)组、雷帕霉素合用RSL3组;分别在培养0 h、24 h用显微镜拍照。计算划痕愈合率。
1.6 Transwell侵袭实验
在Transwell上室内加入50µL基质胶,置于37 ℃恒温箱中孵育30 min,待胶凝固。收集I-10细胞,用无血清RPMI 1640培养基调整为含药的细胞悬液(2×105/mL),药物分组为:Control组、雷帕霉素(16 μmol/L)组、RSL3(2 μmol/L)组、雷帕霉素合用RSL3组;分别取100µL加入上室,下室加入含10%胎牛血清的培养液500µL。每组设置3 个复孔,实验重复3 次;培养48 h 后取出Transwell小室,用PBS清洗两次,然后用4%多聚甲醛室温固定30 min,结晶紫室温染色30 min。采用光学倒置显微镜(×100)下计数侵袭至微孔膜下层的细胞,每个样本观察3个视野。
1.7 Transwell迁移实验
无需在Transwell 上室内铺基质胶,其余步骤同1.6。
1.8 Lipid ROS检测
将细胞以2×105/mL的密度接种于六孔板,待细胞长至60%左右,药物处理24 h。药物分组为:Control组、RSL3(2 μmol/L)组、雷帕霉素(16 μmol/L)组、雷帕霉素合用RSL3组。24 h后弃去含药培养基,用PBS清洗两次,每组加入1 mL含有5 μmol/L的C11 BODIPY 581/591荧光探针的RPMI 1640培养基避光染色。在37 ℃细胞培养箱中孵育30 min后,用无EDTA的胰酶消化细胞并收集至10 mL离心管中,1200 r/min离心8 min,再用PBS离心清洗2次。在细胞沉淀中加入300 μL PBS让细胞重悬,转移至流式管中在激发光为488 nm检测氧化态细胞数量,收集数据并保存文件,使用Flowjo进行数据分析。
1.9 GSH和MDA含量检测
使用谷胱甘肽(GSH)和丙二醛(MDA)检测试剂盒,按照使用说明检测各组细胞中GSH和MDA含量。
1.10 Western blot检测
收集各组细胞,加适量增强型RIPA,冰上裂解30 min后,于4 ℃以12 000 r/min离心30 min,收集蛋白并定量。配制12%SDS-PAGE凝胶。将定量样品上样,电泳,转膜,封闭,孵育一抗,一抗于4 ℃孵育过夜,第2天取出以TPBS清洗3次,10 min/次。二抗于室温孵育2 h,TPBS清洗3次,10 min/次。ECT发光试剂盒暗室发光,显影;Bio-Rad凝胶成像系统采集图像,ImageJ扫描灰度值定量分析。
1.11 统计学分析
使用SPSS 20.0进行统计分析,计量资料表示为均数±标准差,两组之间均数比较采用两样本t检验,两组以上均数比较采用单因素方差分析。统计图采用Graphpad Prism 8.0 绘制,P<0.05 为差异具有统计学意义。
2 结果
2.1 雷帕霉素增强RSL3对I-10细胞增殖的抑制作用
观察RSL3对睾丸癌I-10细胞的抑制作用,结果显示随着RSL3给药浓度的提高,细胞存活率逐渐下降(图1A)。在合用雷帕霉素(16 μmol/L)之后,细胞存活率进一步下降(P<0.01,图1A)。为减少细胞活力对侵袭、迁移的影响,实验中选用低浓度RSL3(2 μmol/L),后续实验包括集落以及铁死亡相关指标检测也选用同样浓度的RSL3。通过集落克隆实验发现,单用RSL3组集落形成数明显低于Control组(P<0.05,图1B);与单用RSL3组相比,雷帕霉素合用RSL3组集落形成数进一步下降(P<0.05,图1B)。
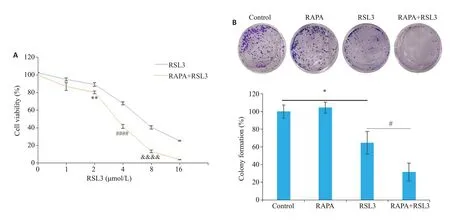
图1 雷帕霉素增强RSL3对I-10细胞增殖的抑制作用Fig.1 Rapamycin enhances the inhibitory effect of RSL3 on I-10 cell proliferation.A:Cell viability assessed by MTT assay.B:Colony formation assay of I-10 cells at 10 days of culture(n=3,**P<0.01 vs 2 μmol/L RSL3,####P<0.0001 vs RSL3,&&&&P<0.0001 vs RSL3).*P<0.05,#P<0.05.
2.2 雷帕霉素增强RSL3对I-10细胞侵袭和迁移的抑制作用
I-10细胞在雷帕霉素(16 μmol/L)、RSL3(2 μmol/L)或雷帕霉素合用RSL3处理后,划痕实验和Transwell迁移实验发现,与Control 组相比,RSL3 组划痕愈合率显著减小(P<0.01,图2A)、穿膜细胞数显著减少(P<0.05,图2B);与单用RSL3组相比,雷帕霉素合用RSL3组划痕愈合率进一步减小(P<0.001,图2A)、穿膜细胞数进一步减少(P<0.01,图2B)。Transwell侵袭实验发现,与Control 组相比,RSL3 组穿膜细胞数减少(P<0.01,图2C);与单用RSL3组相比,雷帕霉素合用RSL3组穿膜细胞数进一步减少(P<0.01,图2C)。
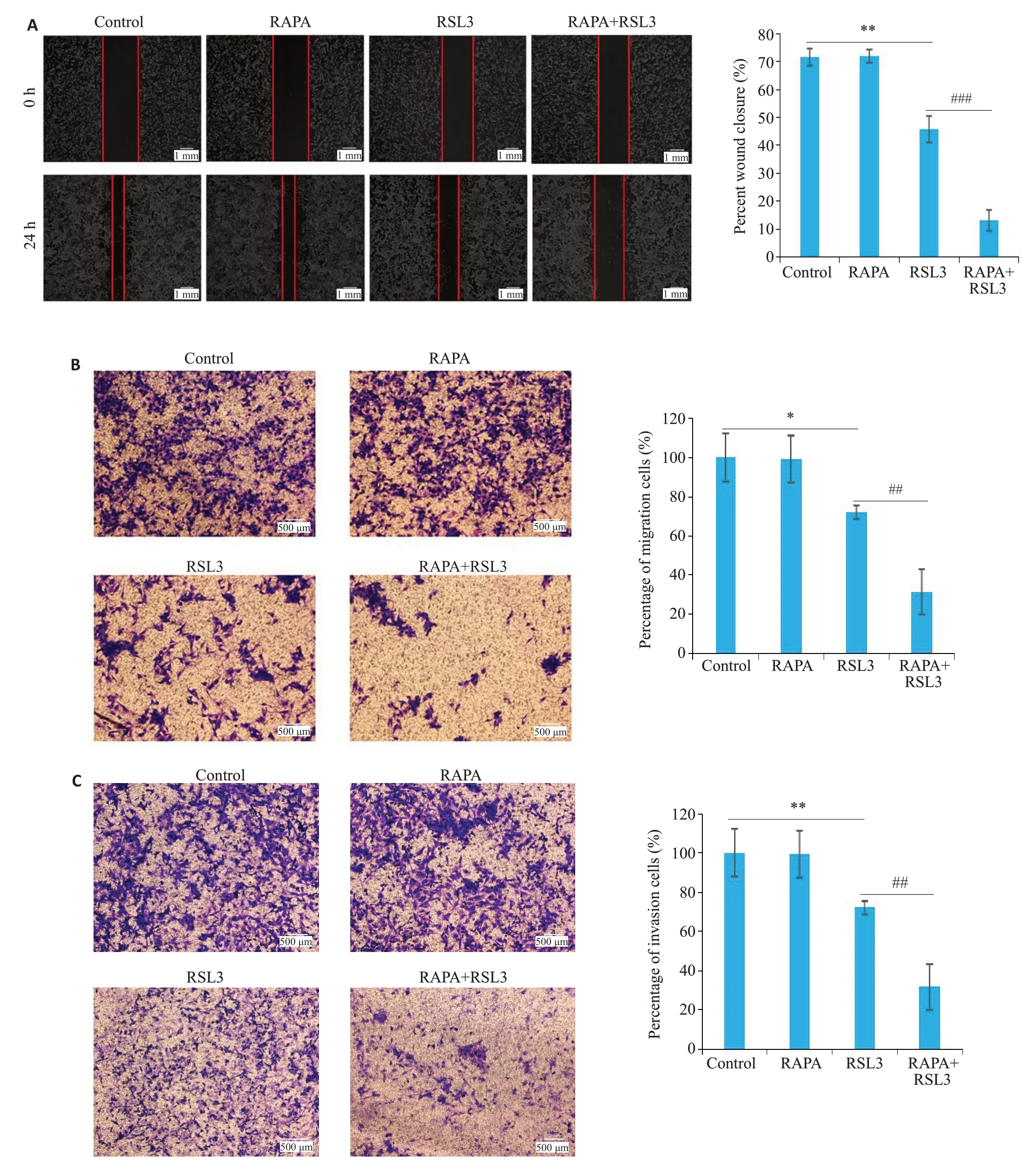
图2 雷帕霉素增强RSL3对I-10细胞侵袭和迁移的抑制作用Fig.2 Rapamycin enhances the inhibitory effect of RSL3 on I-10 cell invasion and migration.A:Wounding-healing assay.B:Transwell assay for assessing migration of I-10 cells.C:Transwell assay for assessing invasion of I-10 cells(n=3,*P<0.05,**P<0.01,##P<0.01,###P<0.001).
2.3 雷帕霉素促进RSL3诱导的I-10细胞铁死亡
I-10细胞经RSL3(2 μmol/L)、雷帕霉素(16 μmol/L)合用RSL3处理24 h后,使用GSH和MDA试剂盒检测发现,与Control组相比,单用RSL3组GSH含量下降(P<0.01,图3A),MDA含量明显升高(P<0.05,图3A);而与单用RSL3组相比,雷帕霉素合用RSL3组GSH的水平进一步下降(P<0.01,图3A),MDA含量升高(P<0.01,图3A);Western blot检测结果显示,与Control组相比,单用RSL3组GPX4的表达水平下降(P<0.01,图3B),而与单用RSL3组相比,雷帕霉素合用RSL3组GPX4的表达水平进一步下降(P<0.05,图3B);C11BODIPY581/591荧光探针处理细胞后,使用流式细胞术检测发现,相比于Control组,单用RSL3组细胞中lipid ROS的表达水平增加(P<0.0001,图3C),而与单用RSL3组相比,雷帕霉素合用RSL3组细胞中lipid ROS水平进一步增加(P<0.05,图3C)。
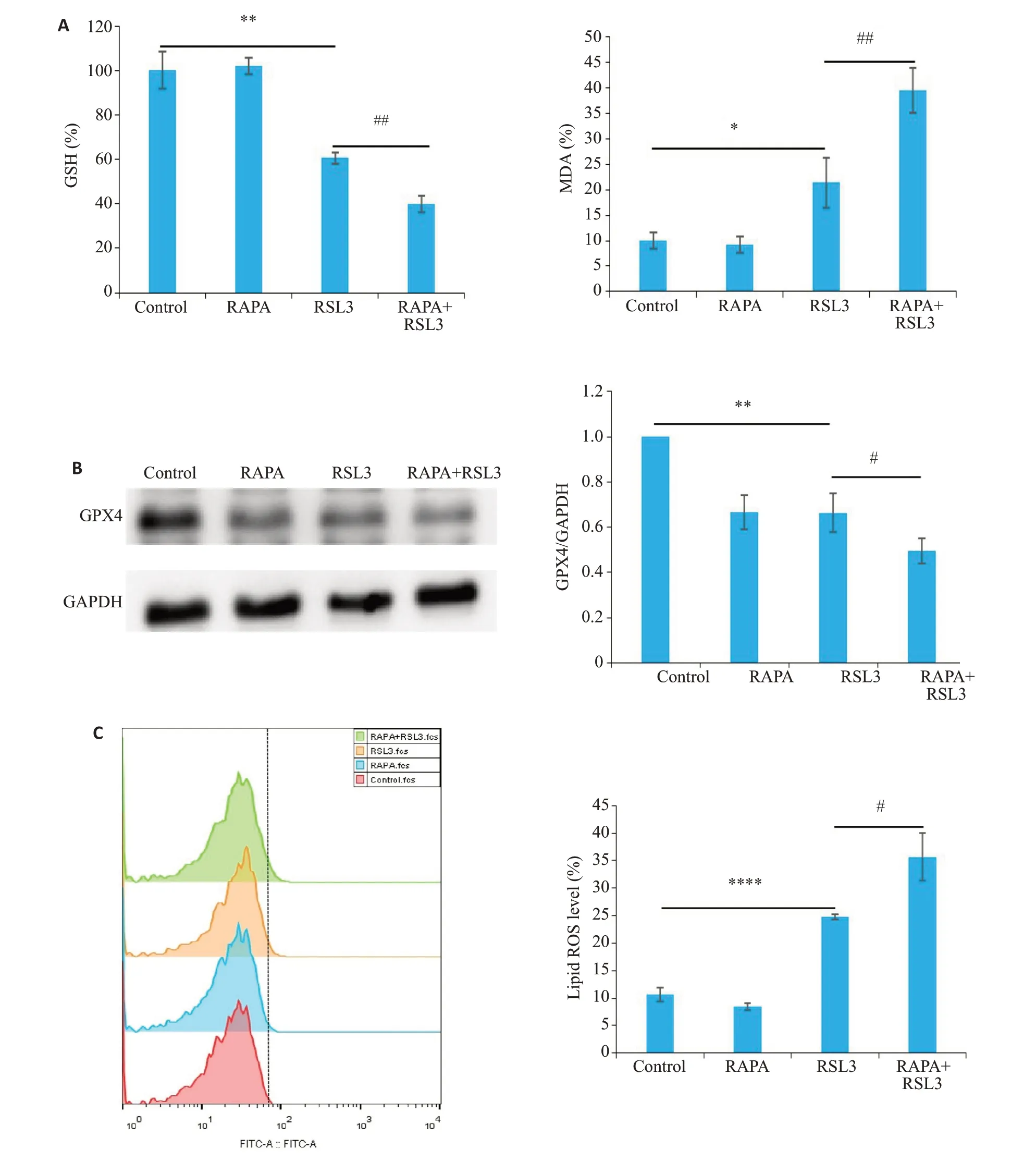
图3 雷帕霉素促进RSL3诱导的I-10细胞铁死亡Fig.3 Rapamycin promotes RSL3-induced ferroptosis in I-10 cells.A:GSH and MDA level.B:Western blotting for detecting the expression of GPX4.C:Cellular lipid ROS level analyzed with flow cytometry(n=3,*P<0.05,**P<0.01,****P<0.0001,#P<0.05,##P<0.01).
3 讨论
睾丸肿瘤是青壮年男性中最常见的肿瘤,生殖细胞肿瘤(TGCTs)占所有睾丸癌的大部分[17]。睾丸癌的基础化疗药物以顺铂为主,然而顺铂的副作用较大、耐药性的产生均限制了疾病的治疗[18]。因此,课题组近年来主要在睾丸癌中,通过诱导细胞的多种死亡形式,以达到更满意的抗肿瘤治疗效果[19,20]。铁死亡是一种由脂质过氧化引起的铁依赖性、非凋亡形式的调节性细胞死亡[21]。生理状态下,细胞内铁离子水平处于动态平衡的状态,然而,癌细胞为了继续生存,积累了大量的铁离子。过量铁离子沉积可以导致膜脂质过氧化反应,以及过度氧化应激,产生大量的脂质ROS[22]。研究表明促进细胞铁死亡可以抑制肿瘤的生长,并提高肿瘤对化学治疗和放射治疗的敏感性[23]。谷胱甘肽过氧化物酶4(GPX4)通过将脂质氢过氧化物转化为无毒的脂质醇来防止铁死亡[24]。GSH作为GPX4的主要辅因子,通过GSH与GS-SG之间的转化,发挥电子供体或受体的作用,在抗氧化应激中发挥重要作用。丙二醛是脂质过氧化产物,其含量在铁死亡过程中逐渐增加[25]。
RSL3是公认的细胞铁死亡的诱导剂,主要通过抑制GPX4的活性来促进细胞的铁死亡[26]。有文献报道,RSL3可通过失活GPX4诱导3种不同的结直肠癌细胞系铁死亡[27,28],也可以在过表达GPX4的非小细胞肺癌中,诱导其发生铁死亡,增加肿瘤对化疗药物的敏感性[29]。然而RSL3能否诱导睾丸癌细胞铁死亡尚未报道。为此,我们将RSL3作用于睾丸癌I-10细胞。本研究通过MTT结果可以看出,RSL3呈浓度依赖性降低睾丸癌细胞I-10的细胞活力。与对照组相比,RSL3能够明显降低I-10细胞的增殖、侵袭与迁移能力,且铁死亡相关指标GSH 水平、GPX4蛋白水平明显降低,Lipid ROS、MDA水平明显升高。这表明,RSL3可以诱导睾丸癌细胞I-10发生铁死亡。
雷帕霉素靶蛋白(TOR)是一种高度保守的丝氨酸/苏氨酸蛋白激酶。研究表明,mTOR可以调节细胞存活、增殖和代谢,mTOR的失调与多种肿瘤相关,如前列腺癌、乳腺癌等[30]。mTOR包括两种蛋白复合物,对雷帕霉素敏感的mTORC1 和不受该药物直接抑制的mTORC2[31]。mTORC1可以通过调节GPX4的表达、自噬发生以及脂质代谢等多种途径影响细胞对于铁死亡的敏感性[32]。且有研究表明,mTOR参与了细胞的铁死亡水平的调控。如阿司匹林通过抑制PIK3CA突变的结直肠癌中mTOR/SREBP-1/SCD1介导的脂肪生成来促进RSL3诱导的铁死亡[33],GYY4137(一种体内外稳定的新型H2S供体)通过抑制mTOR通路促进自噬激活来阻断CLP诱导的肺铁死亡[34]。
雷帕霉素是一种特异性较高的mTORC1抑制剂,通常用作免疫抑制剂,目前已被批准用于治疗人类恶性肿瘤[35]。雷帕霉素是否能在睾丸癌中促进细胞铁死亡,并增强铁死亡诱导剂RSL3的抗肿瘤作用呢?为此,我们将雷帕霉素与铁死亡诱导剂RSL3联合应用于睾丸癌细胞I-10。本研究结果发现,雷帕霉素合用RSL3组相对于单用RSL3组,I-10细胞的增殖、侵袭和迁移能力有显著下降。本研究也检测了铁死亡其他相关指标,结果显示,相对于单用RSL3组,雷帕霉素合用RSL3组,I-10细胞内GPX4蛋白表达明显降低,Lipid ROS水平升高、GSH含量降低、丙二醛含量升高。这些现象表明,雷帕霉素可以促进RSL3诱导的睾丸癌I-10细胞铁死亡。
然而该研究仍有一定的局限性。第一,没有针对于雷帕霉素增强RSL3抗肿瘤作用的机制进一步研究。第二,没有开展相应的动物实验验证。
综上所述,在睾丸癌细胞中,雷帕霉素能够增强RSL3的抗肿瘤作用,该作用与增强了RSL3诱导的细胞铁死亡有关。后续我们将深入研究雷帕霉素在增强RSL3诱导细胞铁死亡水平过程中的具体机制,为睾丸癌的临床治疗提供更多的理论依据。
