非侵入性产前检测对胎儿罕见染色体三体的检测价值
2024-01-12谢潇潇赵青冬胡凌云姜淑芳王晓萍张文玲游艳琴卢彦平
谢潇潇,赵青冬,胡凌云,姜淑芳,王晓萍,张文玲,李 珍,游艳琴,卢彦平
解放军总医院第一医学中心1妇产科,2临检科,北京100853
罕见的染色体三体(RATs)是指除21、18、13号染色体之外的常染色体三体,其嵌合体的发生机制可能是早期着床前胚胎配子减数分裂发生错误后三体/单体自救的结果,或有丝分裂阶段染色体不分离导致[1-3]。罕见的染色体三体的真性嵌合在胎儿期并不多见,但随着产前检测技术的发展,已有越来越多的罕见染色体三体嵌合体被检出。近几年,非侵入性产前检测技术(NIPT)的检测范围由传统的常见染色体非整倍体逐渐拓展为全基因组检测,由此检测出更多的其他染色体异常,包括RATs,给后续的遗传咨询和处理带来很多困难。2022年美国ACMG关于NIPT的指南认为尚没有足够的证据支持NIPT常规用于RATs的筛查[4],但也有研究发现NIPT检测到的RATs与不良妊娠结局有关,认为NIPT是否有益于RATs的检出,NIPT检测到哪种RATs与不良妊娠结局有关,以及嵌合体的百分比是否有助于妊娠风险分层等问题仍需要更多临床数据来进一步评估[5-8]。本研究拟分析本院5年中通过NIPT检出的RATs高风险病例的产前诊断结果及妊娠结局,评估NIPT对RATs的检测价值。
1 资料和方法
1.1 临床资料
选取2019年1月~2023年4月在我院建档的或转诊至我院行非侵入性产前检测提示为罕见的染色体三体高风险的病例,向孕妇及家属进行产前咨询后进行侵入性产前诊断,根据检测结果及超声检查进行产前遗传咨询,所有病例随访妊娠结局。研究已获得孕妇及其家人的知情同意,获得伦理委员会批准(S2019-112-01)。
1.2 染色体核型分析
在超声引导下行羊膜腔穿刺或脐血穿刺,留取羊水20 mL 或脐血2~3 mL,分别放入两个无菌培养瓶中37 ℃培养箱进行培养,收获细胞后行G显带染色体核型分析。使用北昂医药公司的图像分析软件V4.20,镜下分析5~10组核型,至少计数30组分裂相,分别来自两个培养瓶的15个细胞克隆,细胞核型图分析按照人类遗传学国际命名法要求。
1.3 单核苷酸多态性微阵列(SNParray)检测及数据分析
留取7~10 mL羊水使用QIAamp DNA Mini Kit提取试剂盒(QIAGEN,德国)按照标准步骤提取DNA,并测定提取DNA的数量和质量。质控合格(>0.5 μg;A260/A280>1.8;A260/A230>1.5)的样品用于后续SNP array。应用CytoScan 750K Array Kit and Reagent Kit Bundle(Thermo Fisher Scientific)配套试剂和设备进行染色体微阵列分析检测,实验流程包括:DNA 消化和连接、PCR扩增和纯化、定量和片段化、标记、微阵列杂交、洗染和扫描。将数据导入ChAS 4.3(Thermo Fisher Scientific)软件中进行分析,在25 探针/50 Kb 为阈值进行染色体拷贝数变异(CNV)结果的分析,一般报告≥100 Kb 的CNVs,≥10 Mb的杂合性的缺失(LOH)和20%以上的嵌合,参考数据库包括UCSC、OMIM、DECIPHER、DGV、ClinGen和PubMed。
1.4 染色体拷贝数变异测序(CNV-seq)
留取10~15 mL羊水,使用核酸提取试剂盒(鄂汉械备20150250号),参考标准提取SOP进行羊水DNA提取,并对提取质量进行质控,将提取的基因组DNA,通过酶切试剂将基因组DNA进行打断和末端修复加“A”,利用连接酶在DNA 两端加上含标签序列的接头,经PCR扩增纯化进行片段选择,完成单个患者的DNA建库并质控。利用BGISEQ-500测序平台进行测序,并利用测序仪自带的数据处理软件zebracall读出原始测序数据。对所得数据进行质量评估,经过标准化等步骤对数据进行矫正,最后得到最终的CNV结果。下机数据使用SOAP比对到人类参考基因组(hg19)上,通过统计算法进行CNV 变异分析,得到变异分析结果,结合OMIM、HGMD、DGV等数据库对变异结果进行解读判定。
1.5 间期荧光原位杂交(FISH)
使用雅培公司的探针试剂盒,探针定位于7p11.1-q11.1(绿色);2p11.1-q11.1(绿色);14qte 14q32.3-(红色);3p11.1q11.1(红色);15p11.1q11.1(红色)。取新鲜羊水10 mL,经过离心固定后,根据探针数目确定杂交区,制片并烤片后进行杂交与染色,镜检使用图像分析软件Cytovision,羊水病例每杂交区至少计数30个细胞;如遇到低比例嵌合情况需相应加大计数。
1.6 非侵入性产前检测(NIPT)
抽取5 mL 孕妇外周血经双重离心法处理得到DNA溶液。所得cfDNA质控合格后,使用NIFTY®全因1.0试剂盒(华大基因)进行文库制备,将纯化后的DNA文库,进行浓度质控,质控要求每个文库>2 ng/μL。将DNA文库按比例混合准备上机进行测序,然后使用BGISEQ-500高通量测序仪进行测序。测序数据质控和去接头后,样本下机fastq 数据与hg19 的人类参考基因组进行比对,采用Z 检验判断待检样本与正常样本是否存在显著性差异,来判断是否存在染色体非整倍性。
2 结果
2.1 NIPT检出的RATs的基本情况
共25282例孕妇进行NIPT,检出56例(0.22%)罕见的染色体三体高风险,其中7号染色体检出率最高(45%,25/56),其次为3号染色体(11%,6/56),2例病例同时存在两种染色体三体高风险(表1)。所有病例的平均年龄为31.8岁,其中34%(19/56)为高龄孕妇。经过产前咨询后,45例接受侵入性产前诊断,1例因胎死宫内引产后进行遗传学检测;52例已随访到妊娠结局,3例目前在妊娠期,1例失访(图1)。

图1 NIPT检出RATs高风险病例基本情况Fig.1 High-risk cases of RATs detected by NIPT.

表1 NIPT检出的RATs高风险的病例数Tab.1 Number of high-risk cases of rare autosomal trisomies(RATs)detected by NIPT
2.2 胎儿真性嵌合病例及其妊娠结局
获得遗传学检测结果的46例病例中,45例采集羊水进行了染色体核型分析与染色体微缺失微重复检测(SNParray/CNV-seq),1例引产后组织进行染色体微缺失微重复检测,怀疑胎儿真性嵌合的病例均经过两种以上的检测方法进行验证。10例为胎儿真性嵌合病例(表2),阳性预测值(PPV)为22%(10/46),7号染色体胎儿真性嵌合PPV为10%(2/20)。足月分娩4例,随访新生儿结局良好(随访2月~3年),分别为T3嵌合2例、T7、T14嵌合各1例,嵌合比例6%~15%。5例选择终止妊娠,分别为T2、T7、T10、T12、T15嵌合各1例(表2,病例1,5,7,8,10),嵌合比例16%~88%,其中T2、T10嵌合胎儿存在超声结构异常,分别为:T2嵌合胎儿“草莓头“,双胆囊,胎儿生长受限(FGR);T10嵌合胎儿鼻骨缺失、唇裂、单脐动脉和心脏畸形;T15嵌合存在母源单亲二体(UPD)(表2a)。1例T3低比例嵌合病例(1%~7%)仍在妊娠期(表2,病例4),超声未见异常,咨询后决定继续妊娠。共6例获得胎盘进行验证,均存在不同比例的嵌合细胞系(表2,病例1,3,5,6,9,10)。
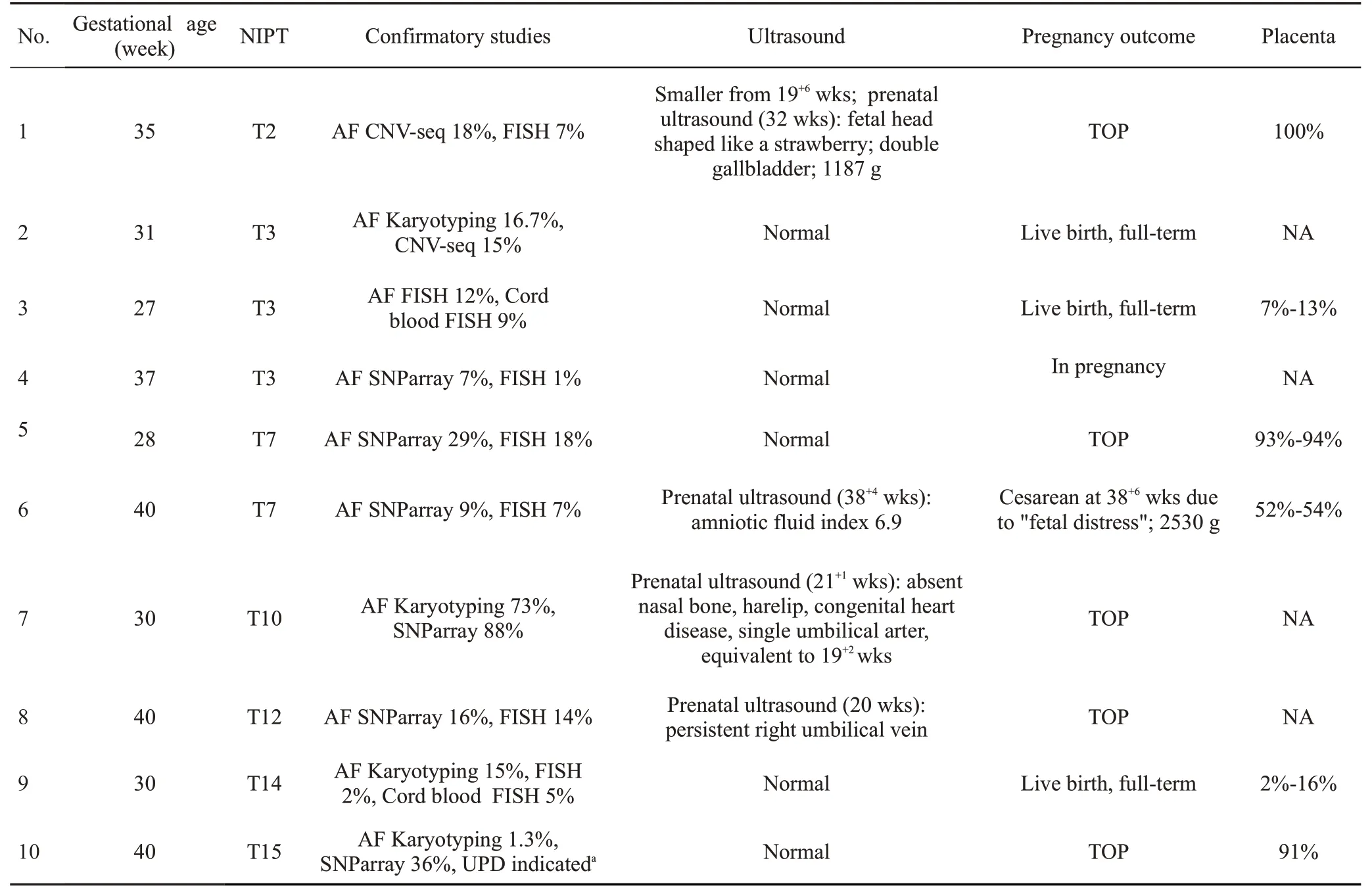
表2 胎儿真性嵌合病例Tab.2 Data of cases of true fetal mosaicism
2.3 非真性嵌合病例及其妊娠结局
胎儿遗传学检测未发现嵌合细胞系的36例病例中,35例获得妊娠结局,1例在妊娠期(表4,病例41)。35例获得妊娠结局病例中27例妊娠结局良好,8例发生不良妊娠结局,分别为3、6、7、11、16号染色体异常。3号染色体异常病例(表4,病例34),因脐带因素孕20周胎死宫内。11号染色体异常病例(表4,病例43),孕25+2周超声体质量414g(<P1),选择致死性引产,胎盘验证为44%T11限制性胎盘嵌合(CPM)。16号染色体异常的2例病例(表4,病例47,48)均发生严重的胎儿生长受限(体质量<P1),生后转NICU;其中病例48孕34+5周合并重度子痫前期、妊娠期肝内胆汁淤积、肝功能损伤、胎盘早剥、凝血功能异常,紧急剖宫产终止妊娠,出生体质量1680 g;病例47合并妊娠期肝内胆汁淤积、肝功能损伤,37+4周剖宫产,出生体质量1550 g,此例胎盘验证为完全性的T16 CPM。7号染色体异常的3例病例(表3,病例13,23,25)中,病例13孕30+5周因脐血流阻力增高、胎心减速紧急剖宫产,新生儿出生低体质量1080 g(<P1),合并尿道下裂,生后转NICU,胎盘验证存在14%T7;病例23孕35周无诱因胎盘早剥紧急剖宫产,生后转NICU;病例25孕36周自发早产剖宫产。6号染色体异常病例(表4,病例39),合并妊娠期高血压,38+2周因“羊水过少,胎心减速”紧急剖宫产,新生儿出生低体质量2200 g(<P1),生后转NICU。不良妊娠结局比例23%(8/35)。
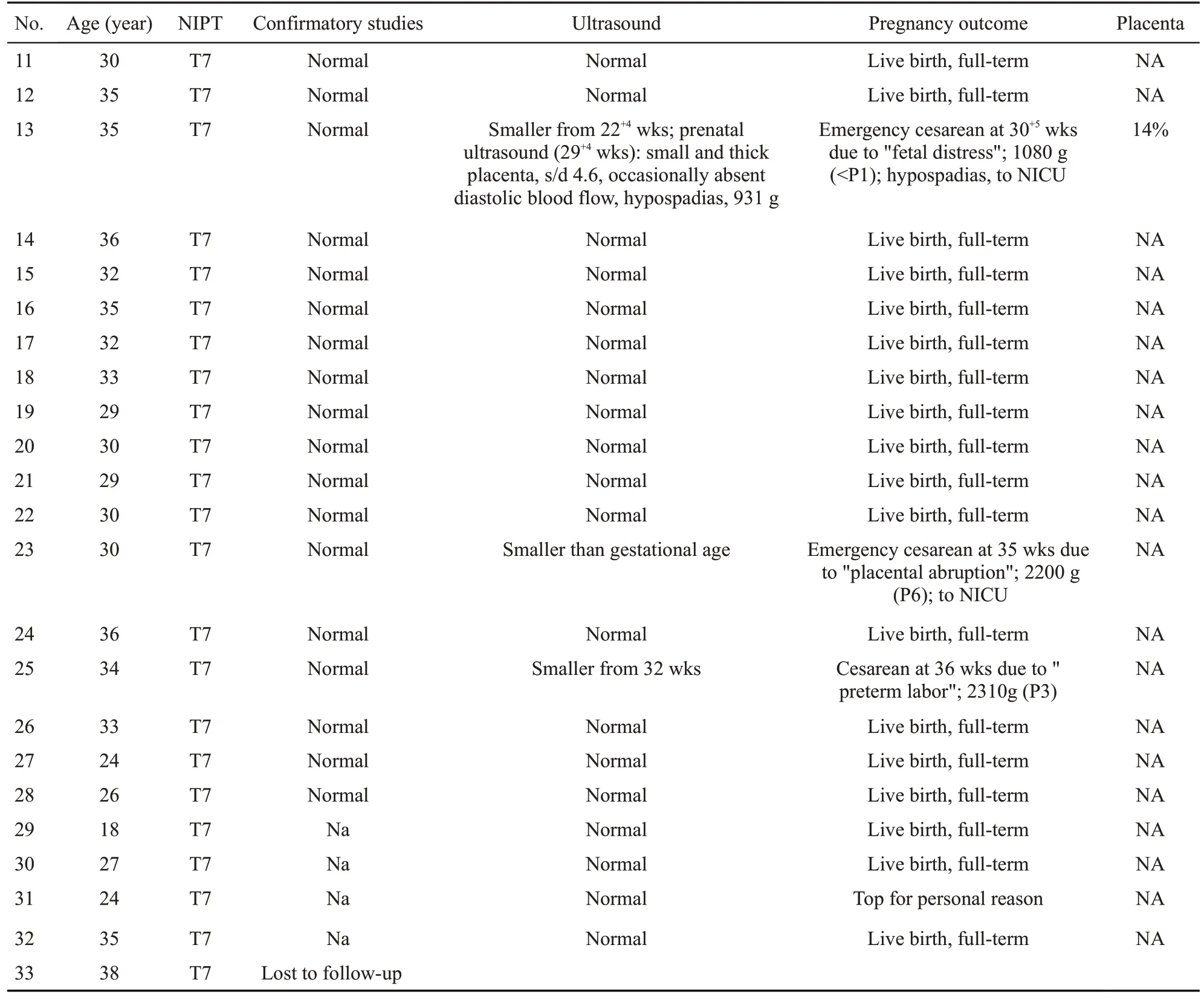
表3 NIPT检出T7高风险病例的遗传学检测结果及妊娠结局Tab.3 Genetic results and pregnancy outcomes of cases with T7 high-risk detected by NIPT
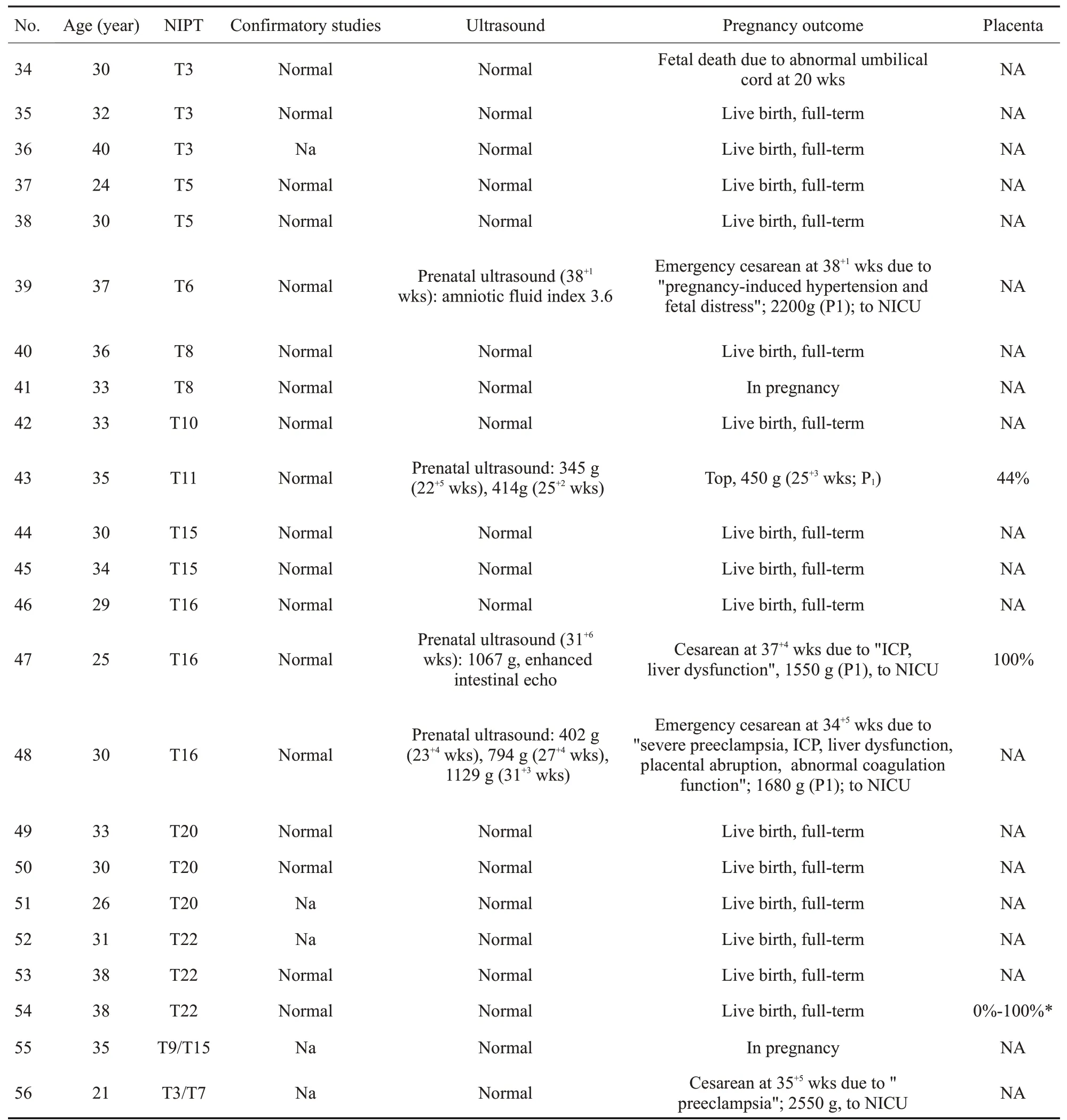
表4 NIPT检出其他RATs高风险病例的遗传学检测结果及妊娠结局Tab.4 Genetic results and pregnancy outcomes of cases with other RATs high-risk detected by NIPT
2.4 未获得遗传学结果的病例及其妊娠结局
未获得遗传学检测结果共10例,8例获得妊娠结局,其中1例同时存在3号和7号染色体异常(表4,病例56)合并轻度子痫前期,35+5周早产,新生儿体质量2550 g,生后转NICU,另1例7号染色体异常(表3,病例31)咨询后选择直接致死性引产,余6例妊娠结局良好。
3 讨论
NIPT是基于母血中的胎儿游离DNA(cfDNA)片段的非侵入性产前检测,目前在临床上广泛应用于常见的染色体非整倍体的筛查,随着生物信息学算法的不断改进,NIPT筛查范围逐渐扩展至全基因组检测,因此检出了更多的其他染色体异常,其中包括罕见的染色体非整倍体[7,9]。罕见的染色体完全三体一般在孕早期胚胎停育或流产[10],因此,孕中期NIPT检出的RATs高风险病例通常为嵌合体。染色体三体嵌合体包括胎儿真性嵌合体(TFM)和CPM。母血中的cfDNA片段来自于凋亡的滋养细胞,其来源与绒毛细胞相似,因此NIPT可以反映细胞滋养层的遗传结构[9,11,12],但无法区分TFM和CPM,只能通过侵入性产前检测来明确。目前评估NIPT对罕见的染色体三体嵌合体的检测价值的研究较少。
本研究总结了本院近5年NIPT检测出的RATs高风险的数据,RATs 检出率为0.22%,较Zhang 等[13](0.36%)及Raymond等[14](0.39%)的研究略低;检出异常的染色体包括2、3、5、6、7、8、9、10、11、12、14、15、16、20,其中7号染色体检出例数最多(45%),与其他研究的结果相似[6,13,14],其次为3号染色体11%,其余染色体检出病例数不多,1、4、17、19号染色体未检出;多数病例检出一种染色体异常,也有少数病例同时检出两种染色体异常。获得胎儿遗传学检测结果的46例中,TFM共10例,PPV为22%,显著低于常见的染色体21、18、13三体的PPV[4,12]。本研究共获得10例胎盘进行多点验证,其中6例TFM病例,4例非TFM病例,结果均提示胎盘存在不同比例的嵌合细胞系,证实了NIPT对于胎盘中存在的罕见染色体三体嵌合具有一定的检测效能,因此,当侵入性产前诊断未提示TFM时,存在CPM的可能性较大,这也可以解释研究中RATs 阳性预测值较低的现象。
RATs的TFM比较罕见,其临床结局的严重程度因嵌合发生的时间、发生的部位、在关键组织中的分布、印记基因以及异常细胞的数量不同而不同[1,15]。在产前诊断中,可以使用多种检测手段检测样本的嵌合细胞比例,本研究10例TFM均使用两种以上的检测方法进行验证,妊娠结局良好的4例病例均为低比例嵌合,超声未发现异常,经过充分的产前咨询后选择继续妊娠,随访妊娠结局良好,而不良妊娠结局的发生主要与超声异常和UPD相关;6例留取胎盘进行检测,证实均存在胎盘嵌合。本研究检出的真性嵌合病例50%为没有高危因素的低龄孕妇,因此NIPT能够在一定程度上增加没有高危因素孕妇的TFM的检出。在本研究中虽然获得良好妊娠结局的均为低比例嵌合病例,但产前能够获得的胎儿样本来源非常有限,因此不能仅用嵌合比例来判断胎儿表型的严重程度及预后,此类病例需结合有经验的超声科医生的产前超声筛查进行评估,并对孕妇及家属进行充分而慎重的产前咨询后进行决策。
Zhang等[13]对97例RATs假阳性的病例中的81例进行了随访,37例发生不良妊娠结局,其中小于胎龄儿、生长受限和早产的发生率较高。Lin等[6]的研究发现,与对照组相比,NIPT显示16-三体、22-三体、9-三体和2-三体的孕妇发生不良结局的风险更高,包括早产、流产和超声异常。Xiang等[16]的研究也认为,RATs假阳性的病例仍处于不良妊娠结局的高风险中,特别是NIPT显示16三体和15三体的孕妇。本研究中除真性嵌合之外的病例共43例获得妊娠结局,发生不良妊娠结局10例,发生率为23%,6例新生儿生后转NICU治疗。最常见的为胎儿生长受限(FGR),共7例,且程度均较重,见于6、7、11、16号染色体异常,其中5例体质量小于第一百分位数;最早出现严重FGR的为T11 CPM的病例,孕22+5周胎儿体质量即小于P1,孕妇选择致死性引产。5例病例早产,其中自发性早产1例(7号染色体),治疗性早产4例,7例活产病例均行剖宫产终止妊娠,其中紧急剖宫产4例(6、7、16号染色体),孕周最小的一例为T7 CPM的病例,孕30+5周即因出现严重的胎盘功能下降,FGR、胎心减速而行紧急剖宫产终止妊娠。5例病例发生妊娠期合并症或并发症,如妊娠期高血压疾病、肝功能损伤、胎盘早剥等,见于6、7、16号染色体,以及1例3、7号两种染色体异常病例。既往已有不少研究发现,T16 CPM病例通常与不良妊娠结局有关,常见FGR、胎儿结构性异常及先兆子痫[17-19]。本研究2例16号染色体异常病例除发生FGR,孕晚期均出现母体肝功能损伤,胆汁酸升高,其中1例孕37+4周剖宫产,胎盘验证为T16 CPM,另一例病例孕33+2周时出现肝功能损伤未重视,孕34+5周重度子痫前期,发生胎盘早剥及凝血功能异常而行紧急剖宫产,但此例未获得胎盘组织,不排除与T16 CPM有关。CPM引起不良妊娠结局的机制还不清楚,有研究发现CPM中胎盘梗死和蜕膜血管变化的比例与正常胎盘相比几乎翻倍,认为可能是染色体异常导致胎盘局部功能失调[20]。与普通孕妇人群相比,CPM病例子痫前期和低出生体质量的风险显著增加,且排除T16 CPM之后仍具有显著意义[21]。根据本研究的数据,虽然NIPT对于TFM的检测PPV不高,但NIPT提示罕见染色体异常的病例仍有可能发生较严重的妊娠合并症或并发症,尤其是存在CPM时,较常见的为FGR和早产,FGR常为首发表现,因此,对于此类病例需重视和加强妊娠期的监测与管理,及时干预。
在既往多项研究中,7号染色体异常是NIPT检测中最常检出的罕见的染色体非整倍体异常,本研究中亦是7号染色体异常病例检出最多,近一半(45%)的RATs高风险病例均为7号染色体,筛查阳性率为0.099%,但PPV仅为10%,随访完整的22例中,82%病例妊娠结局良好。7号染色体携带印记基因,如果三体是减数分裂错误导致,三体自救后可能存在UPD而影响新生儿预后[22-24]。然而,在Benn等[25]的研究中,93例CPM7没有一例检出UPD7,Zhu等[26]的研究也认为,大多数7号嵌合三体形成的原因不是三体自救,胎儿存在UPD7的风险低。本研究未能对所有7号染色体三体高风险的病例进行UPD检测,仅在活产的1例T7 TFM病例和1例T7 CPM病例中排除了UPD7,活产的21例新生儿均未发现UPD7相关异常表现。
本研究中进行侵入性产前检测的病例年龄小于35岁约占67%,NIPT在一定程度上增加了低危孕妇侵入性产前检测的需求,而且,NIPT检测结果给孕妇及其家庭带来的心理焦虑不容忽视[27],本研究有1例孕妇仅因NIPT结果提示7号染色体异常而自行直接选择孕中期致死性引产。因此,对于NIPT检出RATs高风险的结果的咨询需谨慎,且还需要更多的研究来权衡侵入性产前检测对于此类病例的利弊。
综上所述,非侵入性产前检测技术的发展增加了胎儿罕见染色体三体真性嵌合病例的检出,在一定程度上避免了此类缺陷儿的出生,但阳性预测值不高,与限制性胎盘嵌合现象有关。当侵入性产前检测未提示胎儿存在嵌合细胞系,大部分病例预后良好,尤其是7号染色体,但仍有发生母儿不良妊娠结局的风险,最常见为FGR及早产,FGR常为首发表现。因此,当NIPT检出RAT高风险,应向孕妇进行相应的产前咨询以减轻其焦虑,同时结合侵入性产前诊断结果及超声随访对胎儿预后进行评估,加强妊娠期监测和管理能够使这部分孕妇获益;对于未行NIPT的孕妇,孕中晚期发现FGR,如侵入性产前检测未提示异常,可以补充NIPT 协助查找FGR原因。
