兔VX2 移植瘤内间质液压的分布异质性
2024-01-12陈丽萍柳建华黎昱材陈俏利何杨成冯玉仪翁沛华胡志文
陈丽萍 柳建华 黎昱材 陈俏利 何杨成 冯玉仪 翁沛华 胡志文
广州市第一人民医院超声医学科(广东广州 510180)
目前恶性肿瘤被认为是严重危及人类健康的主要疾病之一,如何做好肿瘤的预防和治疗显得特别重要。已有文献表明,肿瘤内的间质液压(interstitial fluid pressure,IFP)升高会严重影响多种传统治疗方法的效果[1]。IFP可导致各种有效药物在肿瘤内分布的差异性,干扰肿瘤内缺氧的发生、发展,进而降低各种化学治疗(化疗)药物和放射治疗(放疗)的疗效[1-3]。然而大多数实体肿瘤内部的IFP因肿瘤内微环境的复杂多变可能会呈现出不均质,存在着异质性。本研究通过建立新西兰大白兔的皮下浅肌层VX2移植瘤模型,通过针芯法(wick-in-needle method,WIN法)测量VX2移植瘤内部不同区域的IFP,探索肿瘤内部不同区域的IFP分布异质性,为今后肿瘤的治疗新途径提供可靠依据。
1 材料与方法
1.1 实验动物
由广东省实验动物中心提供的健康新西兰兔(体质量2.0~2.5 kg)41只。实验全过程均严格按照NIH(National Institute of Health)实验动物护理和使用指南进行操作,经过广州医科大学实验动物伦理委员会许可。
1.2 主要实验相关仪器与材料
1.2.1 微泡:脂氟显脂质包膜微泡悬浮液,超声造影成像:0.01 mL/kg。
1.2.2 彩色多普勒超声诊断仪:GE E9,高频线阵探头ML6-15,具备超声造影模式及时间-信号强度曲线(Time Intenamic Curve,TIC)定量分析软件。调节检查诊断深度、增益、聚焦深度、时间增益补偿(Time Gain Compensation,TGC)等设置,造影模式机械指数(Mechanical Index,MI)为0.11。
1.2.3 生物信号采集与分析系统:成都泰盟软件有限公司研制,型号BL-420S。压力传感器型号:FT-100S。
1.3 实验方法
1.3.1 动物模型制备 健康新西兰大白兔,称重后以复合麻醉(速眠新Ⅱ联合戊巴比妥钠)方法麻醉。待动物角膜反射基本消失、处于麻醉状态后,侧卧位固定于实验台上,左后肢备皮。取VX2肿瘤组织块用眼科剪剪碎至粒径约1 mm,置于含生理盐水的一次性培养皿中形成悬液,使用注射器抽吸1~2粒肿瘤组织块,快速注入兔子左后肢浅肌层[距体表(2.5±0.5)mm]。所有操作过程遵循无菌操作原则,待肿瘤长至长(13±0.2) mm、宽(6±0.2)mm,超声检查未见肿瘤内钙化形成及超声造影见造影剂充盈良好,无充盈缺损者方可纳入实验[4]。
1.3.2 超声造影CEUS及结果分析 所有荷瘤兔的肿瘤需通过二维超声及彩色多普勒模式扫查获取基本信息(如肿瘤大小、有无坏死钙化、血供等),且对肿瘤进行分区(以肿瘤半径的1/2作为肿瘤中心区域,半径的1/2~1/4处为外周1/2区域,半径1/4外侧为外周1/4区域),符合条件者进行超声造影(Contrast-Enhanced Ultrasonography,CEUS)及分析。GE E9彩色多普勒超声诊断系统设置超声造影(Contrast)模式,机械指数为0.11,调节好适宜的检查深度、增益、聚焦深度、TGC等设置。经兔耳缘静脉以团注方式注入微泡,2 mL生理盐水冲管的同时开始对肿瘤进行超声造影,获取并录制动态影像1 min。
1.3.3 肿瘤内不同区域的IFP测量 WIN法也称针芯法,是IFP的常用测量方法之一,能测量来自组织深部如肿瘤组织中的压力。
本实验测量时,在超声引导下穿刺针从肿瘤中心区域缓慢退至肿瘤外周区域继而退至肿瘤周围正常组织,对肿瘤的中心区域、外周1/2区域、外周1/4区域的IFP进行连续测量并记录。穿刺针在超声引导下测量VX2移植瘤IFP值见图1。肿瘤IFP值由BL-420S生物机能实验系统采集并分析。
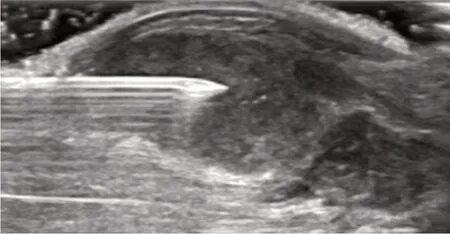
图1 超声引导下IFP 值测量(中央)
1.3.4 HE染色 予实验兔安乐死后取肿瘤组织浸泡于甲醛固定液中,随后行HE染色,光镜下观察肿瘤的病理学改变。
1.4 统计学分析
采用SPSS 24统计软件进行数据统计并分析。VX2移植瘤内不同区域的IFP值经检验呈正态分布,采用均数±标准差(±s)的形式表示,3组间比较采用方差分析,若组间差异有统计学意义,进一步采用LSD-t法进行两两比较,P<0.05认为差异有统计学意义。
2 结 果
2.1 超声的视觉观察评价
超声显示肿瘤内未见钙化形成,其内及周边见点条状血流信号,超声造影显示肿瘤内可见微泡快速进入,并完全均匀充填于内,未见充盈缺损现象(图2),符合上述条件的41个肿瘤可纳入本实验。
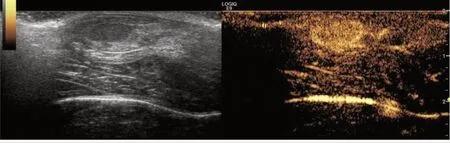
图2 VX2 移植瘤二维超声图及超声造影图
2.2 肿瘤内IFP的变化
在超声引导下进行测压操作,当测量装置的穿刺针置于肿瘤中心位置并稳定时,肿瘤IFP测值时的波形曲线均表现为正向的波形曲线,当穿刺针在超声引导下逐渐缓慢水平外移至肿瘤边缘时(在外周1/2、1/4稍停留以测压),波形曲线呈平直曲线(中央区域、停留在外周1/2、1/4时)后下降并接近基线;当穿刺针位于肿瘤周缘组织时,曲线呈负向的平直波形曲线(图3)。
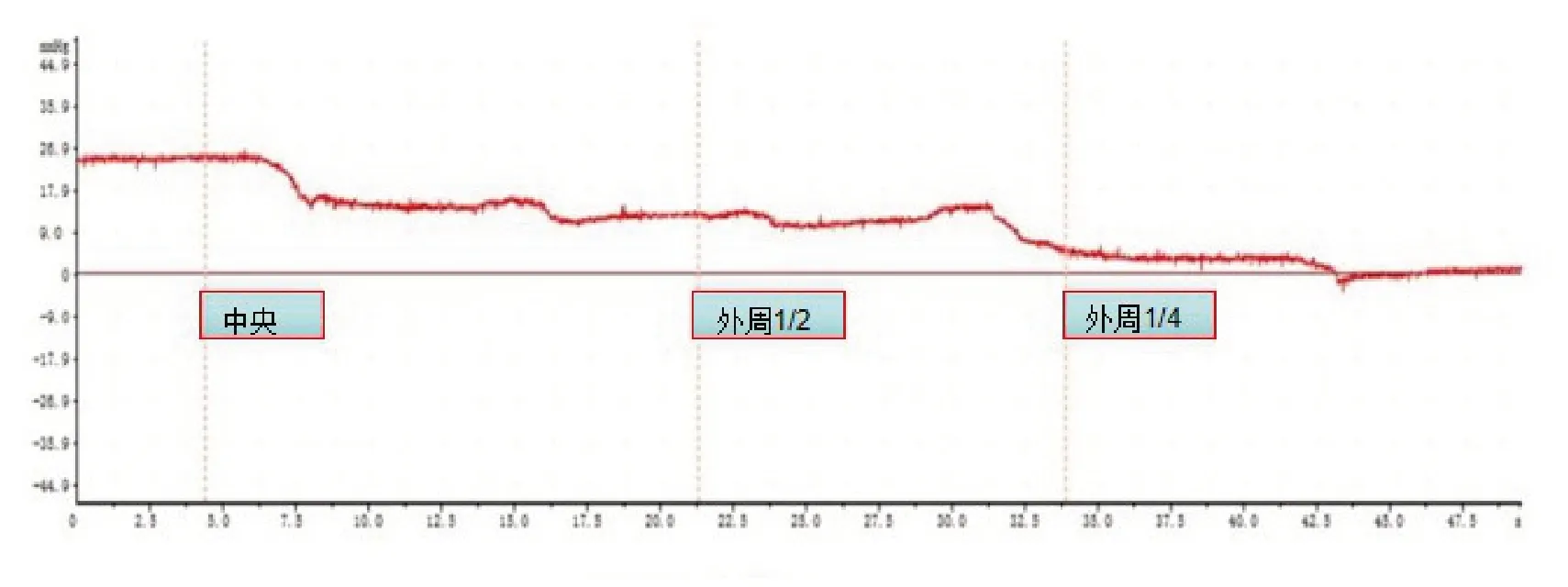
图3 VX2 移植瘤内IFP 曲线图
2.3 HE染色
肿瘤内不同区域组织的HE染色病理结果见图4,可见肿瘤组织呈巢状分布,血管和纤维组织等交错分布在癌巢之间,癌巢内可见大小不等的肿瘤细胞分布紊乱,核大而深染,核异型性明显,有些甚至可见处于不同增殖期的肿瘤细胞,癌巢间及肿瘤内可见血管穿行,形态可辨,呈分支状或囊状,其内可见红细胞分布于管腔内,图4A、B、C可见图上显示的血管数量依次增加,血管周边均未见明显红细胞溢出及未见血栓形成,即肿瘤组织经穿刺测量后,未见血管损伤改变。
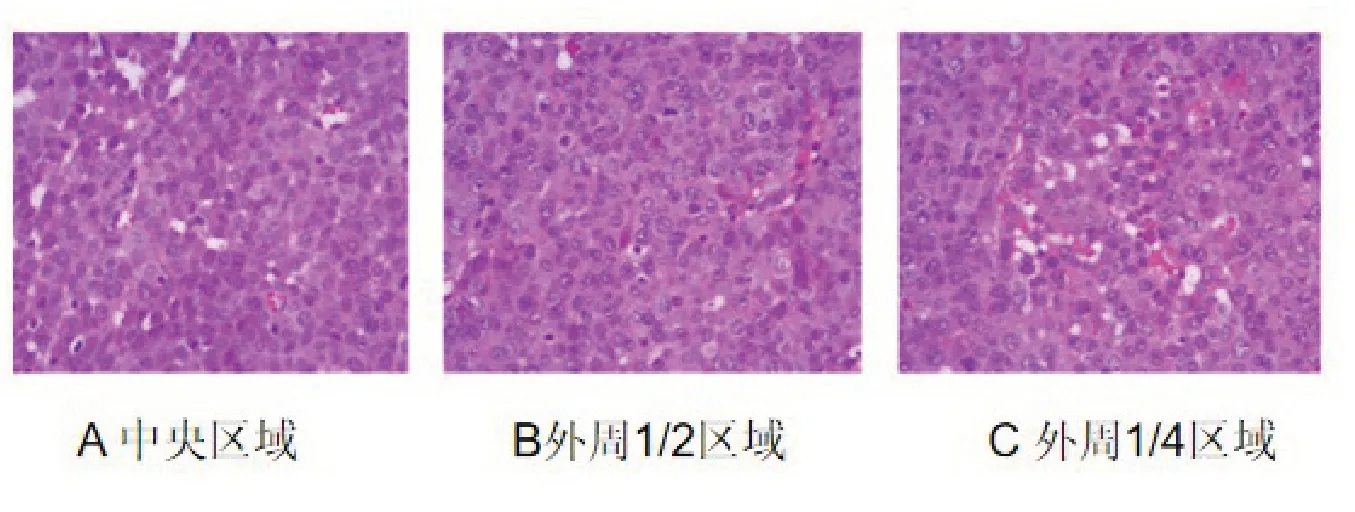
图4 VX2 移植瘤的HE 染色(20X)
2.4 定量分析
4 1 只V X 2 移植瘤的中央I F P为(2 3.7 9±8.07) mmHg,当穿刺针逐渐外移至1/2区时IFP为(15.58±5.22)mmHg,穿刺针继续外移至1/4区时IFP为(8.29±3.47)mmHg,3组间IFP比较差异有统计学意义(F=70.85,P<0.05)。进一步进行两两比较,中央的IFP值高于外周1/2、外周1/4,外周1/2 IFP值高于外周1/4,即从中央到外周,IFP呈梯度显著降低(P<0.05),比较差异均有统计学意义。见表1、图5。
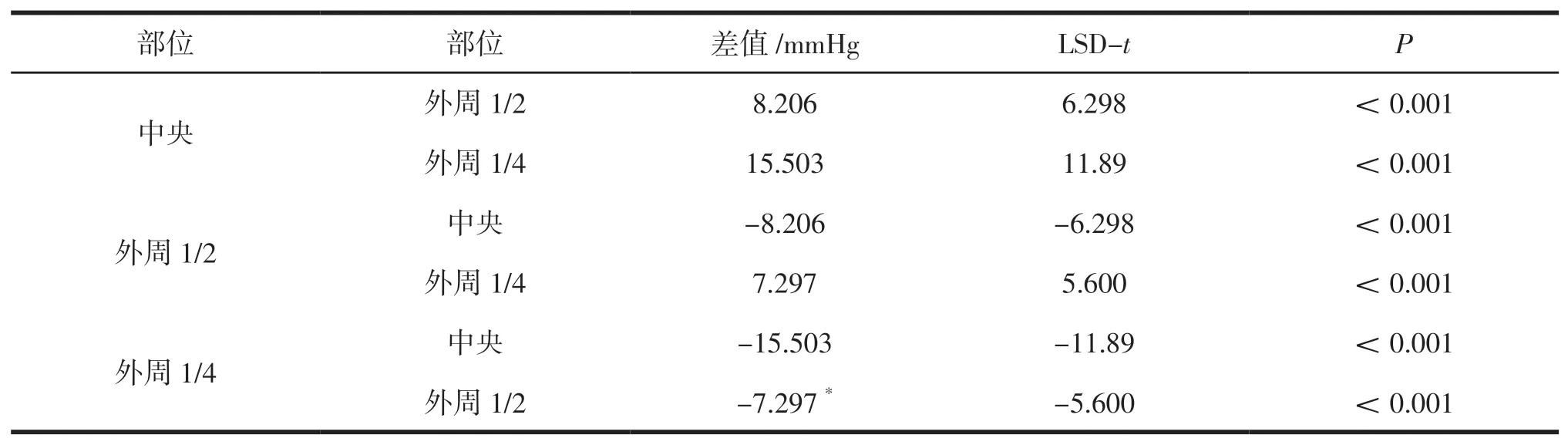
表1 肿瘤内不同区域IFP值两两比较
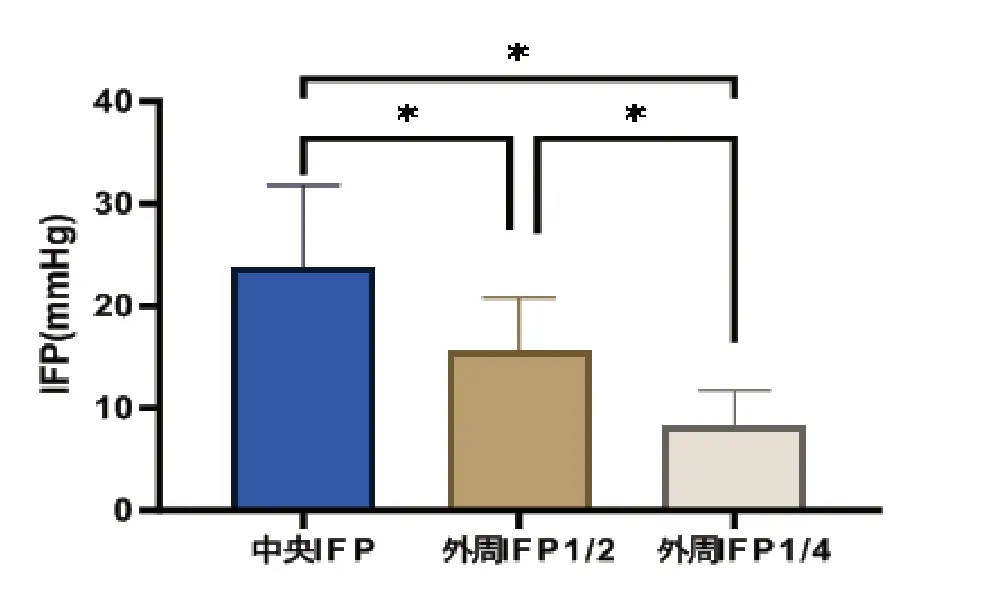
图5 肿瘤内从中央到外周IFP 值呈梯度降低
3 讨 论
近年来,人们已经认识到肿瘤在生长过程中会出现升高的IFP[5-6]。不少研究证实,高IFP是恶性实体肿瘤的特征[7]。大多数实验性和人类肿瘤的IFP值为5~40 mmHg,而大多数正常组织的IFP值在-3~3 mmHg之间[8]。对实验性肿瘤的研究表明,高IFP与化疗药物摄取不良和不均匀[9-10]、放疗抵抗机制[11-12]以及侵袭性生长和淋巴结转移[13-15]有关。临床研究表明,较高的IFP水平与放疗或放化疗后局部晚期子宫颈癌的无病生存率和总生存率低相关[16-20]。
有数学模型表明,IFP除了正常组织的表面会突然下降外,在肿瘤中均升高[21]。但这个结论主要是通过算法模拟计算验证出来的,可能只适合用于一些柔软且具有低细胞密度、高流体含量和极稀疏细胞外基质组分的均匀组织学的肿瘤,并不适用于大多数其内微环境复杂的实体肿瘤。本实验将VX2移植瘤接种于新西兰大白兔的左后肢浅肌层内,采用WIN法测量肿瘤内不同区域的IFP,以探索肿瘤内的IFP在不同区域是否存在异质性,为今后临床治疗肿瘤的新途径提供参考依据。
本研究是把VX2移植瘤种于新西兰大白兔的左后肢浅肌层内,因为IFP探针的准确定位需要较表浅的肿瘤。肌内移植优于皮下移植,因为皮下肿瘤与肌内种植相比,在生长早期就会出现中央坏死及钙化[22-23]。肌内肿瘤IFP通常高于皮下肿瘤,可能是因为肌肉组织对肿瘤组织间质液流入周围环境的抵抗力高于皮下组织[24-25]。本研究中测量的肿瘤中心IFP为5.00~40.28 mmHg。这些值与大多数实验性和人类肿瘤的IFP值中测量的范围一致。
Gutmann等[25]在头颈部鳞状细胞癌中使用WIN法检测IFP,得出在19例病灶中 IFP升高(4~33 mmHg)。此外,IFP随肿瘤大小而增加,说明肿瘤的大小会影响肿瘤内IFP的测值。本研究中纳入实验的肿瘤长径为(13±0.2)mm、宽径为(6±0.2)mm差异,所以在本实验中肿瘤的体积大小不是影响肿瘤内IFP的决定因素。
本研究对41只荷瘤兔在超声引导下进行肿瘤测压,肿瘤中央IFP为(23.79±8.07)mmHg、肿瘤外周1/2的IFP为(15.58±5.22)mmHg、肿瘤外周1/4的IFP为(8.29±5.47)mmHg(±s)。IFP 随着不同区域变化(F=70.85,P<0.05),中央的IFP高于外周1/2、外周1/4,外周1/2高于外周1/4。肿瘤内IFP在不同区域存在异质性,结合从中央-外周的压力曲线,可得出肿瘤从中央到外周,IFP降低。这有可能是引起在治疗肿瘤时各种化疗药物在其内难渗透且分布不均匀的原因之一。在研究高IFP对肿瘤对治疗的反应和临床结果的影响的研究中,对肿瘤内IFP异质性的了解是必不可少的。
实体瘤内的压力可分为两个组成部分:流体压力(凝胶相)和固体压力(固相)[26]。流体压力可分为毛细管的压力和间质的压力,进一步都可以细分为静水压力和胶体渗透压。在正常情况下,由于血管内皮的低渗透性,血浆蛋白仍然保持在血管内,因此相对于间质的胶体渗透压,保持较高的毛细管胶体渗透压。外渗的液体和蛋白质通过毛细血管后静脉和淋巴管重新吸收进入体循环,从而调节组织压力。
由本研究的HE染色病理结果看,在进行测量结束后,肿瘤组织内的血管周边未见红细胞溢出及血栓形成,即说明WIN法测量对肿瘤组织内造成明显损伤,尤其是未引起血管损伤;从图4可见从中央至外周的血管数量似在增加,此可能跟肿瘤组织的IFP分布异质性相关。
所以,我们推测造成肿瘤内不同区域IFP的异质性,从中央到外周,呈梯度显著下降的可能原因有可能是包括肿瘤内中央缺氧区的分布、肿瘤内畸形血管的分布特点及胶原纤维等细胞外基质成分的分布特点:
首先,间质体积的增加引起淋巴流量的增加,以防止间质液的进一步积聚[27]。与正常组织不同,肿瘤细胞的增殖速度快于其血管形成。只有当肿瘤的生长不超过距离滋养血管>1~2 mm的距离,肿瘤才能保持充足的氧合和营养[28]。因此随着肿瘤的生长,现有的血管变得不足以提供足够的氧气和营养供应以适应增加的细胞代谢需求。肿瘤间质中代谢废物的积累也增加,这情况在肿瘤中央区域(缺氧区)的表现更为显著。这两个因素产生了异常的肿瘤微环境,其引发间质中基质细胞的生成增加,包括癌症相关的成纤维细胞和免疫细胞,如巨噬细胞。巨噬细胞和肿瘤细胞可以上调各种细胞因子的产生,包括血管内皮生长因子(Vascular-endothelial-growthfactor,VEGF)、血小板源生长因子(Platelet derived growth factor,PDGF)和转化生长因子-β(transforming growth factor-β,TGF-β)[26],这些细胞因子可以刺激血管生成产生新的血管,以适应不断增加的代谢需要。这些细胞因子的过度表达会导致肿瘤血管的异常和扭曲。这些血管内皮细胞层不完整或缺失,基底膜改变,使其具有高渗透性。这使得更多的液体和血浆蛋白渗出到肿瘤间质,从而降低微血管静水压并增加IFP。
血管通透性增加与肿瘤体内异常或缺失的淋巴管相结合,导致间质中液体和蛋白质的进一步积聚[7-8],从而促进肿瘤内IFP的升高,并且也有可能造成肿瘤内不同区域IFP的异质性。
另外,Hansem Lise Mari K 等[29]的研究也提供了重要的证据,证明肿瘤中的间质液流动可被纤维化基质成分抑制,导致肿瘤内IFP异质性显著。因此,肿瘤内胶原纤维等细胞外基质成分的分布特点(差异性)也是影响肿瘤内IFP在不同区域存在异质性的重要因素,而这一因素是如何影响肿瘤内IFP的机制有待进一步研究探索。
