基于网络药理学和分子对接研究人参治疗糖尿病肾病中的作用*
2024-01-12吴玲玲李彩蓉
吴玲玲,李彩蓉**,王 静
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部临床医学院;3.咸宁市第一人民医院)
糖尿病肾病(diabetes nephropathy,DN)是糖尿病最常见的并发症之一[1],占糖尿病发病率的15%~40%,其中一部分最终会发展为终末期肾脏病[2-3]。虽然通过口服降糖药联合降压药的方法来治疗DN在临床上被证明是有效的,但是治疗效果有限,并且对于提高患者的生存率没有明显的影响。中药由于其多成分、多靶点、多通路且副作用小的作用特点,在临床上的应用越来越广泛。有研究发现,中药及其活性成分可以调节DN的多种发病机制,在肾功能保护方面有着可观的临床效应[4]。因此,研究中药治疗DN的相关机制是非常有必要的。
人参为五加科植物人参的干燥根和根茎,据《神农本草经》记载人参“味甘微寒,主补五脏,安精神,定魂魄,止惊悸,除邪气”。现代药理学研究[5]发现,人参具有抗炎、抗氧化和调节免疫等药理活性。由于中药具有多成分、多靶点、多通路联合发挥作用的特点,且目前对于人参治疗DN的机制尚不够明确,而网络药理学被认为是一种合适的研究中药作用机制的方法[6]。因此,本文通过网络药理学和分子对接技术对人参治疗DN的机制进行了研究。
1 资料与方法
1.1 人参有效成分筛选及靶点预测
以“人参”为关键词,在中药系统药理学数据库和分析平台(TCMSP,ttps://tcmspw.com/tcmsp.php)进行搜索,并设置类药性(drug-likeness,DL)≥0.18、口服生物利用度(oral bioavailability,OB)≥30%,筛选人参有效成分和其对应的靶点,再利用uniprot数据库将筛选得到的靶点名称转换为基因名称,得到人参的靶点。
1.2 疾病靶点的筛选
以“Diabetic Nephropathy”为关键词,利用Genecards(https://www.genecards.org/,5.8版)和在线孟德尔人类遗传(OMIM,https://omim.org/)两个数据库筛选DN的疾病靶点,将从两个数据库筛选得到的靶点进行合并,删除重复靶点,最后再进行2次中位数筛选,最终将中位数≥2.7的靶点作为DN的疾病靶点。
1.3 人参与DN交集靶点的预测
将筛选得到的人参的靶点和DN的疾病靶点同时输入软件Veeny 2.1中,绘制韦恩图,得到人参与DN的交集靶点。
1.4 药物-化合物-靶点网路预测
将人参的活性成分和其对应的靶点输入软件Cytoscape-v3.8.2中得到药物-化合物-靶点网路图。
1.5 蛋白质-蛋白质相互作用(PPI)网络构建以及核心靶点筛选
将筛选得到的人参与DN的交集靶点上传到STRING数据库(https://www.string-db.org/,版本11.5),设定物种为“Homo Spiens”,评分条件设置为>0.40,接着将network display options设定为“disable structure previews inside network bubbles”删除离散的点,得到蛋白质-蛋白质相互作用(PPI)网络。将从STRING数据库获取的PPI网络图的“TSV”格式上传到软件Cytoscape-v3.8.2,应用CytoNCA插件计算各个节点BC、CC、DC和EC值,得到核心靶点。
1.6 GO生物功能和KEGG通路富集分析
将人参和DN的交集靶点输入DAVID数据库(https://david.ncifc rf.gov/,6.8版)进行GO生物功能和KEGG通路富集分析,设定P<0.05进行校正,获取GO生物功能和KEGG通路富集分析数据,选取最显著的前10条通路的数据输入微生信(https://www.bioinformatics.com.cn)在线分析平台,进行GO和KEGG结果可视化分析。
1.7 人参与靶蛋白分子对接
分别以PTGS2、IL-1β、TNF-α和AKT1作为对接受体,以山萘酚作为配体,采用AUTODOCKTOOLS对接。以对接评分AFFINITY来筛选结合活性较好的靶点,结合能<-5KJ/mol,被认为具有较强的结合力。从PubChem数据库获取山萘酚的3D结构,从RCSB PBD数据库(http://www.rcsb.org/)获取最佳的蛋白结构。利用Pymol软件移除溶剂分子与配体,使用AutoDock TOOLs 1.5.7软件进行分子对接,最后使用Pymol软件绘制靶点蛋白受体和山萘酚之间的结合模式图。
2 结 果
2.1 人参有效成分筛选
TCMSP数据库筛选到22种人参的有效成分,按照度值(Degree)由大到小排列的化合物依次为山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)和人参皂苷(Rhginsenoside rh2)等,见表1。Degree值越高说明成分越重要。
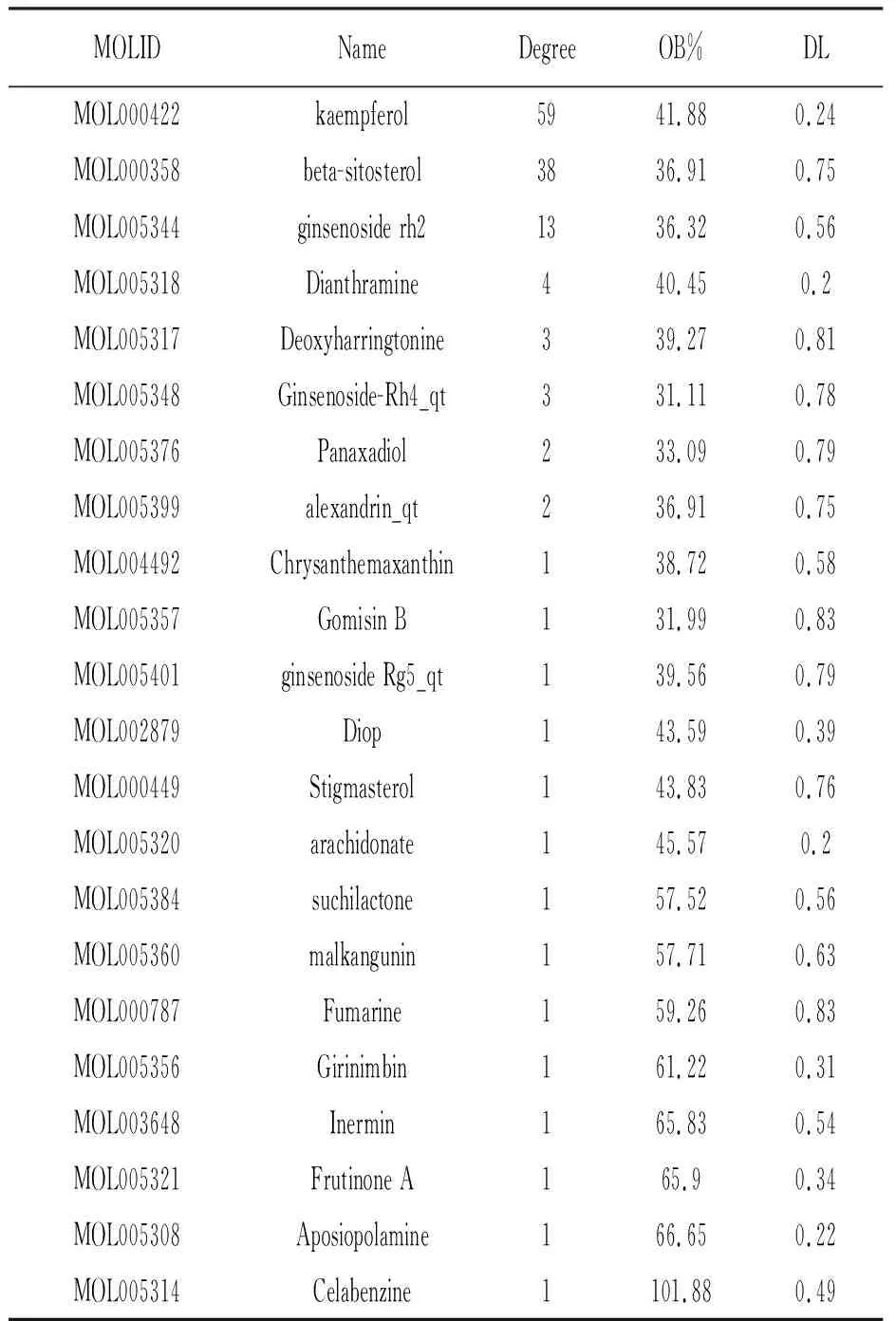
表1 人参中的有效成分
2.2 人参有效成分的靶点
通过TCMSP数据库筛选得到人参的有效成分有22种,对应的靶点有112个,接着利用Uniprot数据库为筛选得到的靶点进行基因名匹配。
2.3 人参-成分-靶点网络
利用Cytoscape 3.9.0软件构建药物有效成分靶点网络图,如图1所示,可见人参的22种有效化合物,对应112个靶点,其中黄色的点代表人参,粉色的点代表人参的22种有效化合物,绿色的点代表化合物对应的112个靶点,粉色图形越大,代表Degree值越大,可以看出排名靠前的有效成分有山奈酚和β-谷甾醇,说明这2种化合物与靶点的关联比较高。

图1 人参-成分-靶点网络
2.4 人参与DN的交集靶点
以“Diabetic nephropathy”为关键词,通过Genecards和OMIM两个数据库收集DN相关的基因,其中,在Genecards数据库的检索结果中,保留RelevanceScore值大于中位数的靶基因。最后将从Genecards和OMIM数据库得到的数据合并,删除重复的结果,将筛选得到的1832个DN的疾病靶点和112个人参靶点同时输入venny 2.1软件,得到人参与DN靶点的63个交集靶点(图2)。
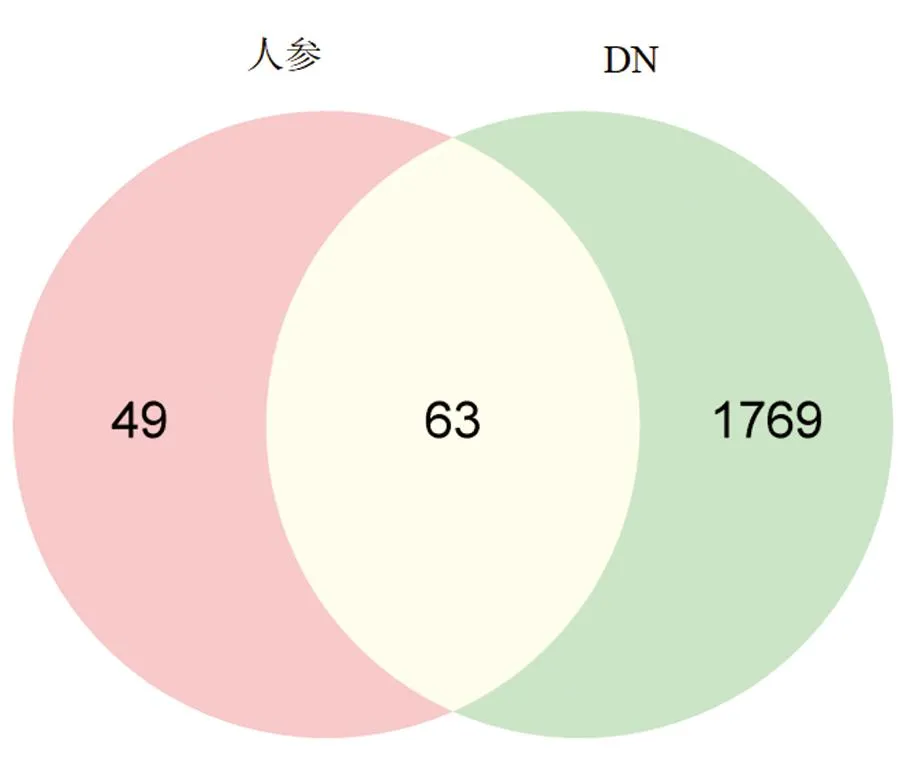
图2 人参与DN交集靶点
2.5 蛋白质相互作用(PPI)网络和核心靶点
将人参与DN的63个交集靶点输入STRING数据库构建PPI网络,结果显示,PPI网络包含了63个节点、409条边,平均节点为13,63个节点代表人参作用于DN的63个靶点,409条边代表63个靶点蛋白之间存在409条关联信息,平均节点13代表有效成分靶点-疾病靶点网络中的每个节点平均相连13条边(图3A)。将在STRING数据库得到的PPI网络图的“TSV”格式上传到ytoscape-v3.8.2软件,并应用CytoNCA插件计算各个节点BC、CC、DC和EC值,最后得到8个核心靶点,分别是AKT1、TNF、PTGS2、IL-1β、PPARG、CASP3、NOS3和NFKBIA(图3B)。
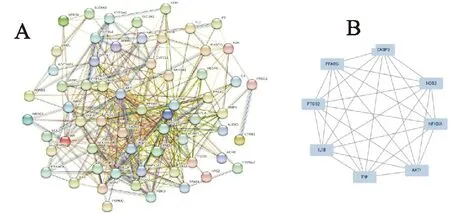
图3 人参与DN交集靶点PPI网络
2.6 GO生物功能富集分析
将人参和DN的63个交集靶点输入DAVID平台进行GO生物功能富集分析,结果显示了377个BP条目,42个CC条目,62个MF条目,将所得的数据以P<0.05的条件进行筛选并将结果按照由小到大进行排序,选取P值靠前的10个条目进行图形展示。结果显示,BP富集结果主要集中在对脂多糖反应、脂多糖介导的信号通路、缺氧反应等;CC富集结果主要集中在细胞外空间、细胞外区域等;MF富集结果主要集中在RNA聚合酶Ⅱ转录因子的活性、配体激活的序列特异性DNA结合等(图4)。

图4 人参对DN治疗靶点的GO富集分析
2.7 KEGG通路富集分析
将人参和DN的交集靶点输入DAVID平台进行KEGG分析,得到135条通路,按照P值从小到大排列,选取排名前20的通路进行图形展示,如图可见KEGG通路主要富集在脂质和动脉粥样硬化通路、弓形虫、糖尿病并发症相关的AGE-RAGE信号通路、TNF信号通路和癌症通路等(图5)。
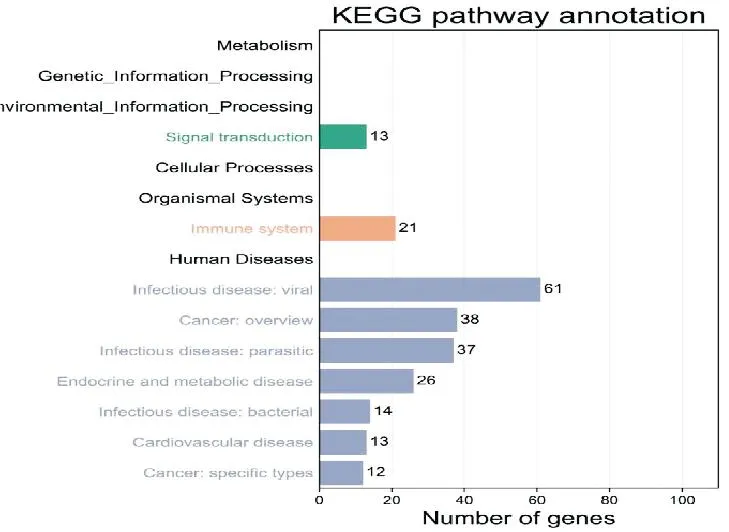
图5 人参对DN治疗靶点的KEGG富集分析
2.8 分子对接
将人参治疗DN的核心成分山萘酚和核心靶点PTGS2、IL-1β、TNF-α和AKT1分别进行分子对接,根据阈值大小得到4个结果,设定结合能≤-5 KJ/mol为条件来筛选结合活性较好的靶点。结果显示,山萘酚与PTGS2、IL-1β、TNF-α和AKT1的结合能分别为7.31KJ/mol、7.38KJ/mol、6.13KJ/mol和6.43KJ/mol(图6)。因此,山萘酚与核心靶点PTGS2、IL-1β、TNF-α和AKT1均具有较好的结合活性。
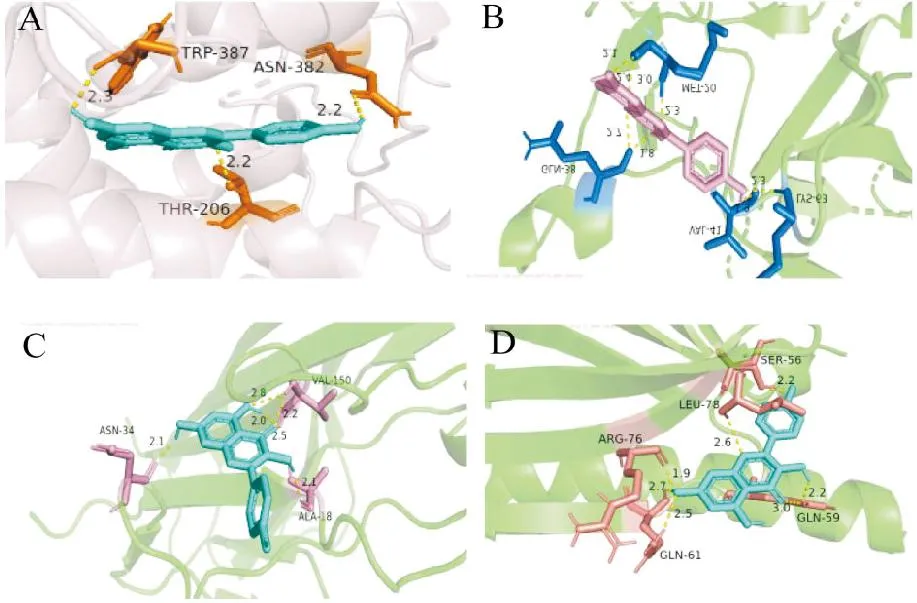
A.为山萘酚与PTGS2分子对接图;B.为山萘酚与IL-1β分子对接图;C.为山萘酚与TNF-α分子对接图;D.为山萘酚与AKT1分子对接图。图6 人参治疗DN的核心成分和核心靶点分子对接可视化图
3 讨 论
研究[7]发现人参通过调节胰岛素分泌、葡萄糖摄取、抗氧化应激和抗炎发挥抗糖尿病的作用。本研究通过网络药理学的方法分析了人参治疗DN的主要活性成分和可能的作用机制。
通过药物-成分-靶点网络发现山萘酚和β-谷甾醇是人参的核心成分。山萘酚即不仅可以抑制炎症反应[8],还可以抑制DN大鼠肾脏氧化应激[9]。而β-谷甾醇可以通过下调IKKβ/NF-κB和JNK信号通发挥抗炎作用[10]。而炎症和氧化应激已经被证实是DN发病的重要机制之一。因此,我们认为,山奈酚和β-谷甾醇可能是人参治疗DN的核心成分。
本研究共发现63个蛋白与人参治疗DN相关联。进一步通过GO和KEGG富集分析发现,这63个蛋白富集于脂质、动脉粥样硬化、弓形虫和AGE-RAGE等信号通路。脂质和动脉粥样硬化通路中的主要通路包括PI3K/Akt、TNF、JNK和ERK[11]。上调PI3K/Akt通路,可以抑制STZ诱导的NF-κB炎症通路的激活,从而发挥肾脏保护作用[12]。此外,下调JNK通路可以缓解高糖导致的线粒体损伤,从而改善肾功能[10]。由此可见,人参可以通过作用于多条信号通路和多种生物学过程发挥抗DN的作用。
通过PPI和分子对接发现人参治疗DN的核心靶点有8个(AKT1、TNF、TNF、PTGS2、IL-1β、PPARG、CASP3、NOS3和NFKBIA),其中PTGS2、IL-1β、TNF-α、AKT1与核心成分山萘酚间具有较好的结合活性。PTGS2(又称为COX2),在肾小球足细胞和系膜细胞以及肾小管细胞中的高表达,会加快DN的发病[13]。IL-1β和TNF-ɑ表达增加会导致肾小球足细胞损伤,引起血流动力学异常,导致肾功能受损和肾脏组织病理损伤[14]。AKT1与肾脏纤维化、肾小管损伤有关[15]。以上结果表明,人参抗DN的作用是通过多靶点发挥作用的。
本文通过网络药理学和分子对接发现人参通过多成分、多靶点、多通路协同作用发挥治疗DN的作用,为后续人参治疗DN的药理学机制提供了理论依据。本研究的不足之处在于没有进行体外和体内实验进行进一步的探讨和验证。
