基于年龄分层分析儿童肥胖与阻塞性睡眠呼吸暂停的关联
2024-01-12舒复平
舒复平
(厦门市妇幼保健院/厦门大学附属妇女儿童医院儿内科,福建 厦门 361000)
近年来我国儿童肥胖流行率急剧上升[1]。陆续有报道分析其与睡眠相关呼吸障碍的相关性,特别是阻塞性睡眠呼吸暂停(obstructive sleep apnea ,OSA)[2]。OSA的特征是睡眠时上呼吸道间歇性完全和部分阻塞,导致缺氧和皮质觉醒,儿童发病率约2%~13%[3]。OSA改善不佳、持续发展会损害心血管和代谢功能,并与一系列认知、行为和社会问题有关[4]。OSA与儿童肥胖之间的关联程度会受到种族、遗传等因素的影响。也有学者认为此种关联性在不同年龄段是有差异的[5]。因此,有必要基于年龄分层展开细致分析,为优化临床干预策略提供依据。
1 资料与方法
1.1 纳入及排除标准
纳入标准:3岁~12岁汉族儿童,未合并严重感染、肿瘤及其他严重的内外科疾病。排除标准:相关临床资料信息缺漏者;精神异常患儿;存在明显的解剖结构异常与先天出生缺陷,患有遗传性疾病。
1.2 一般资料
回顾性分析自2021-2022年在我院儿内科接受睡眠呼吸监测的患儿相关临床资料,包括年龄、性别、体重、身高、疾病诊断以及睡眠呼吸监测各项主要参数。以肥胖患儿(N=32)为观察组,按照约1∶3比例依据年龄匹配非肥胖病例为对照组(N=101)。
肥胖的界定标准:学龄前(<7岁)儿童依据《中国0~18岁儿童、青少年体块指数的生长曲线》,学龄儿童(≥7岁)依据我国卫生行业标准《学龄儿童青少年超重与肥胖筛查》[6-7]。
1.3 研究方法
记录研究对象的一般资料,包括年龄、性别、身高、身体质量指数(BMI)等以及开展呼吸睡眠监测前的临床诊断。监测当天不服用镇静催眠等药物,保持环境安静、舒适状态,在夜间开展睡眠呼吸监测,时间不短于7h。
记录监测指标:呼吸暂停低通气指数(apnea hypopnea index,AHI)、阻塞性呼吸暂停指数(obstructive apnea index,OAI)、氧减指数(oxygen desaturation index,ODI)、最低血氧饱和度(Lowest oxygen saturation,LSaO2)、血氧饱和度低于90%占总睡眠时间的百分比(the percentage of time with blood oxygen saturation less than 90% of the total time,T90)等。OSA的诊断依据为《中国儿童阻塞性睡眠呼吸暂停诊断与治疗指南(2020)》[8]。
基于上述观察指标,分别比较总的研究对象、学龄前组、学龄组中肥胖与非肥胖患儿的一般临床资料、OSA发生率以及呼吸睡眠监测各参数值;分析BMI与呼吸睡眠监测各参数值的相关性。
1.4 统计学方法
运用SPSS 26.0进行数据统计分析,计数资料以百分数(%)描述,采用χ2检验。计量资料经Shapiro-Wilk检验,均符合正态分布,以(均数 ± 标准差)描述,采用t检验,两变量间相关性分析采用Pearson法。采用logistics回归分析BMI对OSA发病的影响,P<0.05 为差异有统计学意义。
2 结 果
2.1 两组一般临床资料的比较
两组平均年龄、男性占比没有显著差异,监测前诊断为“扁桃体肥大”“腺样体肥大”“变应性鼻炎”等的占比亦无显著差异。再经年龄分层,分别比较学龄前、学龄患儿中肥胖组与非肥胖组上述特征,均无显著差异。详见表1。

表1 肥胖组与非肥胖组患儿一般临床资料的比较
2.2 肥胖组与非肥胖组呼吸睡眠监测指标的比较
在不分年龄段的情况下,肥胖组与非肥胖组患儿比较,OSAS的发生率没有显著差异。呼吸睡眠监测相关指标AHI、0AI、ODI、LSaO2、T90均无显著差异。经年龄分层,学龄前的患儿中,肥胖组与非肥胖组比较,OSA的发生率及上述呼吸睡眠监测相关指标均无显著差异;学龄患儿中,肥胖组OSA发生率以及AHI、ODI均高于非肥胖组(72.7% vs 25.7%;7.99±4.03 vs 2.98±1.92;4.40±3.35 vs 1.94±1.67),差异具有显著性意义(P<0.05)。详见表2。
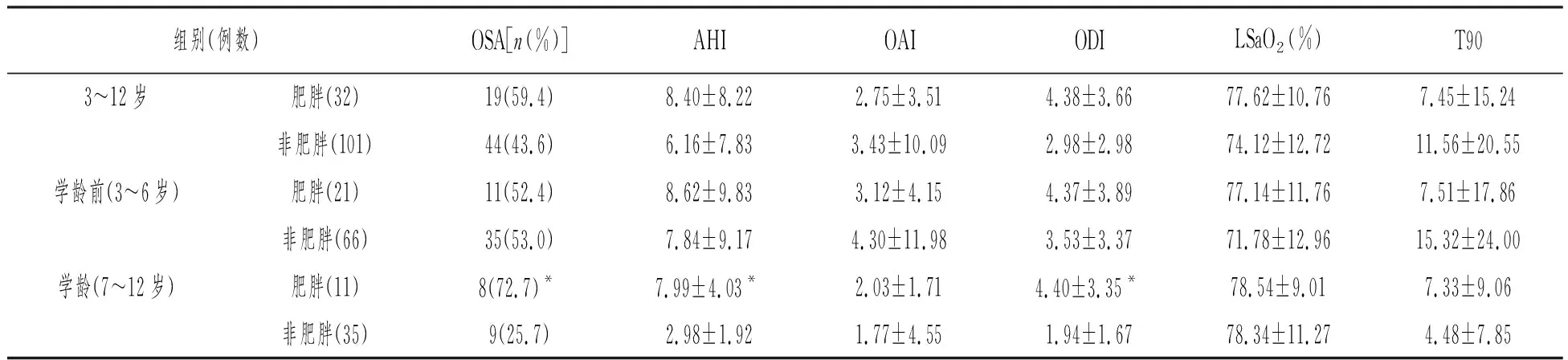
表2 肥胖组与非肥胖组患儿呼吸睡眠监测指标的比较
2.3 患儿BMI与呼吸睡眠监测指标值的相关性分析
经年龄分层,学龄前患儿BMI与呼吸睡眠监测各指标也均无显著相关性;学龄患儿BMI与AHI正相关(r=0.332,P=0.030),具有显著意义。在不分年龄段的情况下,BMI与其他呼吸睡眠监测指标值没有显著相关性。详见表3。
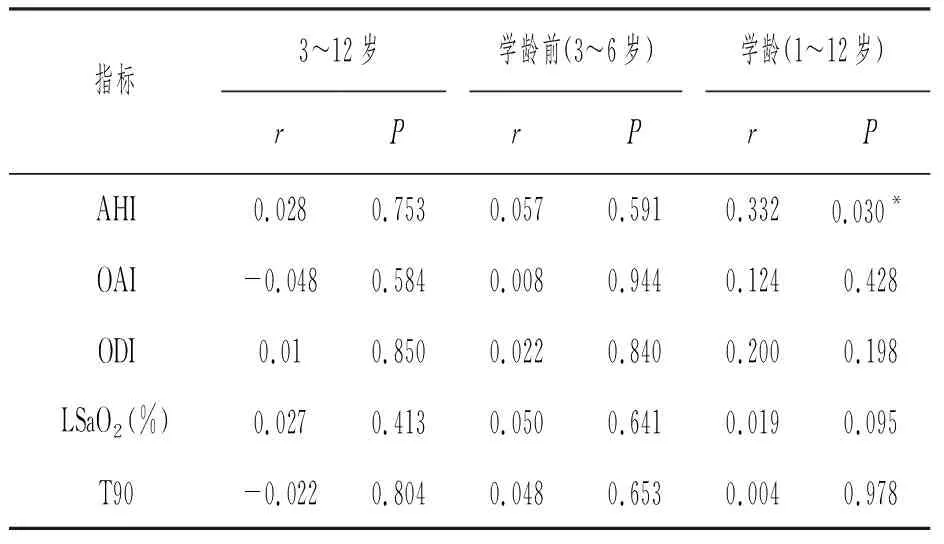
表3 BMI与呼吸睡眠监测指标值的相关性分析
2.4 患儿BMI对OSA发病风险影响的logistics分析
运用logistics回归分析,在考虑年龄与性别的混杂因素影响后,探讨BMI对OSA发病的影响。经年龄分层,学龄前期患儿BMI不是OSA的风险因素(OR=1.009,P>0.05)。学龄期患儿BMI是OSA的风险因素(OR=1.309,P<0.05),即BMI每增加1kg/m2OSA风险增加30.9%。详见表4。
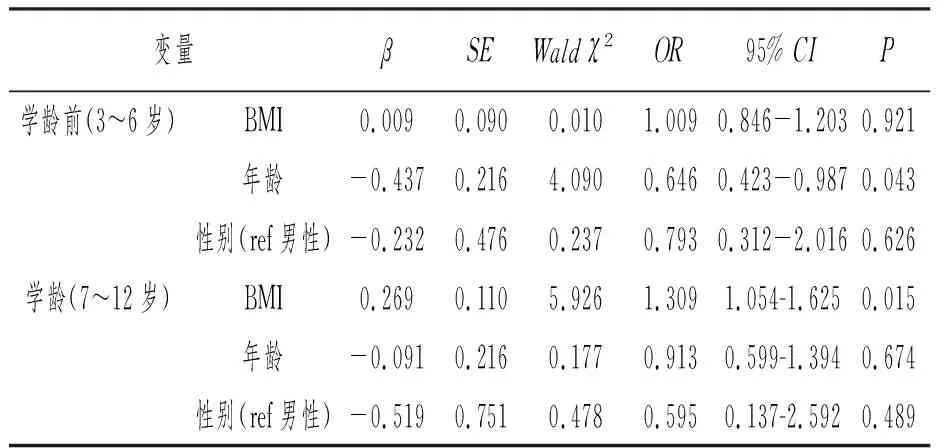
表4 BMI对OSA发病风险影响的 logistic回归分析
3 讨 论
3.1 儿童OSA的近远期不良影响
儿童的睡眠状态对身体健康至关重要[9]。OSA严重影响正常睡眠,其形成原因是上呼吸道阻力和咽部塌陷增加。当气流部分减少或几乎完全停止时,就会发生气道阻塞,引发异常的气体交换或睡眠唤醒。儿童OSA显著增加心血管疾病风险,未经治疗者还会导致发育缺陷,如认知障碍、注意力缺陷等[10],并对成年后健康产生长期不良影响,必须充分重视[4]。
3.2 OSA与儿童肥胖的关联
OSA的发病机制主要有:颅面解剖异常、组织沉积/浸润增加、气道塌陷性加重,肥胖也是其危险因素之一[11]。颈部周围、咽旁脂肪垫区的脂肪沉积会降低气道顺应性,软腭舌头和会厌可限制气道容积,且腹部脂肪增多会减小肺体积,从而促进上气道塌陷。OSA与肥胖存在共同的病理生理机制,即系统性低度炎症状态。一方面,低度系统性炎症是肥胖本身固有特征,另一方面OSA诱导、增强了继发于肥胖的炎症反应[12]。肥胖与OSA的深层关联是一个有待厘清的问题。
3.3 年龄因素对 OSA与儿童肥胖关联性的影响
本研究报道:对于3~12岁儿童,总体而言BMI与OSA没有显著相关性;经年龄分层再进一步分析,学龄前儿童中肥胖组与非肥胖组OSA发病率无显著差异;学龄儿童中,肥胖组OSA发病率显著高于非肥胖组,AHI、ODI与BMI正相关。BMI每增加1kg/m2OSA风险增加30.9%。此研究结论与Kohler MJ等一致[5]。原因可能是,学龄前儿童腺样体扁桃体生长很快,当其超出口腔生长速度时,气道间隙减小,阻力增加,从而OSA风险上升。此阶段OSA主要归因于腺样体扁桃体生长快于口腔生长,肥胖影响并不显著。而对于学龄儿童来说,颌骨快速生长有利于容纳腺样体,减少腺样体肥大对气道阻塞的影响。这样肥胖对气道阻塞的影响开始凸显出来[13]。
近年有学者主张,在临床管理中OSA应分为两型:即非肥胖儿童的OSA与肥胖儿童的OSA[14]。针对肥胖患儿应开展综合措施,包括详细的糖脂代谢监测与严格的体重管理。当代谢指标改善,体重下降至合理区间,OSA风险会随之下降。另一方面,如果OSA得到及时治疗,呼吸睡眠改善后,肥胖与其他心血管、代谢疾病风险亦会随之下降。
本研究的重点与创新之处在于根据儿童不同发育阶段生理功能的差异,开展细致的年龄分层、分段研究,深入探讨OSA与儿童肥胖的关联性。本研究受限于病例数,且为回顾性分析,难以准确控制其他影响变量。将来我们会进一步开展多中心、前瞻性研究,扩大样本量,分析不同病种,如哮喘、糖尿病等患儿中,各年龄段肥胖与OSA关联,旨在为开展有针对性、差异化的临床护理、宣教与药物干预方案提供依据,促进精准施治。
