IL-34在舌鳞状细胞癌中的表达及意义
2024-01-12张伟健邹琸玥朱永娜马彩云武峻捷
张伟健,邹琸玥,朱永娜,王 敏,马彩云,武峻捷,石 昕,刘 茜
1蚌埠医学院第二附属医院口腔科,安徽 蚌埠 233040;蚌埠医学院2口腔医学院,3感染与免疫安徽省重点实验室,4生命科学学院,安徽 蚌埠233030
口腔鳞状细胞癌(OSCC)是头颈部鳞状细胞癌(HNSCC)的主要类型[1],而舌鳞状细胞癌(TSCC)是口腔鳞状细胞癌中最常见的恶性肿瘤。近年来发现该疾病的发病率增高,并且患者逐渐年轻化[2]。TSCC 可以局部转移邻近组织结构,还可以通过血液转移至其他器官,严重影响患者的生命质量及面部外形。目前,以手术为主要的综合治疗对于晚期TSCC患者效果不佳,患者五年存活率仍然较低[3-5]。为了提高患者术后生存率,以生物标志物为靶点的免疫治疗逐渐应用于临床。但目前只有极少的生物标志物,可提供预后信息并指导免疫治疗[6],因此迫切需要识别TSCC进展和转移的关键分子靶点,进一步揭示TSCC 的致病机制,为探寻TSCC 新的诊断标志物和治疗靶点具有重要意义。
白细胞介素34(IL-34)是近年来发现的白细胞介素家族的新成员,是一种由39 000单位组成的二聚体糖蛋白。IL-34 作用于3 种受体即:集落刺激因子受体(CSF-1R)[7]、受体型蛋白酪氨酸磷酸酶(PTPRJ)[8]和Syndecan-1[9]。其由角质形成细胞、神经元及成骨细胞等分泌,广泛表达于以脾为主的多种人体器官和组织[10]。据文献报道,IL-34在结肠癌[11]、肺癌[12]等癌症中高表达,而在乳腺癌[13]、病毒性肝癌[14]等癌症中低表达,IL-34通过直接途径和旁路途径参与调控了多种肿瘤的发生发展[15-18]。但是,IL-34在TSCC中的表达及临床意义尚不清楚,相关研究未见报道。随着公共数据库越来越完善,在癌症的研究中它可以为癌症的诊断、治疗和预后提供相关信息,但本研究无法在公共数据库中直接获得TSCC中与IL-34相关的基因。
因此,本研究首先通过ELISA检测IL-34在TSCC患者与正常人群之间有无差异性表达,再通过IHC和qRT-PCR检测IL-34在TSCC组织中的表达特点,分析其表达水平与患者临床病理的关系,再利用综合生物信息学分析方法,使用多个数据库进行对比筛选,探索在TSCC中IL-34以及相关的基因的生物学功能,从而为TSCC的临床诊断和靶向治疗提供新思路。
1 资料和方法
1.1 病例资料
根据纳入标准收集2022年1月~2023年5月于蚌埠医学院第一附属医院口腔颌面科接受手术治疗的41例TSCC患者的肿瘤、癌旁组织及空腹状态下患者静脉血样本。手术室收集切除的TSCC 癌组织及癌旁组织,置于冰上,迅速转移至实验室内,在超净台内将组织分成两部分,一部分用福尔马林固定,石蜡包埋,用于IHC实验。另一部分分装在无菌的组织冻存管中,保存液氮罐中,之后转移至-80 ℃冰箱,待用,用于qRT-PCR实验。选取同期健康人群36例空腹状态下静脉血样本(对照组),同时随机从空腹状态下TSCC患者静脉血样本中抽取36例(观察组),保证在性别、年龄的临床资料方面,观察组与对照组无明显差异(P>0.05),所有血液样本均在取得后进行离心,取上层血清至-80 ℃冰箱,用于ELISA 检测。纳入标准:所有患者术后病理为TSCC;术前患者未接受化疗、放疗、生物疗法等;所有患者有完整的临床资料。排除标准:合并其他部位恶性肿瘤;合并自身免疫系统疾病;术后合并严重并发症。参与本研究患者或其亲属均签署知情同意书,伦理审查已通过(伦理批字[2022]第95号)。
1.2 ELISA检测
取出-80 ℃冻存的血清标本,置于冰上融化;观察组与对照组分别进行ELISA法检测。首先在室温下将人IL-34试剂盒放置30 min,应用双抗体夹心法测定标本中人IL-34水平。用纯化的人IL-34抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入IL-34,再与HRP 标记的IL-34抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。TMB在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和标本中的IL-34呈正相关。用酶标仪在450 nm 波长下测定吸光度(A值),通过标准曲线计算标本中人IL-34浓度,所有操作均根据说明书进行。
1.3 免疫组化检测
将符合要求的石蜡包块切成4 μm厚切片。对照苏木精-伊红染色,分析病理结果是否为TSCC(病理结果的判读由两名高年资病理科医生共同完成,两名医生结果一致病理诊断成立)。选取TSCC组织及癌旁组织的标本,切片脱蜡,复水,抗原修复,滴加一抗,采用2%牛血清稀释的抗体1∶100稀释,避光孵育4 ℃过夜。用磷酸盐缓冲液(PBS)冲洗3次,采用2%牛血清稀释的二抗,37 ℃避光孵育1 h,用PBS 冲洗3 次,DAB 显色15 min后复染冲洗,常规脱水、透明、封片。脱水后封片,将细胞置于显微镜下观察,IL-34 主要存在于细胞浆,阳性着色为胞浆内可见黄褐色颗粒。选择200倍视野,拍照保存。
拍照保存后,用ImageJ软件对TSCC组织标本进行半定量积分法。计数判定方法如下:(1)半定量阳性结果无着色0分、浅黄色计1分、棕黄色计2分、棕褐色计3分;(2)阳性比例按视野内阳性细胞所占总细胞数的比例计分,无计分为0分、≤25%计1分、26%~50%计2分、51%~75%计3分、>75%计4分;(3)将每张片子于200倍的视野下随机选取5个组织视野,对所有视野进行计分,将上述两种计分结果相乘,本实验中将≤2分定为低表达组,>2分定为高表达组[19]。
1.4 qRT-PCR检测
将冻存的组织取出后,采用Trizol法提取RNA,用逆转录试剂盒按说明合成cDNA,再行QPCR 检测TSCC组织和癌旁组织中IL-34的mRNA表达水平。逆转录PCR 所使用的的引物由上海生工公司Primer Premier 5.0 软件设计、合成,以管家基因β-actin 为内参。所用引物序列见表1。PCR扩增后,使用实时荧光定量PCR仪自动分析结果,阈值和基线根据阴性对照进行调整,以确定各个标本的Ct值,并根据熔解曲线确定该Ct值是否有效。将结果导出,采用2-△△CT法分析目的基因在癌组织和癌旁组织之间的表达差异。

表1 PCR引物序列Tab.1 PCR primer sequences
1.5 IL-34 基因相互作用靶点的获取及蛋白质互作(PPI)网络的构建
通过String 数据库(https://string-db.org/)[20]检索出前20 个与IL-34 基因相互作用的关键蛋白,构建PPI 网络,对于物种类型的选择设定为“Homo sapiens”,置信度选择“Medium 0.4”,相互作用最大数选择20。
1.6 TSCC 中IL-34 相关基因分析及其GO 功能与KEGG信号通路富集分析
本研究通过STRING 数据库(https://string-db.org/)获得IL-34 相关基因集,因无法直接利用LinkedOmics 数据库(http:/linkedomics.org/)[21]获 得TSCC 中与IL-34 相关基因,所以我们先通过LinkedOmics数据库中LinkFinder分析模板探究头颈部鳞状细胞癌(HNSCC)中与IL-34相关的基因,以错误发现率(FDR)<0.05 为相关基因的筛选标准[22]将结果以火山图、热图呈现。再使用GEO 数据库获得GSE149008 数据集的舌鳞状细胞癌与正常组织的差异表达基因。进行比对获得在舌鳞状细胞癌中IL-34相关差异基因。通过Webgestalt数据库(https://www.webgestalt.org/)对相关差异基因进行基因本体论(GO)功能分析及京都基因与基因组百科全书(KEGG)信号通路富集分析。设置步骤如下:(1)上传相关基因,物种选择“Homo sapiens”,我们选择over-representation analysis(ORA)进行基因富集分析;(2)保存并下载富集分析结果;(3)通过错误发现率(FDR)对IL-34相关信号通路富集途径进行排序,FDR 小于0.05 表示显著富集。我们采用R v.4.3.0中的ggplot2包,将富集排序前5的结果进行了可视化。
1.7 统计学方法
本研究结果数据采用SPASS 26.0软件分析,对于计量数据进行正态性检验,非正态分布的计量数据采用中位数和四分位数间距表示。两组间比较使用秩和检验,分析IL-34与临床病理资料的关系采用卡方检验,Fisher确切概率法,以P<0.05为差异具有统计学意义。
2 结果
2.1 IL-34在TSCC人群中的低表达
ELISA结果显示,TSCC人群的血清IL-34浓度比正常人群显著性降低(P<0.001,图1)。
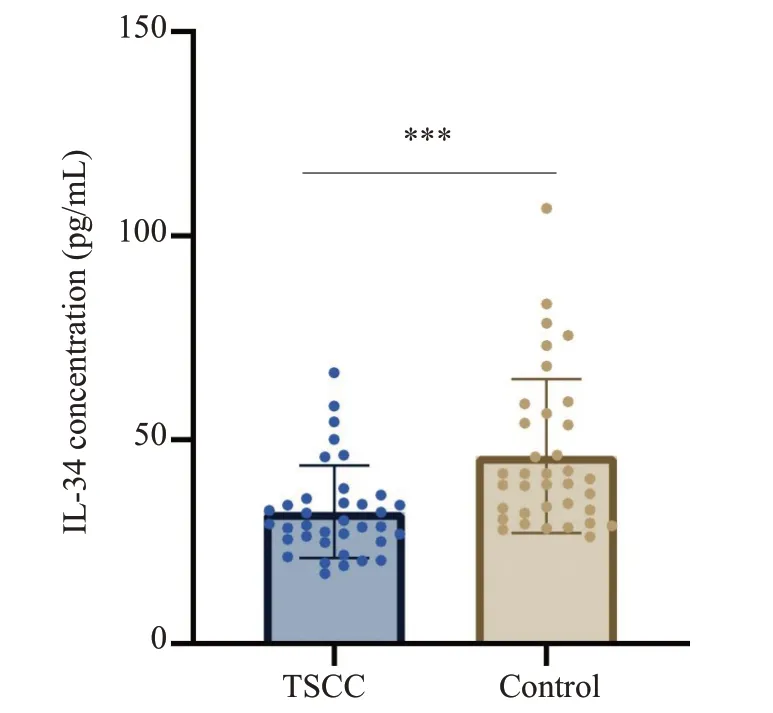
图1 实验组(EG)和对照组(CG)血清浓度Fig.1 Serum levels of IL-34 in patients with tongue squamous cell carcinoma (TSCC) and healthy individuals.***P<0.001.
2.2 IL-34在TSCC组织中的低表达
IHC结果显示,在TSCC的癌组织以及癌旁组织中,IL-34 主要存在于细胞浆(图2),通过Imagej软件对于IOD 值进行分析,分析结果显示,与癌旁组织相比,IL-34蛋白表达在TSCC组织中明显降低,差异有统计学意义(P<0.001,图3)。qRT-PCR 结果显示,与癌旁组织相比,IL-34在TSCC组织中明显低表达(图4,P<0.001)。
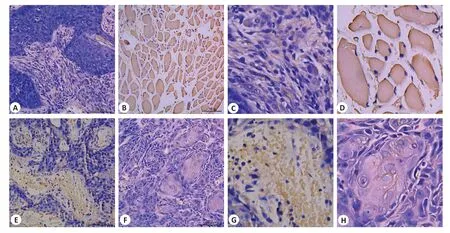
图2 舌鳞癌及癌旁组织中IL-34表达的免疫组织化学染色Fig.2 Immunohistochemical staining for detecting IL-34 expression in TSCC and adjacent tissues.A:Immunohistochemical staining of IL-34 in cancer tissue.B:Immunohistochemical staining of IL-34 in adjacent tissue.E:Relatively high expression of IL-34 in cancer tissue.F:Relatively low expression of IL-34 in cancer tissue.A,B,E,and F(Original magnification:×200)are enlarged in C,D,G,and H(×500),respectively.The scale bar is 100 μm.
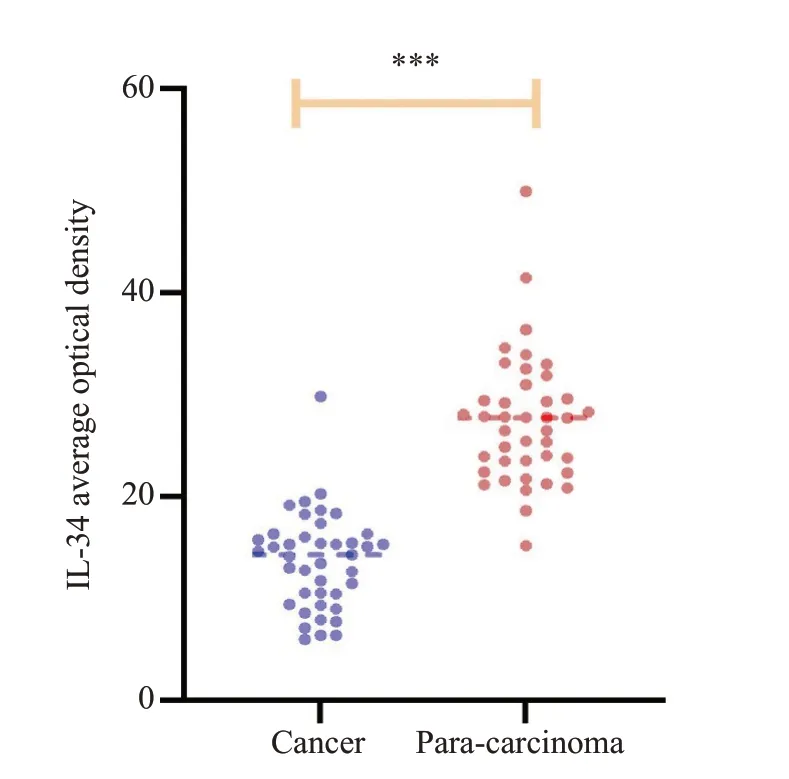
图3 癌组织和癌旁组织平均光密度值Fig.3 Average optical density values of IL-34 in TSCC and adjacent tissues.***P<0.001.

图4 IL-34 mRNA在癌组织和癌旁组织中的表达Fig.4 Expression of IL-34 mRNA in TSCC and adjacent tissues.***P<0.001.
2.3 IL-34的表达与TSCC患者临床病理特征之间的关系
在TSCC组织中IL-34的表达水平和淋巴结是否转移,TNM分期有关(P<0.05),而与TSCC患者的年龄、性别、是否吸烟、是否喝酒以及肿瘤大小无关(P>0.05,表2)。

表2 41例TSCC患者IL-43的表达与临床病理特征的关系Tab.2 Relationship between IL-43 expression and clinicopathological characteristics in 41 patients with TSCC
2.4 IL-34相互作用蛋白的PPI网络
将IL-34基因相互作用的交集靶点导入String数据库,得到PPI 网络,共筛选出前20 个与IL-34基因相互作用的蛋白,根据同源分数比较,由大到小前5名依次为分别为巨噬细胞集落刺激因子受体(M-CSF1-R)、受体型蛋白酪氨酸磷酸酶(PTPRJ)、巨噬细胞集落刺激因子1(CSF1)、Syndecan-1(SDC1)、肿瘤坏死因子配体超家族成员11(TNFSF11)(图5)。

图5 IL-34相互作用蛋白的PPI网络Fig.5 Protein-protein interaction network highlighting the top 20 IL-34-interacting proteins.
2.5 TSCC 中IL-34 相关基因分析及其GO 功能与KEGG信号通路富集分析
借助LinkedOmics数据库获得了HNSCC中IL-34的相关基因(图6A~C)。使用Webgestalt数据库对在舌鳞状细胞癌中与IL-34相互作用的差异基因分别参与GO 注释和KEGG通路分析,GO注释结果表明,舌鳞状细胞癌中,IL-34及相关差异基因在生物学过程(BP)中,主要富集在骨髓细胞分化,髓样白细胞分化,对外部刺激反应的正向调节,髓样白细胞活化,巨噬细胞分化等;在细胞组成(CC)中,主要富集在含胶原蛋白的细胞外基质,转录调节复合物,血小板α颗粒,常染色质,蛋白质-DNA复合物等;在分子功能(MF)中,主要富集在细胞因子结合,RNA 聚合酶II 特异性DNA 结合转录因子结合,信号受体激活剂活性,整合素结合,细胞因子受体结合等(图6D)。KEGG分析结果表明,IL-34及相关差异基因主要参与破骨细胞分化,癌症中的蛋白多糖,MAPK信号通路,PI3K-Akt信号通路,Ras信号通路等通路(图6E)。
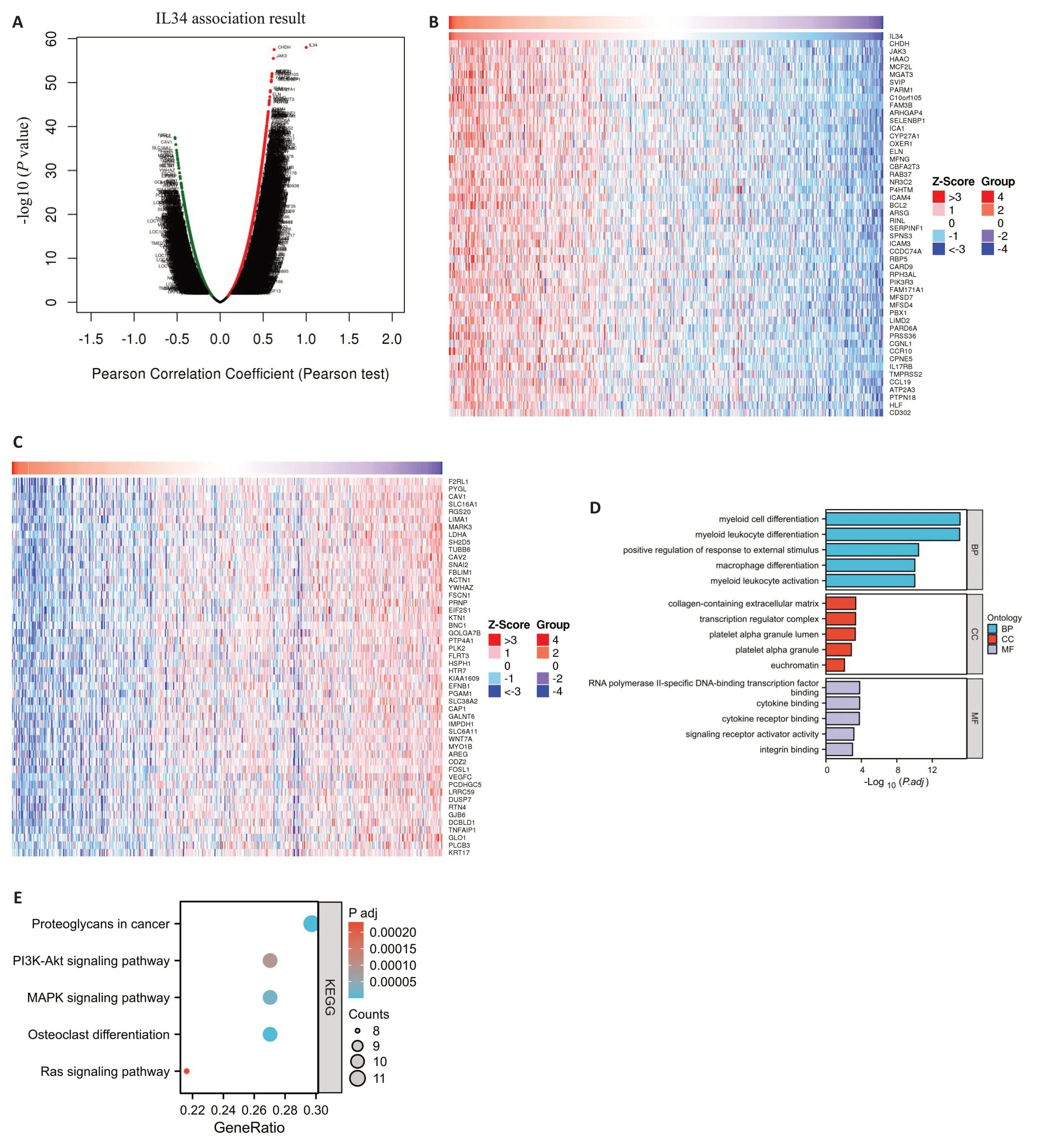
图6 TSCC中IL-34相关基因分析及其GO功能分析和KEGG信号通路富集分析Fig.6 Analysis of IL-34-related genes in TSCC and the GO functional analysis and KEGG signaling pathway enrichment analysis.A:Volcanic plot of IL-34-related genes in NHSCC.B: Heat map of the genes positively associated with IL-34 in NHSCC.C: Heat map of genes negatively associated with IL-34 in NHSCC.D:Bar plot of GO functional analysis of IL-34 in TSCC.E: Bubble plot of KEGG pathway enrichment analysis of IL-34-related genes in TSCC.
3 讨论
近年来,TSCC颈部淋巴结转移的风险日益突出[23],5年的相对存活率仅为63%。目前,手术切除仍是主要的治疗方式,辅以化疗和放疗[24]。为了更好地进行早期诊断和指导免疫治疗,专家学者们致力于寻找TSCC的肿瘤发病机制和潜在生物标志物。自发现以来,IL-34因其参与炎症性疾病、自身免疫性疾病、肿瘤发生发展等而受到研究关注,在病理状态下,机体IL-34的表达水平与疾病的发生、进展及严重程度相关[25,26],IL-34的高表达影响多种癌症的发生发展已得到证实[27-30]。肿瘤微环境的形成和发展是肿瘤发生、发展和转移的重要因素,在肿瘤微环境中,IL-34以不同的方式影响肿瘤相关巨噬细胞的功能[15],并有证据表明,IL-34和肿瘤相关巨噬细胞可作为诱导肿瘤免疫微环境和肿瘤耐药性之间的连接物[31-33]。本研究通过探究IL-34在TSCC中的表达及其临床意义为TSCC 的早期诊断和治疗提供新的依据。
本研究首次通过ELISA实验检测出IL-34在TSCC患者中血清浓度低于正常人群(P<0.001),此外通过IHC和qRT-PCR两组实验检测出IL-34在TSCC组织中显著低表达(P<0.001),其表达水平和淋巴结是否转移,TNM分期呈负相关(P<0.05),与而与患者的年龄、性别、是否吸烟、是否喝酒以及肿瘤大小无关(P>0.05)。这些结果表明IL-34的表达水平可能是TSCC一个重要的预后指标。这两部分实验结果证明了IL-34在TSCC中起到了反调控的作用。有研究表明,IL-34阻碍胶质母细胞瘤细胞的增殖、克隆性和运动性[8];高IL-34表达在Luminal型乳腺癌和Her2阳性乳腺癌预后较好[13],在上述恶性肿瘤中,IL-34与PTPRJ受体相结合起到反调控作用,研究证明PTPRJ它被认为是一种潜在抑癌基因,在多种癌症中发现其表达水平下降[34],这表明IL-34在TSCC中的作用机制可能和上述癌症中作用机制相似,因此通过生信分析做进一步研究。
本研究未能直接利用LinkedOmics 数据库获得TSCC中IL-34相关基因,可能是因为不同数据库储存与癌症有关的基因不同。所以本研究首次利用String数据库,LinkedOmics数据库和GEO数据库通过对比筛选后获得在TSCC中IL-34相关差异基因,提高了所获取数据的准确性。在TSCC中观察到丰富的IL-34相关基因表达差异,通过String数据库分析构建出IL-34的蛋白互作网络(PPI),对IL-34相互作用的多种蛋白分析,发现PTPRJ位列相关性排名第2位,进一步验证了在TSCC中IL-34的作用机制可能同在胶质母细胞瘤,Luminal型乳腺癌等恶性肿瘤中作用机制相似,表明IL-34可能与PTPRJ受体结合进而在TSCC的发生发展中起到反调控作用。本研究中,通过GO功能与KEGG信号通路富集分析显示IL-34及其相关基因在TSCC中发挥作用,在TSCC中IL-34及其差异基因通路主要富集于MAPK信号通路,PI3K-Akt信号通路及Ras信号通路等。这证明了这些基因可能通过MAPK/PI3KAkt/Ras信号轴调节TSCC发生发展。本研究采用生信分析方法探究了IL-34在TSCC中的生物学功能,但由于TSCC的发生发展是受多种因素和机制共同作用的复杂过程所影响,仅进行了ELISA、IHC以及qRT-PCR实验验证,缺乏相应的细胞及动物学实验佐证,因此存在一定的局限性。本课题组期望在接下来的研究中,进一步探究IL-34在TSCC细胞中的相关分子机制,以期更深入地了解IL-34在TSCC发生和发展中的作用。
综上所述,本研究通过多种检测方法首次证实了IL-34在TSCC中低表达并与其临床病理相关,可能成为TSCC新的诊断标志物和治疗靶点。
