克唑替尼与AP化疗方案治疗EGFR-TKIs耐药c-Met扩增阳性晚期肺腺癌的疗效比较
2024-01-12陈海龙钟清军谢传华黄萍潘宜云
陈海龙,钟清军,谢传华,黄萍,潘宜云
目前,肺癌发生率与病死率均居首位,其中非小细胞肺癌最为常见,约占全部肺癌的85%,因发病早期缺乏典型症状,超过50%的患者在确诊时已处于晚期,临床治疗难度大,患者5年存活率较低,预后较差[1]。近些年,随着靶向治疗在临床中的应用,越来越多的晚期肺腺癌患者从中受益,为基因敏感患者带来福音,已成为首选一线治疗方案,但随着广泛应用后,耐药问题逐渐出现,耐药机制中以间质表皮转化因子(c-Met)扩增、T790M突变为常见原因,5年存活率<20%,患者预后不佳[2]。目前临床治疗表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)耐药患者并无统一意见,多选择含铂双药化疗为主,但整体效果有限,探讨更加高效的治疗方案有重要意义[3]。c-Met作为受体酪氨酸激酶家族成员,参与了RAS、RAF、MEK、ERK等信号通路,致病性突变的c-Met基因将持续传递异常信号造成细胞过度增殖,导致肿瘤持续进展[4]。克唑替尼作为间变性淋巴瘤激酶(ALK)/c-Met小分子抑制剂,将其用于c-Met扩增阳性的非小细胞肺癌患者治疗中也能取得显著效果[5]。现比较克唑替尼与培美曲塞联合卡铂(AP)化疗方案治疗EGFR-TKIs耐药c-Met扩增阳性晚期肺腺癌的疗效,报道如下。
1 资料与方法
1.1 临床资料 选取2019年6月—2022年6月赣州市肿瘤医院收治的晚期肺腺癌患者72例,按照随机数字表法分为对照组与试验组,各36例。对照组中男22例,女14例;年龄42~85(61.47±5.82)岁;疾病分期:ⅢB期16例,ⅢC期13例,Ⅳ期7例;体质量41~88(75.34±4.83)kg。试验组中男21例,女15例;年龄42~83(61.34±5.75)岁;疾病分期:ⅢB期15例,ⅢC期12例,Ⅳ期9例;体质量42~87(75.17±4.49)kg。2组临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 病例选择标准 纳入标准:(1)晚期肺腺癌,且经病理检查确诊;(2)对一线EGFR-TKIs耐药进一步行高通量测序技术检测证实c-Met扩增阳性;(3)存在影像学可测量的病灶;(4)卡氏功能状态量表(KPS)评分<70分;(5)治疗依从性良好,可积极配合治疗;(6)患者及其家属对本研究知情同意并签署知情同意书。排除标准:(1)存在已有明显症状的中枢神经系统转移者;(2)预计生存时间<3个月者;(3)无法耐受本研究治疗方案者;(4)合并严重脏器功能衰竭者。
1.3 治疗方法 对照组予以AP化疗方案,化疗前行常规止吐治疗,药物使用方法:注射用培美曲塞二钠(四川汇宇制药股份有限公司生产)500 mg/m2静脉滴注;注射用卡铂(山东睿鹰制药集团有限公司生产)按曲线下面积为4~6计算剂量静脉滴注,2种药物均在化疗第1天使用,以21 d为1个周期。培美曲塞使用前1周,予叶酸片(杭州仟源保灵药业有限公司生产)400 μg口服,每天1次,持续用药至治疗结束。化疗前提前注射维生素B12注射液(江西赣南海欣药业股份有限公司生产)1 mg,每3周注射1次;此外,分别于使用培美曲塞前、后1天口服醋酸地塞米松片(武汉同济现代医药科技股份有限公司生产)4 mg进行预处理。试验组予以克唑替尼胶囊(美国瑞辉制药有限责任公司生产)250 mg口服,每天2次,以21 d为1个周期 。2组均治疗2个周期。
1.4 观察指标与方法 (1)细胞因子、肿瘤标志物:首先采集2组患者空腹状态下静脉血3 ml,以3 000 r/min速率离心15 min,取血清以酶联免疫吸附法检测血管内皮生长因子(VEGF)、癌胚抗原(CEA)、糖类抗原125(CA125),试剂盒购自北京万泰生物药业有限公司。上述指标分别于治疗前、治疗2个周期后检测。(2)免疫指标:以(1)方法取血液样本,采用流式细胞仪检测CD3+、CD4+、CD8+,并计算CD4+/CD8+。上述指标分别于治疗前、治疗2个周期后检测。(3)生存情况:分别于治疗前、治疗2个周期后进行KPS评估,总分100分,评分越高表明患者生存质量越好[6]。随访截至2023年7月,记录2组患者无进展生存时间(PFS)、总生存时间(OS)。PFS即开始治疗到肿瘤再进展时间;OS即自治疗开始至死亡的时间。(4)不良反应:不良反应按国家癌症研究所制定的常见不良事件评价标准(NCI-CTCAE)分0~Ⅳ级,症状表现主要包括皮疹、血细胞减少、腹泻等。
1.5 疗效判定标准 临床症状以及靶病灶均消失为完全缓解(CR);临床症状得到改善,靶病灶基线之和缩小>30%为部分缓解(PR);靶病灶减小程度介于PR、疾病进展(PD)之间为稳定(SD);所有靶病灶直径和相对增加≥20%或出现新病灶为PD[7]。疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。

2 结 果
2.1 临床疗效比较 试验组与对照组DCR比较,差异无统计学意义(88.89% vs. 75.00%,χ2=2.347,P=0.126),见表1。

表1 对照组与试验组临床疗效比较 [例(%)]
2.2 VEGF、肿瘤标志物比较 治疗前及治疗2个周期后,2组血清VEGF、CEA、CA125水平比较,差异无统计学意义(P>0.05);治疗2个周期后,2组血清VEGF、CEA、CA125水平低于治疗前(P<0.01),见表2。
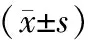
表2 对照组与试验组治疗前后VEGF、肿瘤标志物比较
2.3 免疫指标比较 治疗前及治疗2个周期后,2组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异无统计学意义(P>0.05);治疗2个周期后,对照组CD3+、CD8+及试验组CD8+低于治疗前,试验组CD4+/CD8+高于治疗前(P<0.05或P<0.01),见表3。
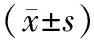
表3 对照组与试验组治疗前后免疫指标比较
2.4 KPS评分以及PFS、OS比较 治疗前,2组KPS评分比较,差异无统计学意义(P>0.05);治疗2个周期后,2组KPS评分高于治疗前,且试验组高于对照组(P<0.01),见表4。2组PFS、OS比较,差异无统计学意义(P>0.05),见表5。
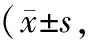
表4 对照组与试验组治疗前后KPS评分比较分)
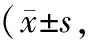
表5 对照组与试验组PFS、OS比较月)
2.5 不良反应比较 2组在治疗期间均未发生Ⅲ~Ⅳ级不良反应,以Ⅰ~Ⅱ级症状表现为主。试验组不良反应总发生率低于对照组(13.89% vs. 38.89%,χ2=5.792,P=0.016),见表6。

表6 对照组与试验组不良反应比较 [例(%)]
3 讨 论
近年来,肺癌发生率呈现出明显升高趋势,除与空气污染、吸烟等因素有关外,与基因也有密切关系,此说法与我国不吸烟女性肺癌发生率增高现象相符[7]。随着医学技术快速发展,临床治疗肺癌的方法越来越多,但其病死率仍居高不下,分析此原因可能与发病早期缺乏典型症状,多数患者于晚期发现,错失最佳手术治疗时机有关。既往临床治疗晚期肺腺癌只能采用以铂类为主的化疗方案或联合放疗,治疗期间不良反应多,整体效果不佳[8]。随着靶向技术的推广使用,EGFR-TKIs成为最常用的靶向治疗药物,已被列为一线治疗方案。但在实际应用中发现,部分患者敏感性较差,易产生EGFR-TKIs耐药,临床应用具有一定局限性。
晚期肺腺癌患者出现EGFR-TKIs耐药机制较为复杂,c-Met扩增、T790M突变为常见原因,目前临床治疗多为经验性用药,缺乏高级别的参考证据[9]。相关研究认为,EGFR-TKIs耐药c-Met扩增阳性肺腺癌患者可从全身化疗中获益,但也有研究指出使用分子靶向药物联合化疗能够增强治疗效果,提升临床获益。AP化疗方案是临床用于肺腺癌的一线治疗方案,由卡铂与培美曲塞组成,具有较好的抗肿瘤效果,可延长PFS,应用效果显著[10]。但由于存在个体差异性,部分患者使用AP化疗方案的效果不理想,且不良反应多,整体效果有待提高。克唑替尼为小分子多靶点的分子靶向药物,属于三磷酸腺苷(ATP)竞争性抑制剂,c-Met、ALK等是其主要作用靶点,为分子靶向治疗领域新的里程碑[11]。本研究结果显示,治疗2个周期后,2组DCR、PFS、OS及CD3+、CD4+、CD4+/CD8+、CD8+、VEGF、CEA、CA125间比较均无统计学差异;治疗2个周期后,2组血清VEGF、CEA、CA125水平低于治疗前,KPS评分高于治疗前,且试验组KPS评分高于对照组,不良反应总发生率低于对照组,表明EGFR-TKIs耐药c-Met扩增阳性晚期肺腺癌患者采用克唑替尼或AP化疗方案治疗均有一定效果,能够降低肿瘤标志物水平,延缓病情进展,延长PFS、OS,且对患者免疫功能损伤均较小,但克唑替尼药物不良反应更少,能够提升患者生存质量,具有较高的应用价值。c-Met扩增阳性在晚期肺腺癌患者中的发生率约为15%,而克唑替尼的研制针对的靶点即为c-Met,故治疗EGFR-TKIs耐药c-Met扩增阳性晚期肺腺癌患者的效果确切,且患者对治疗过程中出现的不良反应均可耐受,不会对治疗进程产生不良影响,患者生存质量更高,具有较好的社会效益[12]。
综上所述,EGFR-TKIs耐药c-Met扩增阳性晚期肺腺癌患者采用克唑替尼或AP化疗方案治疗均能获得一定效果,能够降低肿瘤标志物水平,延缓病情进展,延长生长期,且对患者免疫功能损伤均较小,但克唑替尼药物不良反应更少,能够提升患者生存质量,具有较高的应用价值。
利益冲突:所有作者声明无利益冲突。
