实时荧光定量PCR检测肉制品中牛源性成分及其含量
2024-01-11杨春萍刘小玲
谭 波,杨春萍,刘小玲
(1.广西大学轻工与食品工程学院, 广西 南宁 530004; 2.贵州省检测技术研究应用中心, 贵州 贵阳 550014; 3.贵州省分析测试研究院, 贵州 贵阳 550014)
近年来,随着全球化经济的高速发展,人们的物质需求逐渐提升,各种肉类食品的流通和交易也越来越频繁,这使得一些不法商家为了牟取暴利,以低价肉替代高价肉,导致肉制品掺假事件频繁发生[1-3]。其中,由于牛肉营养价值高[4-5],需求量逐年上涨[6],其掺假问题比较突出。2013年波及欧盟国家“挂牛头卖马肉”的“马肉风波”事件,对欧盟28个成员国的近7300个样本进行检测,结果有近4.6%的牛肉产品中检出马肉成分,且在被检出的马肉中,又有0.5%含有欧盟禁止使用的动物止疼类药物保泰松[7]。唐穗平等[8]对广东省牛羊肉及其制品掺杂掺假情况的调查分析发现,牛肉制品掺假率高达20%。这些食品掺假问题严重影响着食品安全和消费者权益,然而,目前我国对动物源性成分鉴定的现行标准只能进行定性检测,无法完成定量分析[9],且由于检测灵敏度过高,无法排除生产、贮藏、运输、销售等过程中样品交叉污染或原料带入造成的污染[10],很难为市场监管提供有力的技术支撑。因此,建立一种准确、快速的牛源性成分量化检测的方法意义重大。聚合酶链式反应(Polymerase ChainReaction,PCR)是一种基于特异性引物和模板DNA的体外扩增方法[11],近年来在动植物源性成分检测方面得到了广泛的应用[9,12-14]。本研究以牛细胞核单拷贝磷酸二酯酶基因(bosPDE)为靶基因,应用实时荧光定量PCR相对定量方法建立肉制品中牛源性成分及含量的检测方法,旨在为市场监管及后续相关标准制定提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡肉、鸭肉、鹅肉、鹌鹑肉、鸽子肉、鸵鸟肉、猪肉、羊肉、马肉、驴肉、骆驼肉、梅花鹿肉、兔肉、鲈鱼、牛肉、干辣椒、小麦粉购自贵阳市大型农贸市场及网络购物平台;广谱型基因组DNA小量纯化试剂盒(TaKaRa);6×DNA上样缓冲液、2×Taqman PCR MasterMix(索莱宝);100 bp DNA Ladder、TS-GelRed核酸染料、1×TAE速溶颗粒、琼脂糖(北京擎科)。
1.2 仪器与设备
冷冻离心机(Centrifuge 5481R),eppendoff;恒温金属浴(DKT200-4),杭州米欧仪器有限公司;迷你离心机(WTL-10K),湖南湘仪实验室仪器开发有限公司;超微量分光光度计(Deaou-US200),广州迪澳生物科技有限公司;小型板式离心机(PlateSmart),北京鼎昊源科技有限公司;梯度PCR仪(SureCycler 8800),Agilent Technologies;电泳仪(DYY-6C),北京六一生物科技有限公司;凝胶成像系统(BIS 910),北京东胜创新生物科技有限公司;实时荧光定量PCR仪(7500),Applied biosystems。
1.3 试验方法
1.3.1引物探针设计 采用Laube等[15]研究报道的单拷贝细胞核基因bosPDE引物及探针为本研究的牛特异性引物和探针, 序列为 bosPDE-F:ACTCCTACCCATCATGCAGAT,bosPDE-R:TGTTTTTAAATATTTCAGCTAAGAAAAA, bosPDE-probe: (FAM)-AACATCAGGATTTTTGCTGCATTTGC-(TAMRA); 采用Wang等[16]研究报道的单拷贝细胞核基因LcoR引物及探针为本研究内参的通用性引物及探针, 序列为LcoR-F: CCAGCCAGCCCAATAGCACAA, LcoR-R:GAGGTGAGTCTTGGTCAGCCAT,LcoR-P:(HEX)-TGCYGAAAGCATCTC-(MGB)。 引物及针均交于北京擎科生物科技股份有限公司合成。
1.3.2样品处理 鲜肉:用无菌剪刀将动物组织表皮去除,剪取适量中间组织于一次性研磨杯中,于试管研磨机8000 r·min-1研磨3~5 min直至组织为匀浆状。干辣椒:用无菌剪刀将辣椒剪碎至一次性研磨杯中,于试管研磨机8000 r·min-1研磨3~5 min直至组织为粉末状。
1.3.3样品DNA提取 取50 mg样品与1.5 mL离心管,根据DNA提取试剂盒说明书,使用MiniBEST通用基因组DNA提取试剂盒提取辣椒及小麦粉DNA,使用动物基因组DNA提取试剂盒(通用型)提取动物DNA。最终用60 μL Tris-EDTA(TE)缓冲液将提取的样品DNA 洗脱,使用超微量分光光度计测定DNA纯度及浓度。DNA的OD260 nm/OD280 nm在1.8~2.0,可用于DNA扩增,于-20 ℃保存备用。
1.3.4反应条件优化 退火温度优化:用TE缓冲液将牛肉DNA浓度稀释至50 ng·μL-1作为上样模板,参照1.1×T3 Super PCR Mix 说明书推荐的PCR反应体系及程序,使用梯度PCR仪同时对多个退火温度点的DNA模板进行扩增。反应体系为:1.1×T3 Super PCR Mix 21 μL,10 μmol·L-1上游引物1 μL,10 μmol·L-1下游引物1 μL,模板DNA2 μL;bosPDE反应程序为:98℃,2 min,[98℃,10 s,(46.3℃、47.8℃、50.9℃、52.3℃、53.7℃、54.9℃、58.0℃、60.0℃)72℃,1 min]35个循环,72℃,2 min,4℃保存;LcoR反应程序为:98℃,2 min,[98℃,10 s,(53.2℃、54.6℃、56.0℃、57.2℃、59.6℃、61.9℃、63.2℃、65℃)72℃,1 min]35个循环,72℃,2 min,4℃保存。用2%的琼脂糖凝胶电泳分析扩增产物,确认PCR反应退火温度。
荧光PCR引物、探针浓度优化:确认PCR反应退火温度后,将引物、探针浓度稀释至10 μmol·L-1后按表1反应体系分别进行PCR试验,优化PCR引物、探针浓度。
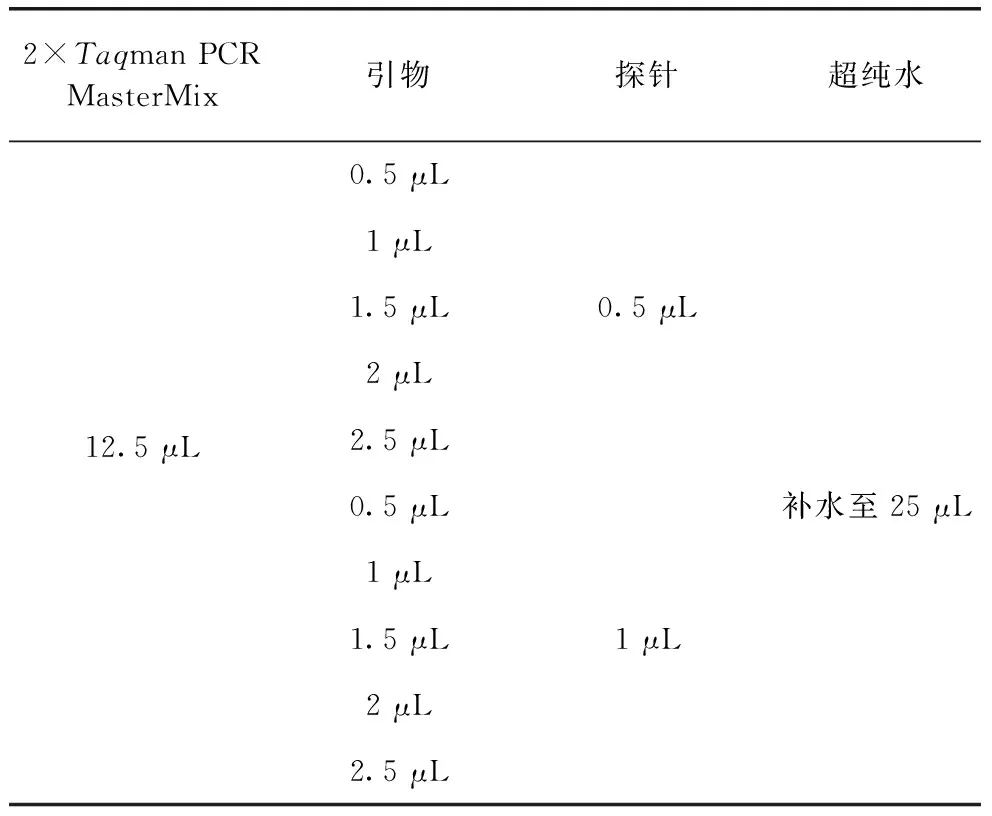
表1 引物探针浓度优化反应体系
1.3.5引物特异性验证 分别以鸡肉、鸭肉、鹅肉、鹌鹑肉、鸽子肉、鸵鸟肉、猪肉、羊肉、马肉、驴肉、骆驼肉、梅花鹿肉、兔肉、鲈鱼、牛肉、干辣椒、小麦粉DNA为模板,用bosPDE引物及探针按照1.3.4优化后的反应条件进行实时荧光PCR扩增,验证bosPDE引物及探针的特异性。
1.3.6内参引物通用性验证 分别以鸡肉、鸭肉、鹅肉、鹌鹑肉、鸽子肉、鸵鸟肉、猪肉、羊肉、马肉、驴肉、骆驼肉、梅花鹿肉、兔肉、牛肉DNA为模板,浓度均稀释至50 ng·μL-1,用LcoR引物及探针按照1.3.4优化后的反应条件进行实时荧光PCR扩增,验证内参引物及探针的通用性。
1.3.7灵敏度试验 将牛肉DNA浓度稀释至100 ng·μL-1,然后按10倍系列梯度稀释,即浓度分别为100、10、1、0.1、 0.01、0.001 ng·μL-1,用超纯水作为空白对照进行PCR试验。
1.3.8牛源性定量标准曲线建立 精确称取匀浆后牛肉和猪肉,按质量比混合,制备牛肉含量分为1 %、10%、20%、40%、60%、80%、100%的混合样品作为标准品,提取DNA,将浓度均稀释至50 ng·μL-1,进行实时荧光PCR 反应。以LcoR作为内参基因,以牛肉含量为1%的样品为对照,以超纯水为空白对照,样品和对照设置2个平行反应体系,分别进行目的基因和内参基因扩增,用Ct平均值,采用相对定量法△Ct值与2△△Ct值线性模型分别建立标准曲线。
1.3.9模拟混合样品验证 以牛肉:猪肉质量百分比为35%、50%、65%、90%模拟混合样提取DNA,将浓度均稀释至50 ng·μL-1,进行实时荧光PCR 反应。按1.3.4优化后的方法进行扩增,将Ct 平均值带入所建立的标准曲线中计算牛肉成分含量,验证方法的准确性。
2 结果与分析
2.1 反应条件优化
2.1.1退火温度优化bosPDE及LcoR各退火温度点下的PCR扩增产物经2%的琼脂糖凝胶电泳结果见图1。bosPDE退火温度在53.7℃以后扩增产物电泳条带清晰度开始降低,且在60.0℃时无扩增条带;LcoR退火温度在61.9℃后扩增产物电泳条带单一且清晰;为防止非特异扩增及引物二聚体出现,本试验选择51℃和63℃分别作为bosPDE及LcoR的PCR反应程序退火温度点。
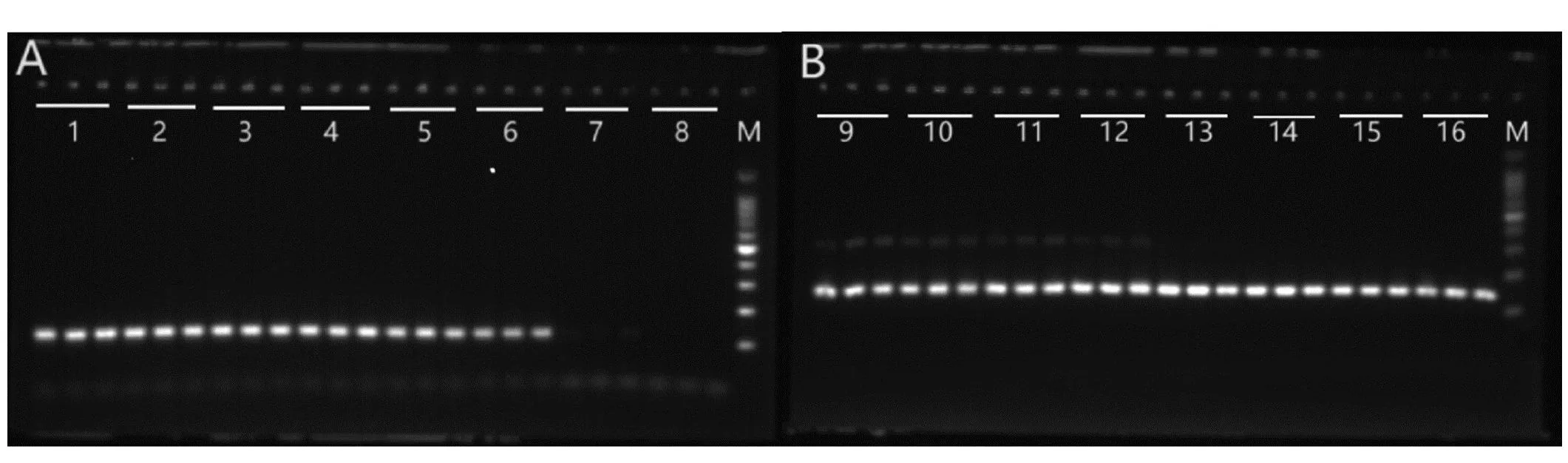
注:A为bosPDE各退火温度点下的PCR扩增产物凝胶电泳结果,1~8分别对应退火温度46.3℃、47.8℃、50.9℃、52.3℃、53.7℃、54.9℃、58.0℃、60.0℃的电泳结果;B为LcoR各退火温度点下的PCR扩增产物凝胶电泳结果,9~16分别对应退火温度53.2℃、54.6℃、56.0℃、57.2℃、59.6℃、61.9℃、63.2℃、65℃的电泳结果;M为100 bp DNA Ladder图1 2%琼脂糖凝胶电泳图Fig.1 2 % agarose gel electrophoresis diagram
2.1.2荧光PCR引物、探针浓度优化bosPDE及LcoR引物、探针浓度优化实时荧光定量PCR扩增见图2,Ct值见表2。由表2可见,bosPDE及LcoR探针取用量为0.5 μL时的Ct值均高于探针取用量为1 μL时的Ct值,即两个靶基因探针取用量在0.5 μL时的扩增效果比1 μL时的低。且bosPDE引物取用量在0.5、1 μL时,探针取用量为0.5 μL时Ct值的离散程度比1 μL时的高;LcoR引物取用量0.5、1、1.5、2 μL时,探针取用量为0.5 μL时Ct值的离散程度比1 μL时的高。为了试验高效快捷,方便计算,本试验选择引物、探针用量均为1 μL时的浓度为优化后的最适引物、探针浓度。
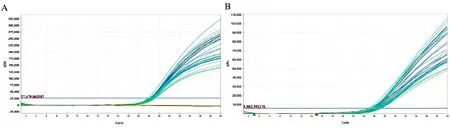
注:A、B分别为不同浓度bosPDE、LcoR引物、探针实时荧光定量PCR扩增曲线图2 实时荧光定量PCR扩增曲线Fig.2 Amplification curve of the real-time fluorescence quantitative PCR

表2 不同浓度bosPDE及LcoR引物、探针实时荧光定量PCR扩增Ct值

表3 LcoR引物对14种畜禽肉DNA扩增Ct值
2.2 引物特异性验证
目的基因bosPDE引物特异性试验结果见图3,bosPDE引物仅对牛肉DNA进行扩增,对鸡肉、鸭肉、鹅肉、鹌鹑肉、鸽子肉、鸵鸟肉、猪肉、羊肉、马肉、驴肉、骆驼肉、梅花鹿肉、兔肉、鲈鱼、牛肉、干辣椒、小麦粉DNA均无扩增效果,由此可见,bosPDE引物特异性高,符合试验要求。

图3 bosPDE引物对17种动植物DNA扩增曲线Fig.3 DNA amplification curves of 17 kinds of animals &plants by bosPDE primers
2.3 内参引物通用性验证
内参基因LcoR引物对鸡肉、鸭肉、鹅肉、鹌鹑肉、鸽子肉、鸵鸟肉、猪肉、羊肉、马肉、驴肉、骆驼肉、梅花鹿肉、兔肉、牛肉14种常见畜禽肉DNA扩增Ct值见表4。除超纯水外,14种常见畜禽肉均有典型扩增曲线,因此,LcoR可以作为内参基因使用。

表4 不同牛肉含量的标准品Ct值结果
2.4 灵敏度试验
为检测bosPDE引物灵敏度,将牛肉DNA稀释至不同浓度后进行检测,结果见图4。当牛肉DNA浓度为0.01 ng·μL-1仍可明显看到PCR扩增曲线。因此,本方法检测灵敏度可达0.01 ng·μL-1。

图4 bosPDE引物对不同浓度牛肉DNA的扩增曲线Fig.4 Amplification curves of beef DNA with different concentrations by bosPDE primers
2.5 牛源性定量标准曲线建立
不同牛肉含量的标准品用bosPDE及LcoR引物、探针经荧光定量PCR扩增反应后Ct值见表4。以△Ct值(△Ct= CtbosPDE- CtLcoR)为纵坐标,以标准品牛肉含量百分比的对数值为横坐标建立标准曲线见图5。以2△△Ct值(△△Ct=△Ct对照-△Ct,△Ct对照=CtbosPDE,1%牛肉样品- CtLcoR,1%牛肉样品)为纵坐标,以标准品牛肉含量百分比为横坐标建立标准曲线见图6。标准曲线回归公示分别为y=-3.0965x+8.4797,R2=0.998;y=0.7122x+3.0504,R2=0.9887。R2均大于0.980,符合实时荧光定量PCR国际化标准-MIQE 指南要求[17],均具有良好的线性关系。
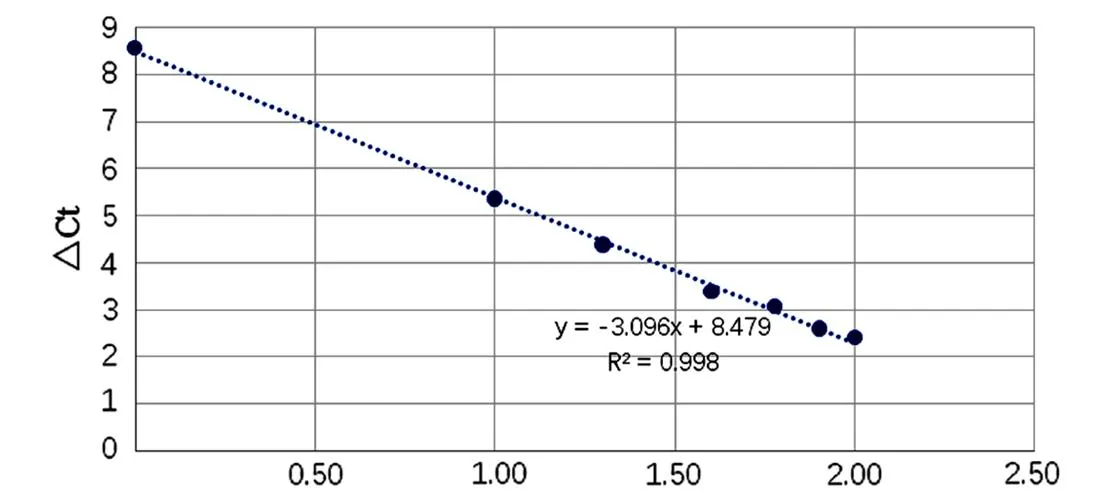
图5 △Ct值与牛肉含量对数值建立的标准曲线Fig.5 Standard curve established by △Ct value and the logarithmic value of beef content
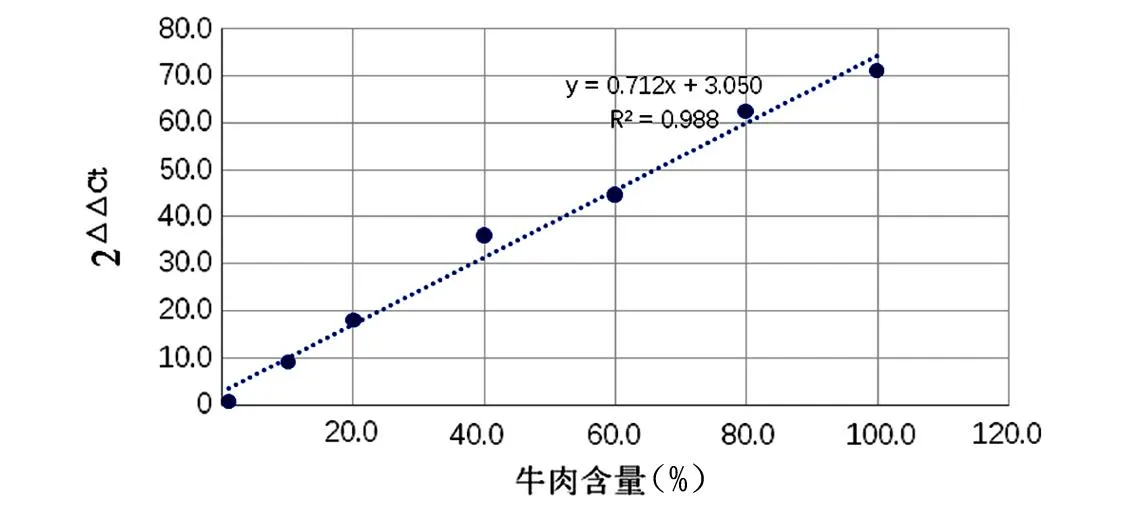
图6 2△△Ct值与牛肉含量建立的标准曲线Fig.6 Standard curve established by 2△△Ct value and beef content
2.6 模拟混合样品验证
将牛肉质量百分比为35%、50%、65%、90%模拟混合样品,经荧光定量PCR扩增后平均Ct值分别代入基于△Ct值与2△△Ct值建立的标准曲线计算牛肉成分含量,并计算回收率,以验证定量检测结果的准确性,结果见表5、表6。基于△Ct值建立的标准曲线检测的模拟混合牛肉含量的回收率在94.30%~102.52%,基于2△△Ct值建立的标准曲线检测的回收率在98.55%~106.30%。基于△Ct值计算的试验结果总体偏低,基于2△△Ct值计算的实验结果总体偏高,取两者平均值后结果见表7,回收率在96.42%~104.42%,由图7可知,其回收率最接近100%,即准确度最高。试验表明,取△Ct值与2△△Ct值模型计算结果后的平均值,得出的牛肉成分含量与实际牛肉成分含量准确度得到提高,可为后期相关检测方法及标准的建立提供参考。

注:A为基于2△△Ct值线性模型结果回收率,B为基于△Ct值线性模型结果回收率,C为A和B结果平均值回收率图7 3种方法结果的回收率比较分析Fig.7 Comparative analysis of the recovery rates of the three methods and results

表5 △Ct值模拟混合肉样检测结果

表6 2△△Ct值模拟混合肉样检测结果

表7 △Ct值与2△△Ct值线性模型均值处理后的混合肉样检测结果
3 讨论与结论
随着肉类掺假案例的暴露,肉类掺假检测技术也随之成了食品安全问题研究的热点,主要研究方法有传统的形态学方法、基于光谱的检测方法、基于蛋白的检测方法和基于核酸的检测方法[2]。其中,基于核酸的实时荧光定量PCR技术灵敏度高、特异性强,在实现肉制品中动物源性成分的定量检测研究中得到广泛应用[18-19]。目前已报道的实时荧光定量PCR技术量化分析方法主要为基于线粒体DNA[17,20-21]和细胞核单拷贝DNA[22-23]两种。然而,由于同一物种在相同组织的不同时期或不同组织间的线粒体DNA拷贝数差异显著[24-25],不适用于定量分析。核DNA 的拷贝数因其在不同品种动物组织中具有良好的稳定性[26],近年来成为物种源性成分定量检测研究的热点。虽然,目前已报道的动物源性成分定量检测方法层出不穷,但尚无可推广的国家标准方法发布。本研究以牛细胞核单拷贝磷酸二酯酶基因(bosPDE)特异的细胞核单拷贝基因为研究对象,通过实时荧光相对定量法△Ct值与2△△Ct值分别建立标准曲线,取两者的平均值,建立了肉制品中牛源性成分及含量的检测方法。研究结果表明,该方法特异性强、灵敏度高,准确度也均比△Ct值或2△△Ct值曲线所得结果的准确度高。本研究建立的方法可准确识别出肉制品中是否含有牛肉成分,并可用于牛肉掺入猪肉或污染猪肉后牛肉含量的量化检测,可为肉制品市场监管及相关标准制定提供有力的科学依据。
