红榄李来源内生真菌Penicillium oxalicum HLLG-13次级代谢产物与生物活性研究
2024-01-10张玉琴徐喆菲白琪琪陈文豪周学明陈光英
王 越, 张玉琴, 徐喆菲, 白琪琪, 陈文豪, 周学明, 陈光英*
(1.海南师范大学 化学与化工学院,热带药用资源化学教育部重点实验室,海南 海口 571127;2.海南省热带药用植物化学重点实验室,海南 海口 571127;3.福建中医药大学 药学院,福建 福州 350122)
红树林是生长在热带、亚热带海岸潮间带,由红树植物为主体的常绿乔木或灌木组成的湿地木本植物群落。根据国家林业和草原局湿地管理司于2021年公布的《中国国际重要湿地名录》,海南省共有红树林自然保护区9个,包含国家级自然保护区1个,省级自然保护区2个,以及市县级自然保护区6个,拥有着丰富的天然药用红树植物资源[1]。红树植物红榄李Lumnitzera littorea(Jacq.) Voigt为使君子科Combretaceae榄李属Lumnitzera植物,已被列入1999 年8 月4 日中国国务院批准的《国家重点保护野生植物名录(第一批)》(Ⅱ级)中,为濒危物种。本课题组前期从红榄李内生真菌分离得到了一系列结构新颖的化合物,并表现出较好的生物活性。如:杨静雨等[2]从红榄李内生真菌Penicillium sclerotiorumHLL113中分离鉴定出2个新的呋喃衍生物,并且展现出显著的α-葡萄糖苷酶抑制活性,其IC50与阳性对照阿卡波糖相当;黄丹瑜等[3]从红榄李内生真菌Nigrospora camelliae-sinensisS30中分离鉴定出2个新的二酮哌嗪类化合物。为了进一步探究红榄李内生真菌次级代谢产物中的活性成分,本研究对一株红榄李内生真菌P.oxalicumHLLG-13的次级代谢产物进行研究,从中分离得到21个单体化合物,分别为2-(4-羟苯基)乙基-(2S)-羟基丙酸(1),2-(4-羟苯基)乙酸乙酯(2),(4-羟苯基)乙酸甲酯(3),4-羟基苯乙醇(4),2,4,5-三甲基间苯二酚(5),1-(2,6-dihydroxyphenyl) butan-1-one(6),rosmarinosin C(7),penicyclone A(8),penicyclone C(9),2-(N-乙酰氨基)苯酚(10),N-乙酰酪胺(11),2-[[(2S)-羟基-1-氧丙基]氨基]苯甲酰胺(12),peniamidone A(13),meleagrin(14),7-羟基-2-(2ʹS-羟丙基)-5-甲基色酮(15),3-甲基-6,8-二羟基异香豆素(16),(-)-6-hydroxymellein(17),(3R)-甲基-5-氯-6,8-二羟基-二氢异香豆素(18),(3R)-甲基-6,8-二羟基-7-甲氧基-二氢异香豆素(19),(-)-citreoisocoumarinol(20)和de-O-methyldiaporthin(21)(图1)。

图1 化合物 1~21的化学结构Figure 1 Structures of Compounds 1-21
1 材料与方法
1.1 仪器与试剂
Bruker EsquireHCT 质谱仪,瑞士Bruker公司;Agilent 1260半制备型高效液相色谱仪,美国安捷伦公司;EYELA N-1001旋转蒸发仪,日本东京理化有限公司;YOKO-ZK紫外分析暗箱,武汉药科新技术开发有限公司;Bruker VANIII-400 MHz 核磁共振仪,瑞士Bruker 公司;恒温水浴锅SB-1000,日本东京理化有限公司;Agilent Eclipse XDB-C18 column(9.4×250 mm, 5 µm)半制备液相柱,美国安捷伦公司;200 ~ 300目薄层层析硅胶,青岛海洋化工厂;C-18反相硅胶,Merck 公司;实验操作过程中所使用的化学试剂均来自广州西陇化工股份有限公司。
1.2 菌株的分离与筛选
1.2.1 菌株来源
从红树植物红榄李(L.littorea)的根部分离、鉴定、筛选出一株代谢产物丰富并且具有一定神经保护活性的菌株HLLG-13;并对其rDNA的ITS序列进行PCR扩增、纯化和测序,在Genbank上通过对真菌核糖体内转录间隔区DNA序列的BLAST分析,确定该真菌为P.oxalicum,该菌的Genbank号为OK560165。菌种现保存于海南师范大学化学与化工学院热带药用资源化学教育部重点实验室(30% 甘油、70% PDB培养基,-80 °C保存)。
1.2.2 菌株培养
将P.oxalicumHLLG-13菌株取出活化,转接到PDA培养基上,放在室温培养箱中培养,2 ~ 3 d后观察其生长情况(如果是单一菌落,即该菌没有污染)。再将接有P.oxalicumHLLG-13菌株的PDA培养基平板放置于超净台上,用灭菌后的接种针挑取菌株接种至装有PDB(马铃薯葡萄糖水) 培养基的1 L锥形瓶中,每1 L的锥形瓶中装有300 mL的PDB培养基,28 °C、130 r/min速度下在摇床中摇荡培养培养3 d,观察种子菌液的生长情况,待种子菌液在培养基中摇荡分布均匀即可,得到种子液。从培养好的种子液中取5 mL接种至大米固体培养基中(每瓶80 g大米、100 mL超纯水、3 g海盐,共发酵200瓶),在28 ℃条件下静置培养28 d。
1.3 提取与分离
发酵28 d后,使用乙酸乙酯(250 mL/瓶,共50 L)浸泡培养基,浸泡3次,每次间隔3 d,合并乙酸乙酯提取物,减压浓缩后得到乙酸乙酯部位浸膏61.27 g。将浸膏进行正相硅胶柱层析 (200 ~ 300目) 梯度洗脱,用石油醚/乙酸乙酯(体积比,100∶0 ~ 0∶100)和乙酸乙酯/甲醇(体积比,20∶1 ~ 0∶100) TLC分析后合并为9个组分(Fr.1 ~ Fr.9)。组分Fr.4(3.2 g)通过反相硅胶柱层析进行洗脱,使用甲醇/水(1∶9 → 100∶0)的梯度洗脱进行分离,TLC分析后合并为13个组分(Fr.4-1 ~ Fr.4-13)。Fr.4-1(722.8 mg)进行半制备HPLC分析制备(乙腈-水,体积比32∶68,3 mL/min),得到化合物16(59.1 mg)和(Fr.4-1-2 ~ Fr.4-1-4)。Fr.4-1-2(36.5 mg)进行半制备HPLC分析制备(乙腈-水,体积比20∶80,3 mL/min),得到化合物3(2.6 mg)。Fr.4-1-3(43.2 mg)进行半制备HPLC分析制备(乙腈-水,体积比22∶78,3 mL/min),得到化合物5(2.3 mg)。Fr.4-1-4(76.2 mg)进行半制备HPLC分析制备(乙腈-水,体积比24∶76,3 mL/min),得到化合物2(6.7 mg)。Fr.4-7(106.3 mg)进行半制备HPLC分析制备(乙腈-水,体积比48∶52,3 mL/min),得到化合物1(7.6 mg)。Fr.4-10(2.7 g)通过正相硅胶柱层析进行洗脱,使用石油醚/乙酸乙酯[体积比,梯度(100∶0) → (0∶100)]的梯度洗脱进行分离,通过TLC分析为5 个组分(Fr.4-10-1 ~ Fr.4-10-5)。Fr.4-10-1(84.1 mg)进行半制备HPLC 分析制备(乙腈-水,体积比70∶30,3 mL/min),得到化合物11(2.3 mg)。组分Fr.5(4.1 g)通过反相硅胶柱层析进行洗脱,使用甲醇/水[(1∶9)→(100∶0)]的梯度洗脱进行分离,通过TLC分析为11个组分(Fr.5-1 ~ Fr.5-11)。Fr.5-1(624.3 mg)进行半制备HPLC 分析制备(甲醇-水,体积比8∶92,3 mL/min),得到(Fr.5-1-1 ~ Fr.5-1-5)。Fr.5-1-1(36.2 mg)进行半制备HPLC分析制备(乙腈-水,体积比12∶88,3 mL/min),得到化合物4(2.6 mg)和化合物10(6.7 mg)。Fr.5-1-5(22.4 mg)进行半制备HPLC分析制备(乙腈-水,体积比8∶ 92,3 mL/min),得到化合物6(2.5 mg)。组分Fr.6(3.9 g)通过反相硅胶柱层析进行洗脱,使用甲醇/水(1∶9 → 100∶0)的梯度洗脱进行分离,通过TLC分析为13个组分(Fr.6-1 ~ Fr.6-13)。Fr.6-1(1.2 g)通过正相硅胶柱层析进行洗脱,使用石油醚/乙酸乙酯[体积比,梯度(100∶ 0) → (0∶100)]的梯度洗脱进行分离,通过TLC分析为8个组分(Fr.6-1-1 ~ Fr.6-1-8)。Fr.6-1-1(206.3 mg)进行半制备HPLC 分析制备(乙腈-水,体积比11∶89,3 mL/min),得到化合物8(41.4 mg)和Fr.6-1-1-2。Fr.6-1-1-2(62.2 mg)进行半制备HPLC分析制备(乙腈-水,体积比9∶91,3 mL/min),得到化合物9(6.6 mg)。Fr.6-1-2(107.6 mg)进行半制备HPLC分析制备(乙腈-水,体积比10∶90,3 mL/min),得到化合物12(18.4 mg)。Fr.6-1-5(281.7 mg)进行半制备HPLC分析制备(乙腈-水,体积比5∶95,3 mL/min),得到化合物7(7.1 mg)和化合物13(4.1 mg)。Fr.6-4(77.6 mg)进行半制备HPLC 分析制备(乙腈-水,体积比19∶81,3 mL/min),得到化合物15(19.3 mg)、化合物20(16.4 mg)和化合物21(4.8 mg)。组分Fr.7(6.2 g)通过反相硅胶柱层析进行洗脱,使用甲醇/水(1∶9 → 100∶0)的梯度洗脱进行分离,通过TLC 分析为10 个组分(Fr.7-1 ~ Fr.7-10)。Fr.7-1(544.0 mg)进行半制备HPLC 分析制备(乙腈-水,体积比20∶80,3 mL/min),得到化合物17(81.0 mg)和化合物19(5.8 mg)。Fr.7-2(27.9 mg)进行半制备HPLC 分析制备(乙腈-水,体积比40∶60,3 mL/min),得到化合物18(3.6 mg)。组分Fr.8(6.2 g)通过反相硅胶柱层析进行洗脱,使用甲醇/水(1∶9→ 100∶0)的梯度洗脱进行分离,通过TLC分析为10个组分(Fr.8-1 ~ Fr.8-10)。Fr.8-5(579.6 mg)进行半制备HPLC分析制备(乙腈-水,体积比40 ∶ 60,3 mL/min),得到化合物14(133.4 mg)。
1.4 抗菌活性测试
采用微量稀释法测试化合物1~21 对5 株人致病菌[金黄葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、白色念珠菌(Candida Albicans)、表皮葡萄球菌(Staphylococcus epidermidis)、铜绿假单胞菌(Pseudomonas aeruginosa)]和3 株海洋弧菌[哈维氏弧菌(Vibrio harveyi)、溶藻弧菌(Vibrio alginolyticus)、副溶血性弧菌(Vibrio parahaemolyticus)]的抗菌活性,具体实验操作方法参考文献[4]。二甲基亚砜(DMSO)为阴性对照,环丙沙星为阳性对照。
1.5 神经保护活性测试
采用CCK8方法对化合物1~21进行神经保护活性测试,具体实验操作方法参考文献[5]。测试细胞为小鼠海马神经元细胞(HT22),细胞培养液为90% DMEM-H + 10% FBS,阴性对照组为H2O2损伤组,阳性对照为100 µmol/L依达拉奉。于450 nm波长下测定各孔光吸收值(OD值)。重复实验3次。各组设定为3个复孔。采用SPSS软件进行方差分析,结果以平均值±标准差表示。
2 结果与讨论
2.1 化合物结构鉴定
化合物1:无色油状。阳离子ESI-MS在m/z211.1处给出准分子离子峰 [M + H]+,推测分子量为210.1,结合1H和13C NMR波谱数据,推断其相对分子式为C11H14O4,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,DMSO-d6)δH: 4.18 (2H, m, H-8), 2.76 (2H, t,J= 6.8 Hz, H-7), 7.02 (2H, d,J= 8.4 Hz, H-2, 6), 6.67 (2H, d,J=8.4 Hz, H-3, 5), 4.08 (1H, m, H-2′), 1.18 (3H, d,J= 6.8 Hz, H-3′), 9.22 (1H, s, 4-OH), 5.34 (1H, d,J= 6.0 Hz,2′-OH)。13C NMR (100 MHz, DMSO-d6)δC: 127.8 (C-1), 129.8 (C-2, 6), 115.1 (C-3, 5), 155.9 (C-4), 33.6 (C-7),64.8 (C-8), 174.5 (C-1′), 65.9 (C-2′), 20.4 (C-3′)。根据其1H和13C NMR数据并与文献[6]数据比对,确定化合物1为2-(4-羟苯基)乙基-(2S)-羟基丙酸。
化合物2:黄色油状。阳离子ESI-MS在m/z181.1处给出准分子离子峰 [M + H]+,推测分子量为180.1,结合1H和13C NMR波谱数据,推断其相对分子式为C10H12O3,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,methanol-d4)δH: 4.19 (2H, t,J= 7.2 Hz, H-1), 2.82 (2H, t,J= 7.2 Hz, H-2), 7.03 (2H, d,J= 8.8 Hz, H-4, 8), 6.70(2H, d,J= 8.4 Hz, H-5, 7), 2.00 (3H, s, H-2′)。13C NMR (100 MHz, methanol-d4)δC: 66.6 (C-1), 35.2 (C-2),130.0 (C-3), 130.9 (C-4, 8), 116.2 (C-5, 7), 157.1 (C-6), 172.9 (C-1′), 20.8 (C-2′)。根据其1H 和13C NMR 数据并与文献[7]数据比对,确定化合物2为2-(4-羟苯基)乙酸乙酯。
化合物3:黄色油状。阳离子ESI-MS在m/z167.1处给出准分子离子峰 [M + H]+,推测分子量为166.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C9H10O3,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,methanol-d4)δH:7.06 (2H, d,J= 8.4 Hz, H-2, 6), 6.71 (2H, d,J= 8.4 Hz, H-3, 5), 3.53 (2H, s, H-7), 3.66 (3H, s,H-9)。13C NMR (100 MHz, methanol-d4)δC:126.3 (C-1), 116.3 (C-2, 6), 131.3 (C-3, 5), 157.6 (C-4), 40.9 (C-7),174.6 (C-8), 52.4 (C-9)。根据其1H 和13C NMR 数据并与文献[8]数据比对,确定化合物3 为(4-羟苯基)乙酸甲酯。
化合物4:黄色油状。阳离子ESI-MS在m/z139.1处给出准分子离子峰 [M + H]+,推测分子量为138.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C8H10O2,不饱和度为4。核磁波谱数据:1H NMR (400 MHz,DMSO-d6)δH: 6.96 (2H, d,J= 8.4 Hz, H-2, 6), 6.64 (2H, d,J= 8.4 Hz, H-3, 5), 2.59 (2H, t,J= 7.2 Hz, H-7),3.51 (2H, t,J= 7.2 Hz, H-8), 9.33 (1H, s, 4-OH), 4.57 (1H, s, 8-OH)。13C NMR (100 MHz, DMSO-d6)δC: 129.3(C-1), 129.6 (C-2, 6), 114.9 (C-3, 5), 155.6 (C-4), 38.3 (C-7), 62.6 (C-8)。根据其1H 和13C NMR 数据并与文献[9]数据比对,确定化合物4为4-羟基苯乙醇。
化合物5:棕色粉末。阳离子ESI-MS在m/z153.1处给出准分子离子峰 [M + H]+,推测分子量为152.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C9H12O2,不饱和度为4。核磁波谱数据:1H NMR (400 MHz,CDCl3)δH: 6.26 (1H, s, H-1), 2.12 (3H, s, H-7), 2.09 (3H, s, H-8), 2.19 (3H, s, H-9)。13C NMR (100 MHz, CDCl3)δC: 109.1 (C-1),151.8 (C-2), 107.2 (C-3), 152.7 (C-4), 114.0 (C-5), 135.1 (C-6), 8.3 (C-7), 11.4 (C-8), 20.1 (C-9)。根据其1H和13C NMR数据并与文献[10]数据比对,确定化合物5为2,4,5-三甲基间苯二酚。
化合物6:黄色油状。阳离子ESI-MS在m/z181.1处给出准分子离子峰 [M + H]+,推测分子量为180.1,结合1H和13C NMR波谱数据,推断其相对分子式为C10H12O3,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,DMSO-d6):δH7.18 (1H, t,J= 8.0 Hz, H-4), 6.36 (2H, d,J= 8.0 Hz, H-3, 5), 3.02 (2H, t,J= 7.2 Hz, H-8), 1.61(2H, m, H-9), 0.90 (3H, t,J= 7.2 Hz, H-10), 1.24 (3H, d,J= 6.8 Hz, H-11)。13C NMR (100 MHz, DMSO-d6):δC110.8 (C-1), 161.5 (C-2, 6), 107.2 (C-3, 5), 135.4 (C-4), 207.4 (C-7), 46.1 (C-8), 17.4 (C-9), 13.8 (C-10)。根据其1H和13C NMR数据并与文献[11]数据比对,确定化合物6为1-(2,6-dihydroxyphenyl)butan-1-one。
化合物7:黄色油状。阳离子ESI-MS在m/z243.1处给出准分子离子峰 [M + H]+,推测分子量为242.1,结合1H和13C NMR波谱数据,推断其相对分子式为C11H14O6,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,DMSO-d6)δH: 6.64 (1H, d,J= 2.0 Hz, H-2), 6.63 (1H, d,J= 4.0 Hz, H-5), 6.48 (1H, dd,J= 8.0, 2.0 Hz, H-6),3.44 (2H, m, H-7), 3.62 (1H, m, H-8), 4.04 (1H, dd,J= 11.2, 6.4 Hz, H-10a), 3.89 (1H, dd,J= 11.2, 4.2 Hz, H-10b), 3.34 (2H, m, H-11)。13C NMR (100 MHz, DMSO-d6)δC: 125.0 (C-1), 116.7 (C-2), 145.1 (C-3), 144.2 (C-4),115.4 (C-5), 120.0 (C-6), 39.7 (C-7), 69.3 (C-8), 171.6 (C-9), 65.9 (C-10), 62.6 (C-11)。根据其1H 和13C NMR数据并与文献[12]数据比对,确定化合物7为rosmarinosin C。
化合物8:棕色油状。阳离子ESI-MS在m/z241.1处给出准分子离子峰 [M + H]+,推测分子量为240.1,结合1H和13C NMR波谱数据,推断其相对分子式为C12H16O5,不饱和度为5。核磁波谱数据:1H NMR (400 MHz,DMSO-d6)δH: 5.87 (1H, s, H-2), 4.17 (1H, d,J= 4.4 Hz, H-4), 3.83 (1H, d,J= 4.4 Hz, H-5), 2.21 (1H, dt,J=14.6, 3.8 Hz, H-7a), 2.00 (1H, dt,J= 14.6, 3.8 Hz, H-7b), 1.77 (1H, m, H-8a), 1.23 (1H, m, H-8b), 2.40 (1H, m,H-9), 2.03 (3H, s, H-11), 1.12 (3H, d,J= 6.8 Hz, H-12)。13C NMR (100 MHz, DMSO-d6)δC: 196.1 (C-1), 123.4(C-2), 162.0 (C-3), 69.3 (C-4), 70.9 (C-5), 87.8 (C-6), 24.6 (C-7), 24.6 (C-8), 34.8 (C-9), 173.8 (C-10), 21.6 (C-11), 16.9 (C-12)。根据其1H和13C NMR数据并与文献[13]数据比对,确定化合物8为penicyclone A。
化合物9:黄色油状。阳离子ESI-MS在m/z273.1处给出准分子离子峰 [M + H]+,推测分子量为272.1,结合1H和13C NMR波谱数据,推断其相对分子式为C13H20O6,不饱和度为4。核磁波谱数据:1H NMR (400 MHz,DMSO-d6)δH: 5.66 (1H, s, H-2), 4.43 (1H, dd,J= 7.8, 3.6 Hz, H-4), 3.77 (1H, dd,J= 7.8, 4.2 Hz, H-5), 1.73(1H, dt,J= 11.8, 2.8 Hz, H-7a), 1.56 (1H, dt,J= 11.8, 2.8 Hz, H-7b), 1.63 (1H, m, H-8a), 1.46 (1H, m, H-8b),2.37 (1H, m, H-9), 1.91 (3H, s, H-11), 1.07 (3H, d,J= 6.8 Hz, H-12), 3.59 (3H, s, H-13), 5.16 (1H, s, 4-OH),4.92 (1H, s, 5-OH), 5.26 (1H, s, 6-OH)。13C NMR (100 MHz, DMSO-d6)δC: 197.8 (C-1), 123.2 (C-2), 159.8 (C-3), 68.5 (C-4), 73.7 (C-5), 75.6 (C-6), 28.7 (C-7), 25.8 (C-8), 39.5 (C-9), 176.4 (C-10), 20.1 (C-11), 16.8 (C-12),51.2 (C-13)。根据其1H和13C NMR数据并与文献[13]数据比对,确定化合物9为penicyclone C。
化合物10:黄棕色粉末。阳离子ESI-MS 在m/z152.1 处给出准分子离子峰 [M + H]+,推测分子量为151.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C8H9NO2,不饱和度为5。核磁波谱数据:1H NMR(400 MHz, DMSO-d6)δH: 7.69 (1H, dd,J= 8.0, 1.4 Hz, H-3), 6.72 (1H, m, H-4), 6.91 (1H, m, H-5), 6.84 (1H, dd,J= 8.0, 1.4 Hz, H-6), 2.08 (3H, s, H-8), 9.34 (1H, s, NH)。13C NMR (100 MHz, DMSO-d6)δC:148.2 (C-1), 126.5(C-2), 122.2 (C-3), 118.6 (C-4), 124.5 (C-5), 115.9 (C-6), 168.8 (C-7), 23.6 (C-8)。根据其1H 和13C NMR 数据并与文献[14]数据比对,确定化合物10为2-(N-乙酰氨基)苯酚。
化合物11:黄色油状。阳离子ESI-MS在m/z180.1处给出准分子离子峰 [M + H]+,推测分子量为179.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C10H13NO2,不饱和度为5。核磁波谱数据1H NMR (400 MHz, methanol-d4)δH: 3.15 (2H, t,J= 8.8 Hz, H-1), 2.66 (2H, t,J= 8.8 Hz, H-2), 7.00 (2H, d,J= 8.4 Hz, H-4,8), 6.69 (2H, d,J= 8.4 Hz, H-5, 7), 1.89 (3H, s, H-2′)。13C NMR (100 MHz, methanol-d4)δC: 41.5 (C-1), 34.6 (C-2), 130.2 (C-3), 129.7 (C-4, 8), 115.3 (C-5, 7), 156.0 (C-6), 172.3 (C-1′), 21.6 (C-2′)。根据其1H 和13C NMR 数据并与文献[15]数据比对,确定化合物11为N-乙酰酪胺。
化合物12:棕色油状。阳离子ESI-MS在m/z209.1处给出准分子离子峰 [M + H]+,推测分子量为208.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C10H12N2O3,不饱和度为6。核磁波谱数据:1H NMR (400 MHz, DMSO-d6)δH: 7.75 (1H, dd,J= 7.8, 1.2 Hz, H-3), 7.47 (1H, t,J= 7.2 Hz, H-4), 7.11 (1H, t,J= 7.2 Hz, H-5), 8.58 (1H, d,J= 8.4 Hz, H-6), 4.09 (1H, q,J= 6.8 Hz, H-9), 1.29 (3H, d,J= 6.8 Hz, H-10), 8.16 (1H, s, 7-NH), 7.59 (1H, s, 8-NH), 5.98 (1H, s, 9-OH)。13C NMR (100 MHz, DMSO-d6)δC: 120.9 (C-1), 138.7 (C-2), 122.4(C-3), 131.8 (C-4), 119.9 (C-5), 128.5 (C-6), 170.3 (C-7), 174.1 (C-8), 67.9 (C-9), 20.9 (C-10)。根据其1H和13C NMR数据并与文献[16]数据比对,确定化合物12为2-[[(2S)-羟基-1-氧丙基]氨基]苯甲酰胺。
化合物13:棕色油状。阳离子ESI-MS在m/z226.1处给出准分子离子峰 [M + H]+,推测分子量为225.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C11H15NO4,不饱和度为5。核磁波谱数据:1H NMR (400 MHz, DMSO-d6)δH: 7.26 (1H, s, H-3), 7.15 (1H, d,J= 8.0 Hz, H-5), 6.72 (1H, d,J= 8.2 Hz, H-6), 3.18 (2H, m,H-8), 1.48 (2H, m, H-9), 1.43 (2H, m, H-10), 3.40 (2H, m, H-11), 8.09 (1H, s, 7-NH)。13C NMR (100 MHz,DMSO-d6)δC: 148.2 (C-1), 144.8 (C-2), 115.1 (C-3), 126.0 (C-4), 118.8 (C-5), 114.8 (C-6), 166.0 (C-7), 39.0 (C-8), 30.0 (C-9), 26.0 (C-10), 60.6 (C-11)。根据其1H和13C NMR 数据并与文献[17]数据比对,确定化合物13为peniamidone A。
化合物14:棕色粉末。阳离子ESI-MS在m/z434.2处给出准分子离子峰 [M + H]+,推测分子量为433.2,结合1H和13C NMR波谱数据,推断其相对分子式为C23H23N5O4,不饱和度为15。核磁波谱数据:1H NMR (400 MHz, DMSO-d6)δH: 7.53 (1H, d,J= 7.4 Hz, H-4), 7.24 (1H, t,J= 7.4 Hz, H-5), 7.26 (1H, t,J= 7.4 Hz, H-6),6.97 (1H, d,J= 7.6 Hz, H-7), 5.27 (1H, s, H-8), 10.18 (1H, s, 14-NH), 8.21 (1H, s, H-15), 7.77 (1H, s, H-18),12.96 (1H, s, 19-NH), 6.01 (1H, s, H-22), 4.98 (2H, m, H-23), 1.20 (6H, s, H-24, 25), 3.67 (3H, s, H-26)。13C NMR (100 MHz, DMSO-d6)δC: 101.4 (C-2), 52.3 (C-3), 126.1 (C-3a), 123.8 (C-4), 123.2 (C-5), 128.0 (C-6),111.6 (C-7), 146.3 (C-7a), 109.2 (C-8), 143.0 (C-9), 158.6 (C-10), 123.2 (C-12), 164.8 (C-13), 107.1 (C-15),124.7 (C-16), 137.3 (C-18), 133.7 (C-20), 41.9 (C-21), 143.4 (C-22), 112.9 (C-23), 24.1 (C-24), 23.2 (C-25),64.8 (C-26)。根据其1H和13C NMR数据并与文献[18]数据比对,确定化合物14为meleagrin。
化合物15:棕色粉末。阳离子ESI-MS在m/z235.1处给出准分子离子峰 [M + H]+,推测分子量为234.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C13H14O4,不饱和度为7。核磁波谱数据:1H NMR (400 MHz, methanol-d4)δH: 6.05 (1H, s, H-3), 6.61 (1H, dd,J= 2.4, 0.8 Hz, H-6), 6.64 (1H, d,J= 2.4 Hz, H-8), 2.72(1H, dd,J= 14.4, 5.2 Hz, H-9a), 2.64 (1H, dd,J= 14.4, 7.8 Hz, H-9b), 4.18 (1H, m, H-10), 1.26 (3H, d,J= 6.4 Hz, H-11), 2.70 (3H, s, H-12)。13C NMR (100 MHz, methanol-d4)δC: 167.1 (C-2), 118.0 (C-3), 181.9 (C-4),115.8 (C-4a), 143.6 (C-5), 112.5 (C-6), 161.4 (C-7), 101.7 (C-8), 163.1 (C-8a), 44.2 (C-9), 66.3 (C-10), 23.5 (C-11), 23.1 (C-12)。根据其1H 和13C NMR 数据并与文献[19]数据比对,确定化合物15 为7-羟基-2-(2ʹS-羟丙基)-5-甲基色酮。
化合物16:棕色粉末。阳离子ESI-MS在m/z193.0处给出准分子离子峰 [M + H]+,推测分子量为192.0,结合1H和13C NMR波谱数据,推断其相对分子式为C10H8O4,不饱和度为7。核磁波谱数据1H NMR (400 MHz,DMSO-d6)δH: 6.41 (s, H-4), 6.29 (d,J= 2.0 Hz, H-5), 6.28 (d,J= 2.0 Hz, H-7), 2.18 (s, H-9)。13C NMR (100 MHz, DMSO-d6).δC: 166.2 (C-1), 153.9 (C-3), 104.2 (C-4), 139.6 (C-4a), 102.5 (C-5), 165.5 (C-6), 101.4 (C-7),162.7 (C-8), 97.6 (C-8a), 18.8 (C-9)。根据其1H 和13C NMR 数据并与文献[20]数据比对,确定化合物16 为3-甲基-6,8-二羟基异香豆素。
化合物17:白色粉末。阳离子ESI-MS在m/z195.1处给出准分子离子峰 [M + H]+,推测分子量为194.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C10H10O4,不饱和度为6。核磁波谱数据:1H NMR (400 MHz, DMSO-d6,)δH: 4.66 (1H, ddq,J= 12.6, 6.4, 2.8 Hz, H-3), 2.89 (1H, dd,J= 16.4, 3.4 Hz, H-4a), 2.78 (1H,dd,J= 16.4, 11.2 Hz, H-4b), 6.22 (1H, d,J= 2.2 Hz, H-5), 6.19 (1H, d,J= 2.2 Hz, H-7), 1.37 (3H, d,J= 6.4 Hz,H-9), 10.60 (1H, s, 6-OH), 11.13 (1H, s, 8-OH)。13C NMR (100 MHz, DMSO-d6)δC: 169.5 (C-1), 75.4 (C-3),33.8 (C-4), 142.2 (C-4a), 106.8 (C-5), 163.5 (C-6), 100.1 (C-7), 164.5 (C-8), 100.9 (C-8a), 20.3 (C-9)。根据其1H和13C NMR数据并与文献[21]数据比对,确定化合物17为(-)-6-hydroxymellein。
化合物18:淡黄色粉末。阳离子ESI-MS 在m/z229.0 处给出准分子离子峰 [M + H]+,推测分子量为228.0,结合1H和13C NMR波谱数据,推断其相对分子式为C10H9ClO4,不饱和度为6。核磁波谱数据:1H NMR(400 MHz, DMSO-d6,)δH: 4.71 (1H, m, H-3), 3.17 (1H, dd,J= 17.0, 2.0 Hz, H-4a), 2.77 (1H, dd,J= 17.0, 11.6 Hz, H-4b), 6.42 (1H, d,J= 1.4 Hz, H-7), 1.43 (3H, d,J= 6.4 Hz, H-9), 10.60 (1H, s, 6-OH), 11.21 (1H, s, 8-OH)。13C NMR (100 MHz, DMSO-d6)δC: 169.0 (C-1), 74.7 (C-3), 31.7 (C-4), 139.0 (C-4a), 110.0 (C-5), 160.4(C-6), 100.8 (C-7), 161.6 (C-8), 101.7 (C-8a), 20.2 (C-9)。根据其1H 和13C NMR 数据并与文献[22]数据比对,确定化合物18为(3R)-甲基-5-氯-6,8-二羟基-二氢异香豆素。
化合物19:棕色油状。阳离子ESI-MS在m/z225.1处给出准分子离子峰 [M + H]+,推测分子量为224.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C11H12O5,不饱和度为6。核磁波谱数据:1H NMR (400 MHz, DMSO-d6)δH: 4.68 (1H, ddd,J= 11.4, 6.2, 3.6 Hz, H-3), 2.88 (1H, dd,J= 16.4, 3.4 Hz, H-4a), 2.76 (1H,dd,J= 16.4, 11.2 Hz, H-4b), 6.31 (1H, s, H-5), 1.38 (3H, d,J= 6.4 Hz, H-9), 3.69 (3H, s, H-10),11.20 (1H, s, 8-OH)。13C NMR (100 MHz, DMSO-d6)δC: 169.7 (C-1), 75.7 (C-3), 33.3 (C-4), 135.9 (C-4a), 106.8 (C-5), 156.0(C-6), 133.5 (C-7), 157.1 (C-8), 100.5 (C-8a), 20.3 (C-9), 59.8 (C-10)。根据其1H和13C NMR数据并与文献[23]数据比对,确定化合物19为(3R)-甲基-6,8-二羟基-7-甲氧基-二氢异香豆素。
化合物20:棕色晶体。阳离子ESI-MS在m/z281.1处给出准分子离子峰 [M + H]+,推测分子量为280.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C14H16O6,不饱和度为7。核磁波谱数据:1H NMR (400 MHz, methanol-d4)δH: 6.36 (s, H-4), 6.30 (s, H-5), 6.30 (s, H-7), 2.56 (dd,J= 8.4, 14.6 Hz, H-9a), 2.69(dd,J=4.4, 14.6 Hz, H-9b), 4.14 (d, H-10), 1.71 (m, H-11a), 1.61 (m, H-11b), 3.98 (m, H-12), 1.20(d,J= 6.2 Hz, H-13)。13C NMR (100 MHz, methanol-d4)δC: 167.8 (C-1), 155.9 (C-3), 107.2 (C-4), 141.2 (C-4a), 103.7 (C-5),167.3 (C-6), 102.6 (C-7), 164.8 (C-8), 99.8 (C-8a), 42.5 (C-9), 68.7 (C-10), 46.4 (C-11), 67.1 (C-12), 23.6 (C-13)。根据其1H和13C NMR数据并与文献[24]数据比对,确定化合物20为(-)-citreoisocoumarinol。
化合物21:棕色晶体。阳离子ESI-MS在m/z237.1处给出准分子离子峰 [M + H]+,推测分子量为236.1,结合1H 和13C NMR 波谱数据,推断其相对分子式为C12H12O5,不饱和度为7。核磁波谱数据:1H NMR (400 MHz, methanol-d4)δH: 6.37 (s, H-4), 6.30 (s, H-5), 6.30 (s, H-7), 2.58 (m, H-11), 4.14 (m, H-12), 1.25 (d,J= 6.4 Hz, H-13)。13C NMR (100 MHz, methanol-d4)δC: 167.9 (C-1), 156.1 (C-3), 141.2 (C-4), 99.6 (C-5), 164.8 (C-6),107.0 (C-7), 167.9 (C-8), 102.8 (C-9), 103.9 (C-10), 43.8 (C-11), 66.2 (C-12), 23.3 (C-13)。根据其1H 和13C NMR数据并与文献[25]数据比对,确定化合物21为de-O-methyldiaporthin。
2.2 抗菌活性测试结果
对化合物1~21 进行了金黄葡萄球菌(S.aureus)、大肠杆菌(E.coli)、白色念珠菌(C.Albicans)、表皮葡萄球菌(S.epidermidis)、铜绿假单胞菌(P.aeruginosa)、哈维氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)、副溶血性弧菌(V.parahaemolyticus)8株菌的抗菌活性测试,结果表明化合物1~21对以上菌株均无明显抗菌活性。
2.3 神经保护活性测试结果
对化合物1~21进行了神经保护活性测试,活性结果显示化合物16 在10 ~ 200 µmol/L 条件下均展现出一定的神经保护活性,特别是在200 µmol/L浓度条件活性最好,可以将细胞存活率从43.36% 提高至60.15%(表1)。
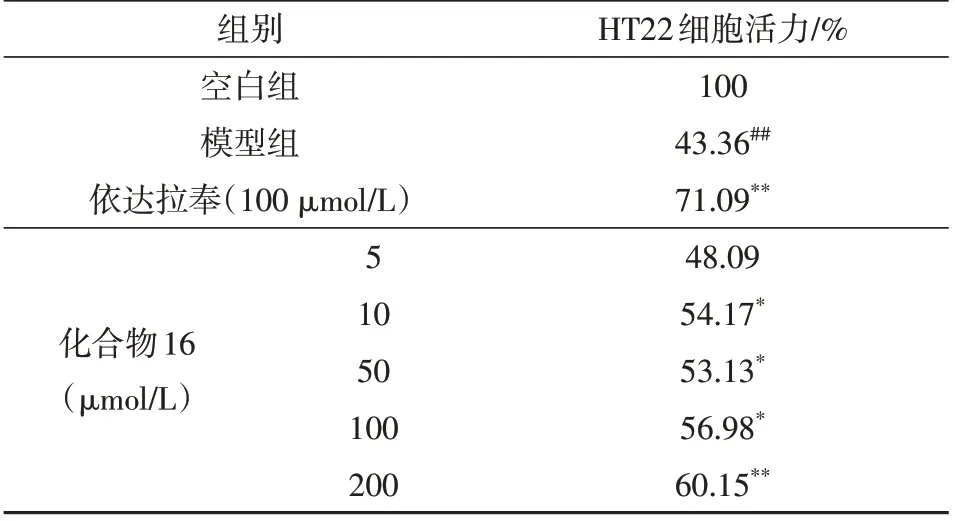
表1 化合物16对H2O2诱导HT22氧化损伤的细胞活力的影响Table 1 Effect of compound 16 on cell viability of HT22 oxidative damage induced by H2O2
3 结论
运用多种色谱分离手段和波谱鉴定技术,从一株红榄李(L.littorea)内生真菌P.oxalicumHLLG-13中分离鉴定了21个已知单体化合物,包括7个酚类化合物(1~7),5个含氮类化合物(10~14),6个异香豆素类化合物(16~21),以及3个其他类化合物(8~9, 15)。活性测试结果发现化合物16在10 ~ 200 µmol/L 范围内具有一定的神经保护活性,在200 µmol/L浓度条件下活性最佳,可以将细胞存活率从43.36%提高至60.15%。本研究可为濒危药用红树植物红榄李的可持续开发利用提供理论依据,同时为缺血性脑卒中治疗药物的先导化合物提供了研究基础。
