新型Argonaute蛋白的挖掘及体外活性表征
2024-01-10方蒙君司振军沈培杰徐志南
方蒙君, 司振军, 沈培杰, 黄 迪, 徐志南
(浙江大学 化学工程与生物工程学院,浙江 杭州 310000)
Argonaute 蛋白(Agos)广泛存在于原核和真核生物中[1],可以通过短核苷酸的介导来结合或切割与其序列互补的核酸分子[2]。真核生物来源的Agos(eukaryotic Agos,eAgos)是RNA 干扰途径(RNA interference,RNAi)中的主要组成部分,用于调控基因的表达和抵抗病毒的入侵[3-5]。而原核生物来源的Agos(prokaryotic Agos,pAgos)也有免疫功能,可以降解入侵的遗传元件,如质粒和噬菌体核酸等[6-7]。
eAgos主要通过RNA的介导特异性切割RNA分子,而pAgos则更偏好以单链DNA(single-stranded DNA,ssDNA)为导向切割DNA 靶标[8-9]。然而随着研究的深入,越来越多具有多样功能的pAgos 引起了人们的注意。例如,来自Kurthia massiliensis的KmAgo[10-11]和Marinitoga piezophila的MpAgo[12]可以通过ssDNA 或RNA的介导切割DNA和RNA底物。除了导向核酸类型之外,pAgos的核酸酶活性还受导向的5末端修饰基团的影响。大多数pAgos偏好具有5末端磷酸基团的导向核酸,此时切割位点位于导向的第10-11位碱基对应的磷酸二酯键[13]。而某些pAgos也可利用5′末端为羟基的核酸为导向,此时切割位点会发生迁移,位于第11-12位碱基之间[10]。
pAgos的可编码核酸内切酶活性使得它在核酸操作领域,例如基因组编辑[14-15]、人工限制性核酸内切酶开发[16]和核酸检测[17]等,具有广阔的应用前景。然而,目前只有少数几种pAgos的酶学性质、催化机理和结构进行了研究分析。因此,对于新型pAgos的挖掘和研究不仅可以深化我们对Agos的了解,还可以为核酸操作领域提供更多的工具蛋白。本研究通过在NCBI中比对已报道的、具有核酸酶活性的pAgos序列,获得了一些同源性较高的新型pAgos,并对其进行了表达纯化和体外活性验证,为后续的pAgos研究工作提供了新的参考和借鉴。
1 材料与方法
1.1 材料
1.1.1 培养基LB培养基:10 g/L氯化钠、5 g/L酵母提取物、10 g/L蛋白胨(固体培养基再添加1.5%的琼脂粉);TB培养基:24 g/L酵母提取物、12 g/L蛋白胨、12.5 g/L磷酸氢二钾、2.3 g/L磷酸二氢钾、4 g/L甘油。
1.1.2 商品化试剂
Bradford 蛋白浓度测定试剂盒,翌圣生物,货号20202ES86;2 × SSCP去离子甲酰胺凝胶上样缓冲液,上海生工,货号B548;4 × Protein SDS-PAGE Loading Buffer,TaKaRa,货号9173;Acryl/Bis 40% Solution,37.5∶1,上海生工,货号B54601;大肠杆菌BL21(DE3)感受态细胞,上海生工,货号B528419-0005。
1.1.3 SDS-PAGE试剂
15%分离胶:3.867 mL Acryl/Bis 40% Solution(37.5∶1)、2.533 mL Tris-HCl(1.5 mol/L,pH8.8)、100 µL 10% APS、100 µL 10% SDS、10 µL TEMED,去离子水补充至10 mL;5%浓缩胶:0.62 mL Acryl/Bis 40% Solution(37.5∶1)、0.62 mL Tris-HCl(1 mol/L,pH6.8)、50 µL 10% APS、50 µL 10% SDS、4 µL TEMED,去离子水补充至5 mL;5×SDS-PAGE 电泳缓冲液:0.125 mol/L Tris、1.25 mol/L glycine、0.5% SDS;染色液:80 mL 去离子水、100 mL甲醇、20 mL乙酸、0.5 g考马斯R-250;脱色液:600 mL去离子水、300 mL甲醇、100 mL乙酸。
1.1.4 尿素-PAGE试剂
10×TBE:108 g/L Tris、55 g/L 硼酸、7.44 g/L 二水合Na2EDTA;14%尿素-PAGE 配方:4.2 g 尿素、3.5 mL Acryl/Bis 40% Solution(37.5∶1)、1 mL 10×TBE、100 µL 10% APS、10 µL TEMED,去离子水补充至10 mL。
1.1.5 亲和纯化试剂破胞缓冲液:20 mmol/L Tris-HCl、0.3 mol/L NaCl、20 mmol/L 咪唑,pH7.5;洗脱缓冲液:20 mmol/L Tris-HCl、0.3 mol/L NaCl、250 mmol/L咪唑,pH7.5;蛋白保存缓冲液:20 mmol/L Tris-HCl、0.1 mol/L KCl,pH7.5。
1.1.6 寡核苷酸序列
FAM-tDNA:FAM-aaaataatttaatatactatacaacctactacctcttata;
FAM-tRNA:FAM-aaaauaauuuaauauacuauacaaccuacuaccucuuaua;
P/OH-gDNA:P/OH-tgaggtagtaggttgtata;
P/OH-gRNA:P/OH-gagguaguagguuguaua。
1.1.7 氨基酸序列
TtrAgo(Thermococcus thioreducens):MLMKVLTNMVKLNQDIIPNEIYLYKIFNKPEDGMNIYKIAYRNHGIVI DPQNRIIATPSELEYSGKFAIEDEISFNELPENYQNRLVLRILRDNGISDHALSRTLQKYRKPKPFGDFEVIPEIRSS VIKHGGDFYLVLHLSHQIRSKKTLWELVGRNKDALRDFLKEHRGTILLRDIASEHKVVYKPIFKRYNGDPDLIED NSNDVEHWYDYHLERYWNTPELKKEFYKKFGPVDLNQPIILAKPLRQHNRGDLVHLLPQFVVPVYNAEQLNDI LASEILEYLKLTSNQRISLLSRLINDIKTNTNIIVSSLTELEANTFDVDLNDMLQVRNADNVKVTLSELEISKTRLFTW MKSRKYPVILPYDIPQKLKKIEKIPVFIIVDSALSRDIQTFAKDEFRYLISSLQKSLSNWVDFPILDIRDKYIFTIDLTS DKDIVNLSIKLVNLMKNAELGLALIATRTKLPNETFDEVKKRLFSVNIISQVVNEATLYKRDKYNESRLNLYVQH NLLFQILSKLGIKYYVLRHKFSYDYIVGIDVTPMKLSHGYIGGSAVMFDSQGYIRKIIPVEIGEQMGESIDMKEFFK DMVVQFGKFGIDLEGKSILILRDGKITKDEEEGLAYISKVFGIKITTFNIVKRHLLRIFANRKLYLRLANSVYLLPH RIKQSVGTPVPLKLSEKRLILDGTITSQEITYNDIFEILLLSELNYGSISADMKLPAPVHYAHKFVRALRKGWRIRE ELLAEGFLYFV;
TeAgo(Thermococcus eurythermalis):MNIDEYQTNMYKIKSSIVKEAFSDLVSVEILLGQKLNHREIYRIVQGK FGGLVYKHDEMLGKVVAVIKEEYISELENEPEIQVLSIQAFDVSSLDKNKREKLLLNILKKKGHLFQILRHKQVIG KIENRTIRRTFRVSIESEGKEYYIVVLPRHEIIEDSTIMDLLIKGELTIEDLKINLIEKGTWKITSFRKDIDVSPNAVE EIILKVEDPSRYNAELKRINEYFITRTSLEPIDDSKYPDKYNMILITKGKRYSYHPSRAMLIRPVEGELQKKIHHSG EFLKALNIAAEYIKDIIETSKRATFEGVQIPSQDIYYKATFLENGRIIRKKIAPYYNIKNTFNWLFKNEPFEKTYSLI VPTKTPKFIKDKKIAIYLLYPKEFSKERTTLVSDVKSALDRVSEYFAYLRTISMTSSLSLPVEITTPLIAVDYTNLAQ RLTKIFEKYENYDYHLAITFVPSMSREQFDRIKKFFFERGIIHKAINIDNLNSKFGKNKQRIIESVILQALYAFGIYF YSLDNLPYDIIIGIDVTREKDKNGKYYGISGAAVVQNKNGEIIKIVPITQPQSSSETVDVEKIFESLQPELDQIVETKS NVDILILRDGRIPSREIEQLKRLSLRRPYTFTLVGIIKRPLVRFFKGTDRHLFGPKPNYYFRIGDTYYLTSHFLEHYL KVPLKLERKYVISRGKLATSPLNHEDILAITKLTKLNYSQPKNPDRMKLPAPVHLSHRLINYERRGLRFARPEFLQ EGALYFL;
DeAgo(Domibacillus enclensis):MEPYITEATAIGLASDIHLHVYEFPVDNPLKKYEGVSDICREWKRANGYM AVAYNQSTIATLEPVVNYAGFEPLSYQEKPIDPDNPFERSLLERLLKEGLLTAGQQKLKLKRVGADLQEWEPKRV GRILIYPALSFHVNVLNNRVHIGFAMTHKFEYEVTLQQMLEQGEVVEEGLKVVHSDVWNNYTYEVEQIAPYSVM DMCPKLKKPIHQYYVDKGNQKMADTLHENVKVIYAKPLHGDSLSYAASVLKPLCSFETMKPFEAKKIMDVLKLK PDERMRKQLEQAKKLLSVFSYLQFEKRPFLLQANQYELMTLSEPAVFTNKRFNKPIYGLKNGPLFKGGTVTLSIFF DEAIESSLGLSKKLVFQFVKVLQKIAEQNGVIMKISHETKHIKGKLNESFFQHFSWEIRELENVFTDTTVLALMTEE HLTKLPNKLYNEFKRQFGGKWDISSQIITEKVLKTFQYALTRHQLTDFNVNDEKECERVADIVKNDSLSYPVFNIL LGIYVKSGMQPWVLAERAHSDCFIGLDVSHEDGKSAAGIMNVIGSNGHLIKQSALNGVLAGEKIDEPTLNEIITEV LYSYQKQFGHFPKHVTIHRDGKWRESSELVGRLFKDRNVAYDIVEVIKKPNRRMAFYNNETGKFETKQGVCYV RNQEAFLCSTNPRETIGMAQPVKIVQLTNTLPFKQIIQDCYDLSFMHIHAVNKMRLPATIHYADLSSTAYQRGQVA PRTTNGTHLPFV;
MhAgo(Marinitoga hydrogenitolerans):MYLNLYEIKIPYRVKRLYYFNKENDPKEFARNLSRVNNIRFNDSKD LVWLEIPDIDFKITPQQAEKYKIEKNEIIGEKEDSDLFVKTIYRYIKKKFIDNNFYYKRGNNYISINDKFPLDSNTNV NAHLTYKIKLYKINERYYISVLPKFTFLSDKPALESPIKSTYLFNIKSGKTFPYISGLNGVLKIDLGENGIKEVLFPEN YYFNFTSKEAEKFGFSKEIHNIYKEKIFSGYKKIKQSLYFLEDIININNYNLTMDKKIYVNIEYEFKKGISRNIKDVF KYSFYKNDQKIKIAFFFSSKKQIYEIQRSLKMLFQNKNSIFYQTIYEMGFSKVIFLREPKTNSSAFMYNPETFEISNK DFFENLEGNIMAIIILDKFLGNIDSLIQKFPENLILQPILKEKLEKIQPYIIKSYVYKMGNFIPECQPYVIRNLKDKNK TLYIGIDLSHDNYLKKSNLAISAVNNFGDIIYLNKYKNLELNEKMNLDIVEKEYIQILNEYYERNKNYPENIIVLRD GRYLEDIEIIKNILNIENIKYSLIEVNKSVNINSCEDLKEWIIKLSDNNFIYYPKTYFNQKGVEIKIIENNTDYNNEKIL EQVYSLTRVVHPTPYVNYRLPYPLQVVNKVALTELEWKLYIPYMK。
1.2 方法
1.2.1 新型pAgos的筛选
分别使用PfAgo(NCBI 序列号:WP_011011654.1)、MpAgo(NCBI 序列号:WP_014295921.1)或KmAgo(NCBI序列号:WP_010289662.1)的氨基酸序列在NCBI中进行序列比对。
1.2.2 系统发育树构建
使用MEGA7.0软件比对和分析了4个候选蛋白以及已报道的活性pAgos的氨基酸序列,并以此构建了系统发育树,其中序列比对采取MUSCLE算法,进化树构建则选择Neighbor-Joining方法。
1.2.3 pAgos表达载体的构建
以大肠杆菌为表达系统,对候选pAgos的基因进行密码子优化。蛋白纯化采取亲和层析,因此在目的蛋白的N 端添加6 个组氨酸,委托金斯瑞公司合成设计好的基因。表达载体选择pET28a,基因插入位点为NcoI 和EcoRI。4 个pAgos 表达质粒分别命名为pET28a-TtrAgo、pET28a-TeAgo、pET28a-MhAgo、pET28a-DeAgo。
1.2.4 质粒的转化
从-80 ℃冰箱中取出4 支大肠杆菌BL21(DE3)感受态细胞,将其放置于冰上5 min;分别加入100 ng 的pAgos质粒,用枪头轻轻搅动后放置于冰上30 min;将细胞转移到42 ℃水浴锅中进行90 s热击;将细胞转移到冰上,静置3 min后加入900 µL新鲜的LB培养基,转移至37 ℃、220 r/min 摇床复苏1 h;取100 µL复苏后的细胞,涂布在含有50 ng/µL卡那霉素的LB固体平板上,在37 ℃下倒置培养12~16 h。转化后的菌株分别命名为BL21(DE3)/pET28a-TtrAgo、BL21(DE3)/pET28a-TeAgo、BL21(DE3)/pET28a-MhAgo、BL21(DE3)/pET28a-DeAgo。
1.2.5 pAgos的表达
使用牙签挑取上一步质粒转化所得的单菌落,放入5 mL LB液体培养基中,37 ℃、220 r/min培养12 h;取2 mL 种子液,接种于200 mL TB 液体培养基中,37 ℃、220 r/min 培养至OD600为2.0 ~ 3.0;加入终浓度为0.1 mmol/L 的IPTG 溶液,25 ℃、220 r/min 培养12 h;将菌液转移至50 mL 离心管中,5000 r/min 条件下离心10 min,倒掉上清液,收集的菌体可用于后续纯化或保存于-80 ℃冰箱。
1.2.6 SDS-PAGE验证pAgos的表达
取1 mL发酵菌液,12 000 r/min条件下离心1 min,倒掉上清液;加入1 mL去离子水重悬菌体,12 000 r/min离心1 min,倒掉上清液;加入适量体积的破胞缓冲液,调整菌液的OD600约为5;取0.5 mL上一步骤的菌液放入2 mL EP管中,冰浴条件下进行超声破胞(3 s工作,7 s间隙,20次循环,工作功率为250 W);4 ℃、12 000 r/min离心10 min,取15 µL上清液与5 µL 4 × loading buffer混合,作为可溶表达样本;在沉淀中加入1 mL去离子水清洗,12 000 r/min离心10 min,倒掉上清液;加入0.5 mL 8 mol/L尿素溶液重悬菌体,取15 µL与5 µL 4×loading buffer混合,作为包涵体样本;将可溶表达和包涵体样本在沸水中煮5 min后,取10 µL样品进行电泳(120 V、90 min);将凝胶放入染色液中,在水平旋转振荡仪中染色30 min;倒掉染色液,加入脱色液振荡,至脱色完全;加入清水,振荡30 min后记录结果。
1.2.7 pAgos的纯化
取出发酵后的菌体,加入适量体积的破胞缓冲液,调整菌液的OD600约为10;用高压匀浆机进行破胞,压力设为60 ~ 70 MPa,进行3个循环的破碎;将破碎后的混合液在4 ℃、10 000g条件下离心30 min,上清液使用0.22 µm的滤膜进行超滤;往镍离子层析柱中加入3倍柱体积的破胞缓冲液;然后加入上一步得到的破胞液;再用破胞缓冲液进行清洗,直到280 nm的吸收峰稳定;加入洗脱缓冲液洗脱目标蛋白。
为提高目的蛋白浓度以及更换为蛋白保存缓冲液,使用孔径为30 kDa的超滤管对洗脱样本进行超滤,方法为4 ℃、5 000 r/min离心30 min,弃下层液体后加入适量蛋白保存缓冲液,重复上述步骤,直至咪唑浓度低于0.1 mmol/L。使用Bradford 试剂盒对浓缩后的蛋白样品进行定量,再加入加入等体积的甘油、1 mmol/L二硫糠醇(DTT)、0.1 mmol/L乙二胺四乙酸(EDTA),混匀后分装,置于-80℃保存。
1.2.8 pAgos的可编码核酸酶活性测试
反应体系如下:10 mmol/L Tris-HCl(pH7.5),0.2 mol/L NaCl,5 mmol/L MnCl2,0.5 µmol/L pAgos,0.5 µmol/L向导核酸,0.5 µmol/L靶标核酸,加入去离子水补充至总体积20 µL。首先将除了靶标核酸以外的组分混匀,在50 ℃条件下孵育10 min;加入靶标核酸后,将各个pAgos 反应液分别置于相应的温度下反应1 h,其中TtrAgo、TeAgo、MhAgo和DeAgo的温度分别为90、90、60和50 ℃;反应结束后加入等体积的2× SSCP去离子甲酰胺凝胶上样缓冲液,95 ℃变性5 min;取10 µL样本进行尿素-PAGE,在1 × TBE缓冲液、150 V条件下电泳1 h;将凝胶转移至蓝光切胶仪观察结果。
2 结果与讨论
2.1 pAgos的筛选与序列分析
NCBI的比对结果显示TtrAgo(NCBI序列号:WP_055429304.1)和TeAgo(NCBI序列号:WP_050002102.1)与PfAgo 的同源性分别为54.46%和33.02%,MhAgo(NCBI 序列号:WP_072865986.1)与MpAgo 的同源性为65.41%,DeAgo(NCBI 序列号:WP_052698403.1)与KmAgo 的同源性为49.8%。由于经文献报道的活性Agos在催化四联体(DEDX,X可以为D、H或N)位置高度保守,因此本研究分析了4个候选蛋白和已报道的活性pAgos的氨基酸序列,并以此构建了系统发育树。结果显示四个候选pAgos均具有催化四联体(图1A),分别为TtrAgo(D538、E576、D608、H725)、TeAgo(D529、E570、D602、H728)、MhAgo(D445、E481、D515、N623)及DeAgo(D529、E564、D598、D715)。在系统发育树中,各个候选蛋白与对应的参考蛋白均处于相邻分支(图1B),表明其亲缘关系较近。

图1 候选pAgos的序列分析Figure 1 The sequence analysis of pAgos (A: Results of sequence alignments; B: The phylogenetic tree)
2.2 pAgos在大肠杆菌系统中的可溶表达
为了分析pAgos 的表达对宿主细胞生长速率的影响,本研究记录了各个菌株的生长曲线(图2)。与对照组(含有pET28a空质粒)相比,TtrAgo、TeAgo和MhAgo的表达对细胞的生长无明显影响,而含有DeAgo 质粒的菌株最终的OD600仅为6 ~ 7 左右,我们推测这可能是由于表达的DeAgo 在大肠杆菌胞内环境下也具有核酸酶活性,因此对细胞产生了一定毒性所导致的。而TtrAgo、TeAgo 和MhAgo 的工作温度较高,在胞内的核酸酶活性不明显,因此对细胞的生长影响不大。

图2 生长曲线Figure 2 The growth curves
对表达了pAgos蛋白的菌液进行SDS-PAGE验证,结果显示TtrAgo(88.6 kDa)、TeAgo(89.3 kDa)、MhAgo(77.9 kDa)以及DeAgo(86 kDa)在对应的理论分子量位置均有明显的可溶表达(图3)。其中TtrAgo和DeAgo的可溶部分含量与包涵体部分相当,而TeAgo和MhAgo则主要以包涵体形式存在,这可能与pAgos的密码子、氨基酸序列以及蛋白的结构与功能有关。
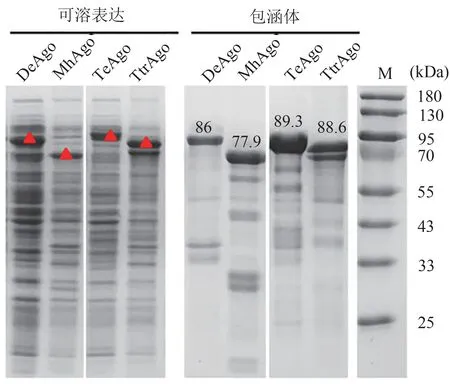
图3 候选pAgos的表达结果Figure 3 The expression of pAgos
2.3 pAgos的纯化
对亲和层析后的洗脱样本进行SDS-PAGE分析,以确定是否含有目标蛋白以及目标蛋白纯度。结果显示所有候选蛋白均成功纯化(图4)。其中TeAgo的回收率低于其余3个pAgos,主要原因是其组氨酸标签与镍柱的结合强度较低,这可能是由于TeAgo的折叠导致组氨酸标签未暴露在蛋白表面导致的。总的来说,利用大肠杆菌表达系统及亲和层析可有效获得高纯度的pAgos蛋白。

图4 候选pAgos的纯化结果Figure 4 Purification of pAgos
2.4 候选pAgos的可编码核酸酶活性
本研究测试了4 个pAgos 在4 种向导核酸,即5’末端磷酸基团或羟基修饰的ssDNA 或RNA 介导下,对DNA或RNA靶标的切割效率。
当以DNA为靶标核酸时,4个pAgos均具有可编码核酸酶活性(图5)。其中TeAgo和TtrAgo可在DNA介导下高效切割DNA底物,且5’末端羟基或磷酸基团修饰的向导DNA对应的切割产物大小不一致,表明切割位点不同;MhAgo可在4种向导核酸作用下切割DNA,但效率均不高;DeAgo也能以DNA为向导核酸,但催化效率较低。除此之外,MhAgo与DeAgo的切割产物有多个条带,表明此时存在多个切割位点。
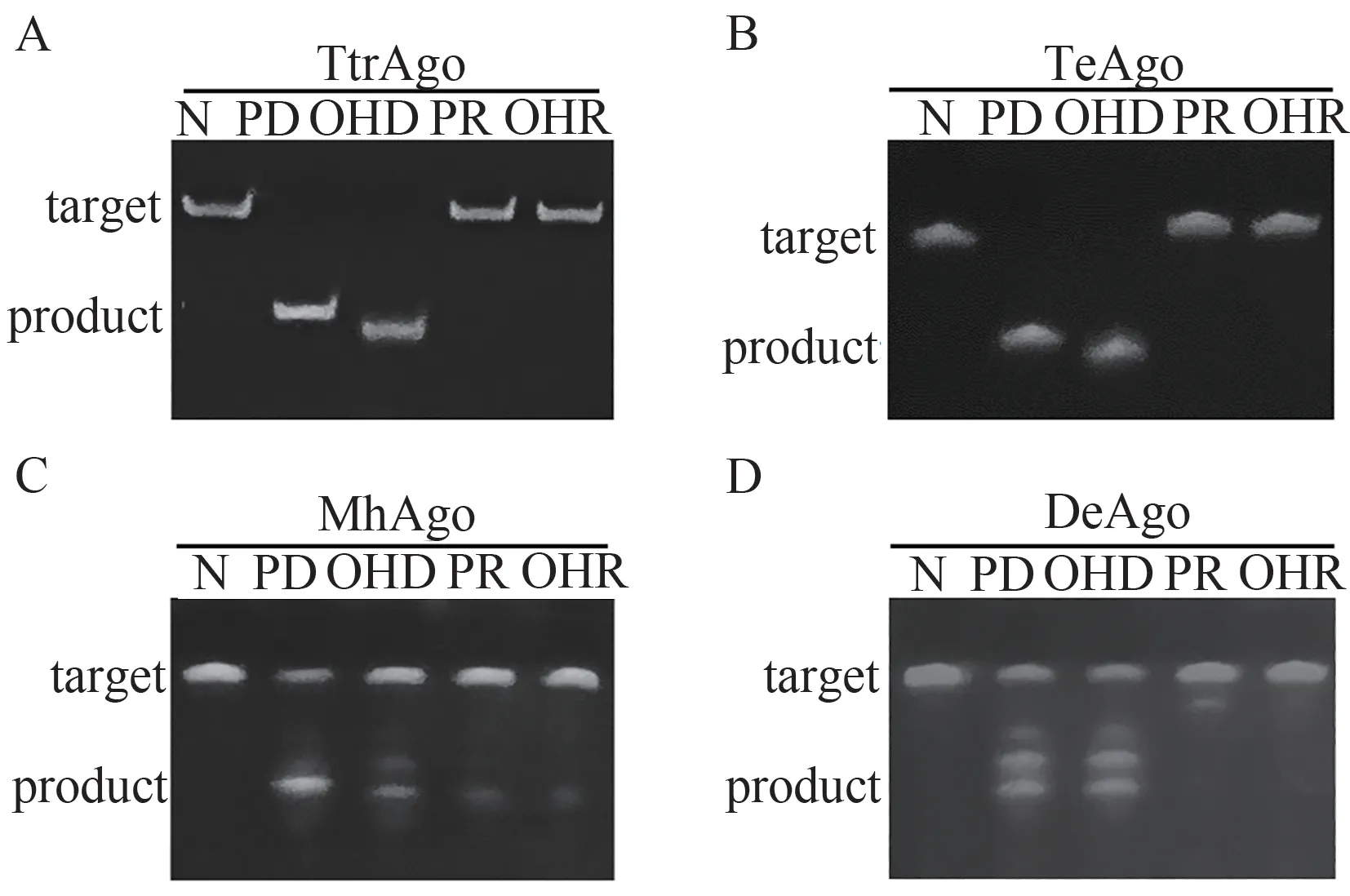
图5 4个pAgos的可编码DNA内切酶活性测试结果(AD分别为TtrAgos、TeAgo、MhAgo和DeAgo对DNA的切割结果;N表示未加入向导核酸的阴性对照,PD表示磷酸修饰的DNA,OHD为羟基修饰的DNA,PR为磷酸修饰的RNA,OHR为羟基修饰的RNA,靶标为FAM-tDNA)Figure 5 The programmable DNA endonuclease of four pAgos (A-D: The results of TtrAgos, TeAgo, MhAgo and DeAgo, respectively; N represented negative control, PD represented P-gDNA, OHD represented OH-gDNA, PR represented P-gRNA, OHR represented OH-gRNA, FAM-tDNA was used as target)
当以RNA为靶标核酸时,4个pAgos也展现出可编码的RNA切割活性(图6)。其中TeAgo和TtrAgo的活性最佳,在DNA向导的作用下可将RNA底物切割完全,不过此时的切割位点也受向导5末端的修饰基团影响;MhAgo 的结果与DNA靶标的类似,虽然在向导核酸的类型上具有全能性,但催化效率均不佳;DeAgo 则仅能使用羟基修饰的DNA作为向导,但活性较弱。
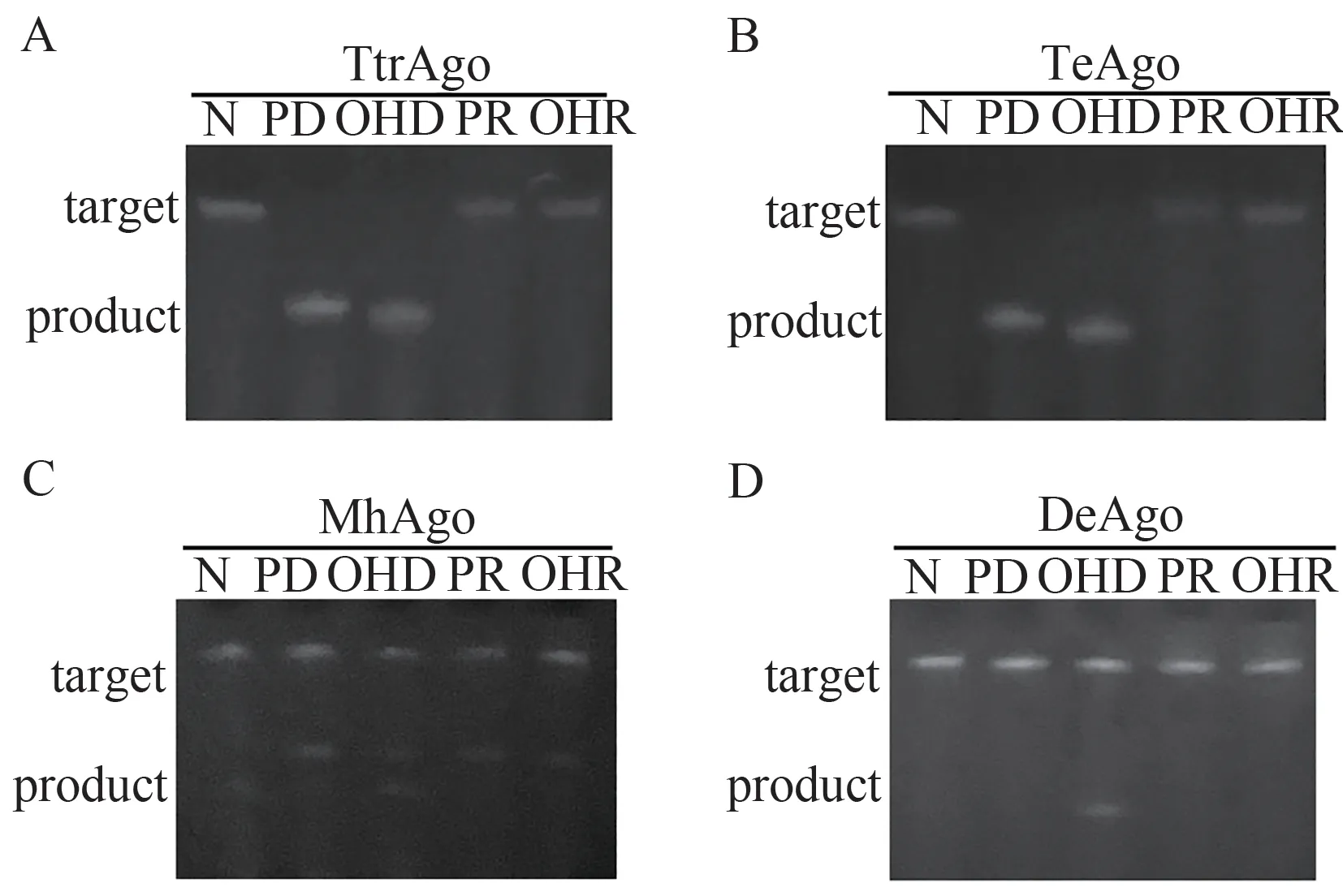
图6 4个pAgos的可编码DNA内切酶活性测试结果(AD:分别为TtrAgos、TeAgo、MhAgo和DeAgo对DNA的切割结果;N表示未加入向导核酸的阴性对照,PD表示磷酸修饰的DNA,OHD为羟基修饰的DNA,PR为磷酸修饰的RNA,OHR为羟基修饰的RNA,靶标为FAM-tDNA)Figure 6 The programmable RNA endonuclease of four pAgos (A-D: The results of TtrAgos, TeAgo, MhAgo and DeAgo, respectively; N represented negative control, PD represented P-gDNA, OHD represented OH-gDNA, PR represented P-gRNA, OHR represented OH-gRNA, FAM-tRNA was used as target)
3 结语
本研究首先通过序列比对,获得了与靶序列具有高同源性的候选pAgos氨基酸序列;其次利用大肠杆菌系统实现了候选pAgos的可溶表达,并采取亲和层析对目的蛋白进行纯化;最后建立了可编码核酸切割活性的测定方法,并以此测试了TtrAgo、TeAgo、MhAgo以及DeAgo的核酸酶活性。本研究不仅深化了对Ago的理解,且对于后继Ago核酸酶的研究工作也具有借鉴和参考价值。
