妊娠合并血小板减少的病因及母婴结局分析
2024-01-10陈志敏
李 冕,陈志敏
(郑州大学第一附属医院妇产科,郑州 450000)
妊娠期血小板减少(pregnancy with thrombocytopenia,PT)是妊娠期常见的并发症及合并症,其发生率约为5%~10%[1],是发病率仅次于贫血的妊娠期血液系统疾病,国内通常将两次及以上的血小板计数<100×109/L诊断为血小板减少[2]。妊娠期血小板减少的病因复杂,可由多种内、外科合并症及妊娠期并发症引起,排名前三的病因包括妊娠期特发性血小板减少(pregnancy-associated thrombocytopenia,PAT)、妊娠期高血压疾病相关性血小板减少(hypertensive disorder complicating pregnancy,HDCP)、特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)[3]。此外,还有一些少见的病因,包括血液系统疾病性、药物性、感染性、遗传性、营养不良性(维生素B12、叶酸缺乏等)以及不明原因的血小板减少等[4]。不同病因引起的血小板减少程度及母婴预后差异较大,严重时导致胎死宫内、产后大出血及新生儿颅内出血等。因此,及时、准确识别病因,加强孕产期管理,可极大程度改善母婴结局[5]。目前关于妊娠期血小板减少的诊治不断进展,但仍无明确的诊疗指南。本研究通过分析妊娠合并血小板减少孕产妇的临床特点、诊疗方案及母婴结局,为临床诊疗提供参考依据。
1 资料与方法
1.1 研究对象 回顾分析2019年6月至2023年6月于郑州大学第一附属医院产科分娩的255例妊娠合并血小板减少孕妇的临床资料。孕妇平均年龄(29.48±4.83)岁,终止妊娠孕周(6.14~41.29)周,平均(36.38±5.29)周,平均孕次(2.19±1.32)次,产次(0.64±0.76)次。PAT组119例,HDCP组49例,ITP组66例,其他组21例。纳入标准:孕期两次及以上血小板计数<100×109/L;临床资料完整,孕期规律产检。排除标准:双胎或多胎妊娠;假性血小板减少;孕期未规律产检或在外院接受过治疗;先天性凝血功能障碍;妊娠前严重肝肾功能异常;精神疾病或意识模糊。
1.2 分组
1.2.1 按病因分组 PAT诊断标准参考ACOG指南[6];妊娠期高血压疾病诊断标准参照《妇产科学》(第9版)[7];妊娠前及妊娠期ITP诊断标准按国内《成人原发免疫性血小板减少症诊断与治疗中国指南(2020版)》制定的诊断标准[8];其他组:除以上原因以外的血小板减少(包括系统性红斑狼疮、未分化结缔组织病、抗磷脂抗体综合征、急性髓系白血病、再生障碍性贫血等)。
1.2.2 按病情严重程度分组[8]以妊娠期最低血小板数值分组:轻度组最低血小板数值≥50×109/L,中度组为30×109/L≤血小板数值<50×109/L,重度组则血小板最低数值<30×109/L。
1.3 观察指标 患者一般情况:年龄、孕周、孕产次、身高、体重;临床特征:病因、首次诊断血小板减少孕周、终止妊娠孕周、血小板计数波动范围、出血事件、治疗方式;母婴结局:早产率、剖宫产率、产时出血情况、新生儿Apgar评分、新生儿血小板减少率等。新生儿早产、窒息等诊断标准参照《妇产科学》(第9版);Apgar评分:分数越高代表新生儿出生状况越好,出生1min后Apgar评分4~7分判断为轻度窒息,0~3分为重度窒息[9-10]。出血事件包括皮肤瘀点、瘀斑、牙龈出血、鼻出血等。
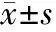
2 结 果
2.1 一般资料 PAT组119例,HDCP组49例(其中子痫前期7例、重度子痫前期16例、慢性高血压并发子痫前期6例、HELLP综合征20例),ITP组66例,其他组21例(其中系统性红斑狼疮10例、未分化结缔组织病4例、抗磷脂抗体综合征2例、急性髓系白血病1例、再生障碍性贫血4例)。按病情程度分为轻度组154例,中度组42例,重度组59例。无论哪种分组方式,各组孕妇的孕产次、体质量指数(body mass index,BMI)等比较,差异均无统计学意义(P>0.05);ITP组的孕妇年龄小于PAT组和HDCP组,重度组的孕妇年龄小于轻度组,差异有统计学意义(P<0.05)(表1)。
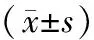
表1 各组一般资料对比
2.2 各组临床特点
2.2.1 不同病因分组中血小板减少严重程度 PAT组与HDCP组中轻度分别占82.35%和79.59%,ITP组重度占59.09%,各组差异有统计学意义(P<0.05)。73例患者出现出血症状,包括皮肤瘀点、瘀斑、牙龈出血、鼻出血等,孕晚期发现血小板减少在PAT组、HDCP组及ITP组中分别占68.07%、73.47%及6.07%,各组差异有统计学意义(P<0.05),即ITP组的发现孕周早于PAT组和HDCP组,出血事件例数最多(63.6%),差异有统计学意义(P<0.05)(表2)。

表2 各组临床特点[n(%)]
2.2.2 不同病因孕产期血小板减少的临床处理 PAT组119例中,口服升血药物或观察103例,输血小板11例。4例重度血小板减少,1例孕18周时血小板值为27×109/L,输注1个治疗量血小板后给予羊膜腔穿刺注射依沙吖啶药物引产,产后血小板逐步上升至正常,其余3例均给予术前1h或术中输注血小板对症处理。
HDCP组49例中,观察或口服升血药物以纠正血小板减少38例,使用激素2例,输血小板9例。本组均在解痉、降压的基础上根据病情对症处理,31例入院后24~48h紧急终止妊娠,18例期待治疗后终止;胎盘早剥4例,4例因病情进展行羊膜腔穿刺注射依沙吖啶药物引产。
ITP组66例中,应用升血药物有26例。孕期用激素或丙球或两者联合治疗28例,其中21例均为孕前确诊,11例因疗效不佳孕期反复输注血小板,血小板波动于(3~50)×109/L;接受血小板输注者共57例,其中24例为妊娠期输注,33例为分娩当天或之后输注;不同时期的输血小板率均大于其他各组,差异有统计学意义(P<0.01)。
其他组21例中多为自身免疫性及血液系统疾病(均由风湿免疫科及血液内科确诊),16例自身免疫性疾病患者主要针对原发病治疗,用激素冲击治疗、丙种球蛋白封闭抗体、免疫抑制剂治疗或输注血小板等;5例血液系统疾病患者主要采用对症支持、免疫抑制及输注血小板。13例输注血小板。各组临床治疗原则不同,但均有不同程度输注血小板(表2)。
2.3 实验室指标 无论何种分组,各组间血凝块形成时间(K)无统计学意义。病因分组中,PAT组的凝血反应时间(R)最低,凝固角(α)、最大振幅(MA)最高;病情程度分组中,轻度组的入院血红蛋白值最高,凝固角(α)、最大振幅(MA)最高。ITP组和重度组的凝固角(α)、最大振幅(MA)和入院血红蛋白值在各分组中最低,差异有统计学意义(P<0.05)(表3)。
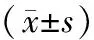
表3 实验室检查
2.4 母婴结局 255例患者中,193例剖宫产(其中77例因血小板减少导致剖宫产),50例阴道试产。ITP组因血小板减少而导致的剖宫产率、产时术中出血量、新生儿血小板减少率均高于其他各组(P<0.05)。PAT组的产时术中出血量及新生儿血小板减少率均低于其他各组,差异有统计学意义(P<0.05)。除去流产、羊膜腔穿刺引产、胎死宫内的18例,余下237例患者中,HDCP组的新生儿早产率最高(67.35%),1、5min Apgar评分最低,PAT组的新生儿早产率最低(5.88%),1、5min Apgar评分最高(P<0.05)(表4)。
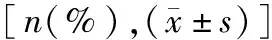
表4 母婴结局
3 讨 论
健康女性中,妊娠会使血小板计数下降(25~50)×109/L[11],妊娠期血小板数量减少主要是由体内血小板生成障碍、分布异常、消耗和破坏增加、血液稀释等导致。由于其病因较多,机制复杂,常需多学科诊断与治疗[12]。PAT、HDCP、ITP是妊娠合并血小板减少的前三位病因。不同病因孕产期血小板减少的临床特征、诊断及治疗各有其特点。
3.1 PAT组 妊娠期出现血小板减少的患者中,70%~80%为PAT[6,13]。PAT病因不明,可能与孕期血液稀释、胎盘循环中血小板破坏过多、血小板清除增加、激素对巨核细胞生成的抑制有关[12,14]。其诊断的要点在于孕前无血小板减少病史,常发生于妊娠中晚期,不伴有明显出血症状,一般无需特殊处理,通常不会增加孕妇产后出血或胎儿血小板减少的风险,产后1~2个月可恢复正常。因此,大多数病例无需特殊处理,只需定期检测、动态观察血小板计数波动或给予对症口服升血小板药物治疗。
本研究中,PAT发病率最高,初次发现孕周常在妊娠晚期(81例,68.07%),轻度血小板减少占比较高(82.4%),PAT组的血栓弹力图中K值小于ITP组,α角、MA值大于其他三组,提示纤维蛋白原功能及血小板功能均较好,呈现出妊娠晚期高凝状态,提示出血事件发生的风险低,这与本组中的较低出血事件发生率相吻合(14.29%)。7例未足月终止妊娠,其中1例因血小板重度减少,在患者与家属强烈要求下于孕22周羊膜腔穿刺注射依沙吖啶引产,引产后血小板逐步恢复正常;1例自然早产,其余5例均因其他原因剖宫产终止,早产儿Apgar评分5min均达10分,结局良好。4例重度血小板减少的孕产妇孕期给予口服升血小板药物及输注血小板等对症处理,出院前血小板均较前稳步提升(均>100×109/L),随访至产后1月,血小板均升至正常范围,提示PAT组母婴结局良好。但有报道提示,下一次妊娠时PAT复发率可能超过50%[15]。因此,对于有PAT病史患者的再次妊娠产前咨询中,应警惕血小板减少的风险,定期检测血小板计数。
3.2 HDCP组 血小板减少通常在妊娠20周以后出现,伴随血压升高、尿蛋白阳性等临床表现[16]。本研究中HDCP组49例患者,其中子痫前期7例、重度子痫前期16例、慢性高血压并发子痫前期6例、HELLP综合征20例。本组中,HELLP综合征占比最高,其是以溶血、肝酶升高、血小板减少为表现的一种综合征。妊娠期高血压疾病出现血小板减少时意味着病情进展,即使血小板计数正常,血小板功能也可能受损[17],因此需及时终止妊娠。通常孕周≥32~34周,病情恶化或胎儿宫内窘迫时需紧急终止妊娠;28周≤孕周<32~34周,病情平稳可短期内期待治疗。此外,即使患者不表现明显出血征象,产妇阴道试产中血压的进一步升高可能加剧产妇脏器出血和胎儿宫内窘迫的风险,临床上通常倾向剖宫产终止妊娠,这与本研究中的结局一致。本研究HDCP组中,轻度血小板减少39例,占79.59%,有33例未足月终止妊娠,7例因病情原因放弃胎儿或胎死宫内,剖宫产率、早产率均高于PAT组。这提示产科因素是决定终止时机和方式的最关键因素,应根据妊娠期高血压疾病诊治原则进行评估。
3.3 ITP组 ITP亦称原发性免疫性血小板减少症,是一种获得性自身免疫性出血疾病。ITP属于排除性诊断,在骨髓穿刺结果未明确之前与PAT的鉴别关键在于是孕前或孕早期出现血小板减少且进行性下降趋势明显、血小板减少程度重、产后大多不能恢复正常、对激素和丙种球蛋白治疗有效。根据2019年美国妇产科医师学会(American College of Obstetricians and Gynecologists,ACOG)公布的《妊娠期血小板减少实践公报》,ITP是妊娠早期血小板计数低于50×109/L最常见的原因[6]。Wang等[18]研究显示,妊娠12周之前出现的血小板减少91.7%为ITP。本研究中,孕前及孕早期发现的ITP有53例,占80.3%,中重度血小板减少有56例,占84.8%。ITP组中,42例患者出现出血事件,表现为瘀点、瘀斑、牙龈出血或鼻出血,占63.6%。因此,在既往无血小板减少症病史或本次为轻度血小板减少的患者中,相比较于PAT,早期发病和诊断时的较低血小板计数可作为ITP的独立预测指标[18]。
与PAT组及HDCP组相比,ITP组的治疗更早期、更全面,一线药物为糖皮质激素与丙种球蛋白,同时辅以重组人血小板生成素等升血小板药物。本研究中ITP组输注血小板率高达86.4%,这与较低的血小板计数有关,即当出现重度血小板减少或合并出血症状或围术期,临床上给予输注血小板治疗。陈虹霏等[19]研究表明,血小板<30×109/L且伴有活动性出血或准备分娩,须输注血小板至计数相对安全水平,对于无出血及紧急分娩表现且血小板计数≥30×109/L的ITP孕妇,无需特殊处置,可观察随访。也有研究提示,MA≤45mm时出血风险更大,低于该阈值可作为输注血小板的一项证据[20]。但ITP患者体内血小板只能存活48~230min(正常人血小板可存活8~12d),输入的血小板会迅速被体内的抗体破坏,故可在术前1h内一次性输注[14]。研究发现,妊娠合并ITP的孕妇所分娩新生儿中约25%发生新生儿血小板减少,其中严重血小板减少(血小板计数<50×109/L)发生率约为8.9%~14.7%,但新生儿颅内出血发生率很低(<1%)[21]。本组资料中早产21例,流产和胎死宫内5例,新生儿窒息5例,新生儿血小板减少15例,追踪血小板减少的新生儿资料,5例确诊新生儿自身免疫性血小板减少,给予抗感染、营养心肌、输血小板、丙种球蛋白应用等,除2例因家庭原因要求自行出院之外,余均好转出院。提示ITP组患者在严密检测及规范化治疗的情况下,根据血小板计数水平、有无出血症状、孕周以及治疗效果等综合因素,多学科联合评估,多数患者母儿结局良好。
3.4 其他组 妊娠合并血液系统疾病患者(急性髓系白血病1例、再生障碍性贫血4例)主要是对症支持和免疫抑制治疗;自身免疫系统疾病患者(系统性红斑狼疮10例、未分化结缔组织病4例、抗磷脂抗体综合征2例)均为孕前或孕期确诊,治疗主要针对原发疾病,给予激素和免疫抑制治疗后终止妊娠。本研究中10例早产,2例新生儿窒息,3例引产或流产。与PAT组相比,其他组的剖宫产率、输血率和早产率均较高,差异有统计学意义。提示妊娠合并血液系统或免疫系统疾病影响母婴结局,临床上发现血小板减少时要注意排查血液及免疫系统疾病,重视相关指标筛查。
不同病因引起的妊娠期血小板减少的临床特点、治疗方案和母婴结局各有差异。对于症状轻、发现时期晚、母婴结局较好的PAT患者,常无需干预;发现早、出血事件较多、剖宫产率较高、血小板减少程度严重的ITP患者应根据病情程度采取系统治疗(激素或丙球或联合治疗);HDCP患者因孕期难以控制的高血压,导致的胎儿宫内生长受限或宫内窘迫,早产率和剖宫产率往往较高,但终止妊娠的时间和方式常取决于产科因素。研究表明,分娩时血小板计数低于80×109/L,产后出血风险增加2.5~3倍[22]。另有研究显示,母体妊娠期血小板计数<30×109/L,新生儿血小板减少甚至颅内出血风险随之增加。因此,维持剖宫产患者血小板计数>80×109/L,自然分娩患者血小板计数>50×109/L较为安全[23]。
综上所述,妊娠合并血小板减少的主要治疗原则是做好产前咨询与围产期保健,维持血小板计数在安全范围,根据具体病因及病情严重程度采用个体化治疗,以尽可能降低妊娠期出血风险,保障母婴安全,避免过度治疗[24]。不同病因引起的血小板减少程度、变化规律及母儿预后差异均较大。但在临床上,其发病机制尚未明确,诊断与鉴别诊断复杂。本研究搜集了近年来的新发病例,通过回顾分析相关临床资料,为PT大样本研究提供了新数据,旨在提高临床医师和孕产妇对该疾病的认识,加强孕产期的管理,明确不同的病因并采取系统的管理和个性化治疗,从而改善母婴结局。
