子宫内膜癌肝转移患者生存预测模型的建立与验证*
2024-01-10郑云峰谌清渝汪晋羽田晨帆
郑云峰,谌清渝,蒋 鹏,汪晋羽,田晨帆,袁 瑞
(1.重庆医科大学附属第一医院妇产科,重庆 400016;2.渝北区妇幼保健院妇科,重庆 401120)
子宫内膜癌是最常见的妇科恶性肿瘤,每年约有65620例新发病例和12590例死亡病例,严重威胁着女性健康[1-2]。大多数子宫内膜癌患者诊断时分期较早,约70%的患者在诊断时处于I期,5年总生存率超过80%,仅少数发生远处转移,但器官远处转移仍是导致患者死亡的主要原因。子宫内膜癌肝转移(endometrial cancer liver metastases,ECLM)的发生率仅次于骨转移和肺转移,患者预后较差,中位生存时间仅为1~10个月[3]。因此,准确预测ECLM生存时间,为患者定制合理的治疗策略尤为重要。目前,对于子宫内膜癌预后的判断主要基于传统临床病理参数和预后标志物。由于发病率低、病例采集难等原因,有关ECLM患者预后研究相对较少,预后分析仍不确切。本研究通过分析ECLM预后相关临床病理因素,并构建列线图模型准确预测ECLM患者总生存期(overall survival,OS),帮助临床医生确定和调整治疗方案。
1 资料与方法
1.1 一般资料 从SEER数据库(https://seer.cancer.gov/)中获取2010年1月1日至2018年12月31日诊断为ECLM的患者1266例,提取患者的基本临床病理资料和治疗方法等信息。纳入标准:(1)术后病理证实为子宫内膜癌;(2)肝转移;(3)随访资料完整。排除标准:(1)年龄小于18岁;(2)多原发肿瘤;(3)患者种族,肿瘤分级信息缺失;(4)手术和淋巴结清扫资料缺失;(5)随访数据缺失。根据上述纳入和排除标准,共614例ECLM患者纳入本研究。本研究获得SEER数据库的访问权限与使用许可,SEER数据库中的数据是匿名且公共获取的,故本研究无需获得机构伦理委员会的批准。
1.2 研究变量 提取以下变量作为潜在预后因素:年龄、种族、肿瘤大小、肿瘤分级、手术、淋巴结清扫、放疗和化疗。将连续变量转化为分类变量进行预后分析和预测模型的构建。其中,年龄和肿瘤大小采用X-tile软件确定最佳截断值,并依据截断值进行分组。SEER数据库中,肿瘤大小以肿瘤最大直径表示,具体测量方法包括临床测量(术后测量肿瘤直径)、病理学测量(病理学家对切除的组织标本进行测量和分析)以及影像学测量(包括CT扫描、MRI、B超等)。依据国际疾病分类肿瘤学专辑第三版(International Classification of Disease for Oncology third edition,ICD-0-3),将子宫内膜癌病理亚型分为子宫内膜样腺癌(endometrial endometrioid adenocarcinoma,EEA)、浆液性子宫内膜癌(serous endometrioid adenocarcinoma,SEA)和其他组织学亚型,其他组织学类型包括透明细胞癌、癌肉瘤和其他罕见亚型,如黏液性癌、未分化癌等[4-6]。将肿瘤分级定义为Ⅰ级(高分化)、Ⅱ级(中分化)、Ⅲ/Ⅳ级(低分化或未分化)。将总生存期作为结局事件指标,定义为从诊断到任意原因死亡/随访结束的时间。
1.3 统计学分析 采用IBM SPSS(版本25.0)和R语言(版本4.2.1)软件分析。计数资料以频数和百分率表示,组间比较采用χ2检验或Fisher精确概率法。对ECLM患者预后影响因素进行单因素Cox回归分析,将P<0.05的变量进一步纳入多因素Cox回归模型,基于多因素Cox回归分析结果,构建列线图并对预测模型进行内部验证。采用Bootstrap自抽样法进行1000次重复分析;采用C指数、ROC曲线及AUC值衡量预测模型的区分度及诊断效能;基于Hosmer-Lemeshow检验,绘制校准曲线评估列线图的校准能力和一致性;通过DCA决策曲线评价不同风险阈值概率下的净获益来确定列线图模型在临床应用中的价值。采用Kaplan-Meier法绘制生存曲线,组间差异采用log-rank检验进行比较分析[5]。P<0.05为差异有统计学意义。
2 结 果
2.1 流行病学与临床病理特征 将614例ECLM患者按7∶3比例分为训练队列(432例)和内部验证队列(182例)。年龄低于64岁的患者占比最高(46.4%);ECLM患者的病理类型主要以EEA为主(51.8%);肿瘤分级为Ⅲ/Ⅳ级者占84%。大部分患者接受了手术治疗(55.5%)和化疗(61.1%),仅有少数患者接受淋巴结切除(23.6%)和放疗(16.3%)。ECLM患者中,同时伴有骨转移、脑转移和肺转移的比例分别为18.6%、3.6%和39.1%。训练队列和验证队列的临床病理参数比较,差异均无统计学意义(P>0.05)。见表1。

表1 纳入ECLM患者的流行病学与临床病理特征
2.2 单因素与多因素Cox回归分析 在训练队列中进行单因素分析,结果显示婚姻状态、组织学类型、肿瘤大小、外科手术、淋巴结切除术、化疗、骨转移、脑转移和肺转移是影响患者OS的危险因素(P<0.05);将上述变量进一步纳入多因素Cox回归分析,结果表明组织学类型、肿瘤大小、手术、化疗、骨转移和肺转移是影响ECLM患者OS的独立预后因素。ECLM患者中包括其他组织学类型,肿瘤大小>11.7cm,以及骨转移和肺转移是ECLM的独立危险因素;而接受手术治疗和化疗是ECLM的独立保护因素,见表2。

表2 训练集中ECLM患者总生存率(OS)的单因素与多因素分析
2.3 列线图的建立与验证 根据单因素和多因素分析结果,将上述独立预后因素纳入并构建列线图(图1A)。训练队列中,模型的C指数为0.767(95%CI为0.745~0.789);验证队列中,模型的C指数为0.744(95%CI为0.705~0.783)。训练队列中,1年和3年的AUC值分别为0.851和0.795;验证队列中,1年和3年的AUC值分别为0.775和0.741,表明预测模型具有良好的预测能力和区分度(图1B、C)。校准曲线中显示模型预测ECLM生存概率与实际概率接近,表明模型具有较好的校准度(图2)。DCA曲线分析结果提示模型具有良好的临床效用和应用价值(图3)。
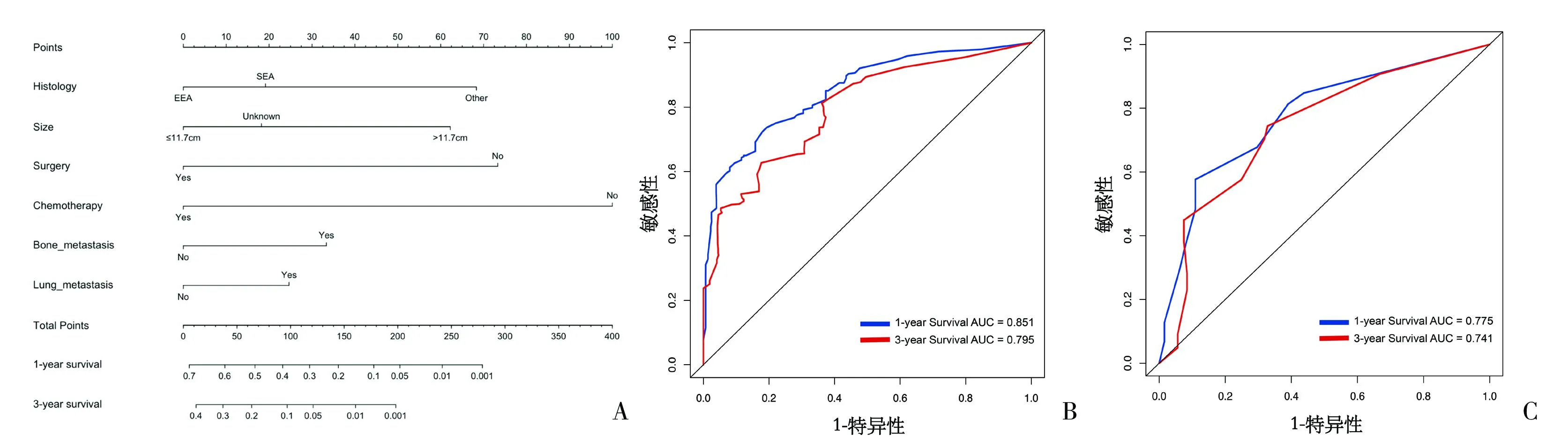
图1 预测ECLM患者OS列线图模型建立及ROC曲线
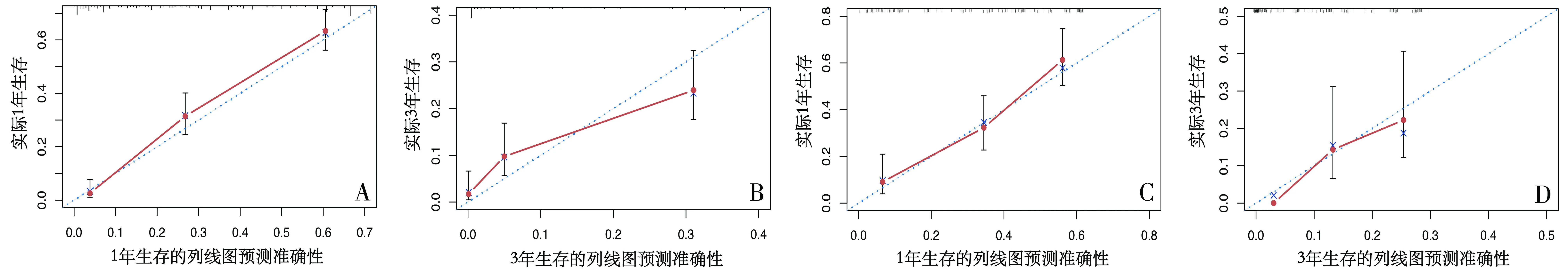
图2 校准曲线

图3 DCA曲线
2.4 生存分析 生存分析显示,ECLM患者的中位生存时间为7个月。Kaplan-Meier生存曲线结果显示,其他组织学类型、肿瘤大小>11.7cm、未接受手术治疗和化疗,以及ECLM同时伴有骨转移和肺转移者生存概率显著下降(P<0.001)(图4)。
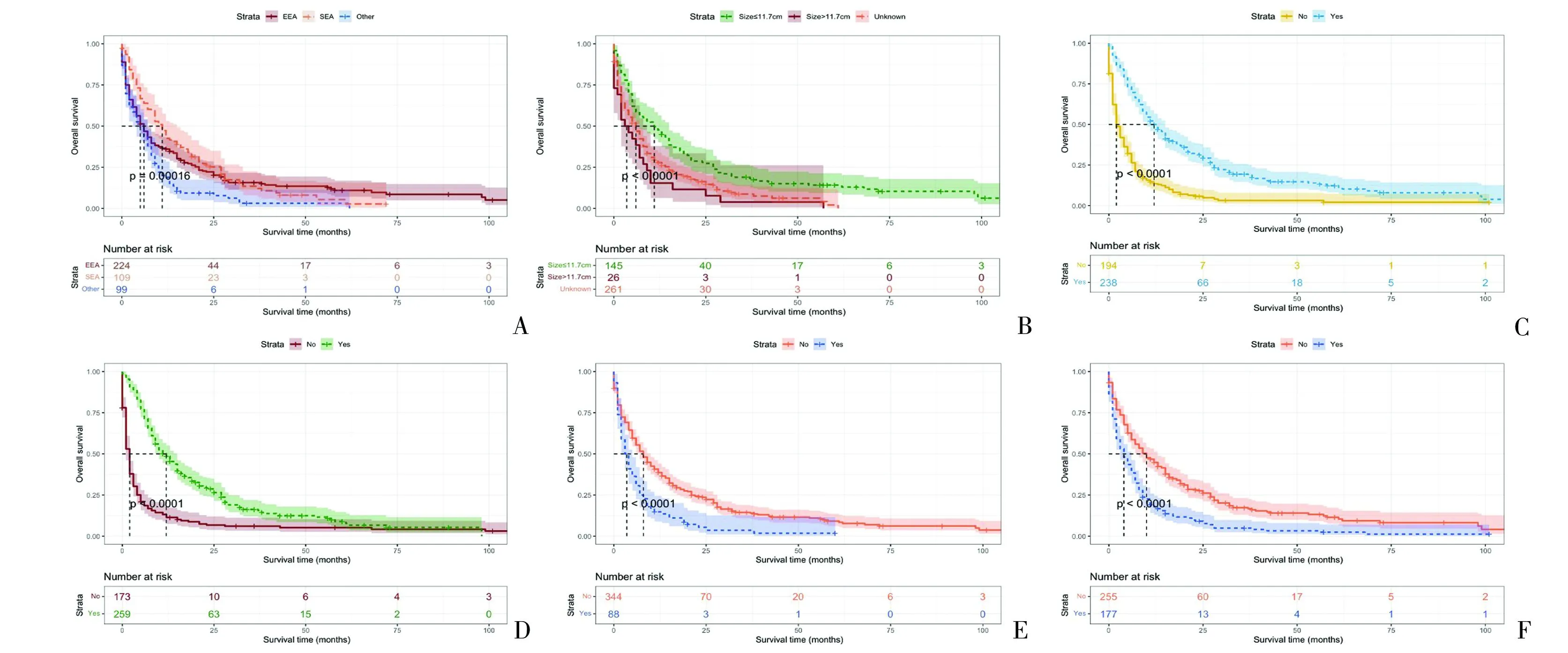
图4 K-M曲线
3 讨 论
子宫内膜癌患者大多预后良好,复发和转移是导致晚期患者死亡的主要原因之一[7]。研究表明,Ⅳ期EC最常见的转移部位是肺和淋巴结,不常见转移部位包括骨、肝和脑[8-10]。一项基于SEER数据库的流行病学调查显示,ECLM的发生率从2010年的163例(0.8%)升至2015年的202例(0.8%)[3]。与未转移患者相比,伴有肝转移的EC患者肿瘤往往更具侵袭性,临床分期晚且预后更差[3,11]。ECLM临床较罕见,相关报道较少。目前尚无综合分析ECLM预后危险因素的相关报道,亦无相关研究建立ECLM生存预测模型。本研究基于SEER公共数据库探索ECLM患者预后的独立危险因素,并构建了一种易于使用的列线图模型,用于预测ECLM患者1年和3年OS,协助临床医生评估患者预后和优化临床决策。
本研究经单因素和多因素分析,确定6个变量(包括组织学类型、肿瘤大小、手术、化疗、骨转移和肺转移)为ECLM患者OS的独立预后因素,并基于上述变量构建列线图模型。其中,对预后影响最大的因素是化疗和手术治疗,其次是肿瘤大小和组织学类型,而骨转移及肺转移对ECLM患者OS的影响相对较小。手术是治疗局限性EC的主要方法。然而,对于转移性或晚期EC是否行手术治疗仍有争议。一些学者认为,晚期EC患者的预后很大程度上取决于其生物学特性,而手术治疗在改善这类患者预后方面的作用甚微[12]。本研究显示,手术治疗是ECLM患者的独立预后因素,行手术干预的患者较非手术患者的OS明显延长。2018年NCCN指南建议根据Ⅳb期EC的特点,选择姑息性子宫切除术,包括或不包括化疗、放疗和激素治疗[12]。一项meta分析指出,对转移或复发晚期EC患者实施肿瘤减灭术可改善患者的生存预后并延长OS[13]。在临床实践中,是否对ECLM患者行手术干预,应考虑诊断时间、疾病部位、复发位置、数量及患者状态,以选择合适的治疗方案。本研究认为,化疗是影响ECLM患者预后的独立保护因素,K-M曲线显示,接受化疗者的OS明显高于未化疗者。此外,新辅助化疗(neoadjuvant chemotherapy,NACT)作为伴远处转移EC患者的治疗方法之一,已被广泛接受。Wilkison-Ryan等[14]研究表明,术前接受NACT治疗者的肿瘤切除率明显提高,改善患者预后的同时有效减少了术后并发症。本研究表明,肿瘤大小与ECLM患者预后密切相关,肿瘤直径大于11.7cm的EC患者预后较直径小于11.7cm患者更差。Hou等[6]研究发现,肿瘤大小与EC患者预后之间存在非线性关系,随着肿瘤大小增加,死亡风险明显增加。一项回顾性研究表明,肿瘤大小与病理分级和T分级呈正相关,而与患者生存预后呈负相关[15]。此外,本研究还发现,肿瘤的组织学类型显著影响ECLM患者预后,其中子宫内膜样腺癌生存表现最佳,浆液性子宫内膜癌次之,而透明细胞癌等其他组织学亚型的生存时间最短。文献报道,非子宫内膜样亚型患者的生存预后往往较差,尤其是透明细胞癌恶性程度较高,肿瘤更具侵袭性[16-17]。研究表明,透明细胞癌等其他组织学亚型对于治疗的反应性往往更差,而伴有子宫内膜样腺癌的患者对化疗和靶向治疗均表现出良好的反应性,与本研究结果相符[18-19]。多发远处转移与EC患者不良预后之间的关系已被证实[9]。本研究中,同时伴有肺转移和(或)骨转移的ECLM患者有着更高的死亡风险。脑转移因在多因素Cox回归分析中未显示出统计学意义而未被纳入到本模型中,其主要原因是合并脑转移和肝转移的发生率低(3.6%),导致脑转移不是ECLM患者预后的独立危险因素。
本研究结果显示,患者年龄、肿瘤分级和放疗并不是ECLM的独立预后因素。年龄在临床上被认为是决定治疗方式的重要依据,老年患者通常患有基础性疾病(高血压、糖尿病、神经系统疾病等),且对治疗的耐受性差,预后往往不佳。据相关文献报道,40~59岁女性发生EC的概率为0.77%,而70岁以上女性患病率明显提高(约1.24%)[20]。此外,在病理分级上,年轻EC患者以高分化为主,分期较早,往往预示着患者的生存率和生活质量较好。而老年女性在晚期被确诊且组织学类型较差,预后往往不佳。临床实践中,老年患者更易出现脉管癌栓阳性、肿瘤深肌层浸润等危险因素,故应充分考虑年龄因素,优化疾病管理策略,以改善患者预后,提高生活质量。本研究中,发生肝转移的患者年龄普遍较大,且生存期较短,可能是导致年龄未被纳为独立预后因素的重要原因之一。盆腔外放射治疗作为子宫内膜癌患者的标准治疗方式之一,能有效改善局部复发患者的预后[21],尤其对于早期低分化子宫内膜样腺癌患者,术后选择性放疗能有效降低肿瘤复发率和死亡率[22]。但由于晚期子宫内膜癌易发生远处转移,如经淋巴道转移至盆腔以外的淋巴结,经血道转移至肺、肝等,而这些部位都在盆腔放疗范围外,可能是导致术后盆腔放疗难以有效控制远处转移和提高晚期患者生存率的原因之一[23]。一项来自国际多中心的3期临床试验(PORTEC-3)比较了辅助放化疗与单纯放疗对高危子宫内膜癌女性患者的疗效,结果显示,与单纯放疗相比,放疗期间给予化疗能提高患者的无进展生存期,但不能有效改善患者OS[24]。因此,高危患者行联合治疗,需评估患者状态进行个性化定制和长期随访,同时权衡治疗带来的毒性反应,以期改善患者生存及预后。
基于上述独立危险因素,本研究构建了列线图模型用于预测ECLM患者1年、3年OS,模型在训练队列和验证队列的C指数分别为0.767(95%CI为0.745~0.789)和0.744(95%CI为0.705~0.783),提示模型具有良好的预测准确性。ROC曲线、校准曲线和DCA均显示,本研究构建的预测模型具有较好的一致性及临床应用价值;并进一步通过Kaplan-Meier法分析不同变量对患者OS影响的差异。目前研究仍存局限性:(1)本研究基于公共数据库(SEER)建立,由于肝转移病例数较少,无法在本研究中开展外部验证,因此模型的外推能力需进一步通过外部数据进行评估;(2)SEER数据库未提供详细的治疗信息,限制了本研究对治疗方案的进一步探究;(3)本研究系回顾性研究,可能造成选择性偏倚;模型的预测准确性还有待未来多中心前瞻性研究进行进一步验证。
综上所述,评估ECLM患者的生存预后,应综合考虑肿瘤特征及治疗方式等因素,通过接受积极的手术治疗和化疗有望提高患者的总体生存率,而同时伴有骨转移和肺转移的患者预后往往不佳,这类人群需临床医生密切关注并加以全程科学化管理。本研究构建的ECLM患者的生存预测模型能准确预测患者1年和3年OS,协助临床医生评估患者预后和制定合适的治疗策略。未来需更多的随机对照试验提供准确的数据,以验证、更新和改进本模型。
