抗新冠病毒木瓜样蛋白酶原核表达条件优化及多克隆抗体的制备与鉴定*
2024-01-10刘志成闫干干闫浩浩刘晓丽刘晓平陈云雨
刘志成,闫干干,闫浩浩,刘晓丽,刘晓平,陈云雨
(皖南医学院药物评价与筛选研究所,安徽 芜湖 241000)
由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus-2,SARS-CoV-2)所引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)已成为全球性大流行病[1-3]。截至2022年9月5日,全球COVID-19累计确诊病例已超过6亿,死亡病例达646万。疫苗接种虽有效控制了SARS-CoV-2的传播,但随着SARS-CoV-2的高频基因突变和奥密克戎(omicron)变异株的出现使得疫苗保护效力下降,COVID-19确诊病例再次激增,人类的生命健康仍受到病毒严重威胁[4-5]。
SARS-CoV-2是具有包膜的单正链RNA病毒,与SARS-CoV同为β属冠状病毒,二者具有高度的同源性,基因组相似性达80%[6-7]。在SARS-CoV-2感染宿主细胞时,位于病毒表面的刺突糖蛋白与宿主细胞血管紧张素转换酶2受体结合,释放病毒RNA,形成对宿主细胞的感染。SARS-CoV-2基因组RNA通过宿主细胞核糖体翻译成两条同尾多聚蛋白质体pp1a和pp1ab,在病毒编码的主蛋白酶(main protease,Mpro)、木瓜样蛋白酶(papain-like protease,PLpro)的作用下,多聚蛋白质体被水解生成RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)、RNA解旋酶(RNA helicases)等16个非结构蛋白(non-structural proteins,NSP),在NSP的作用下,病毒颗粒得以进一步成熟与释放。在病毒的复制过程中,PLpro参与了NSP1、NSP2和NSP3的生成,是调控病毒复制关键功能分子[8-10]。
PLpro是分子量为36 kDa的多功能半胱氨酸蛋白酶,其分子构成主要包括三个部分:具有水解活性的催化结构域、调控PLpro生物活性的锌离子结合结构域以及促进免疫逃逸的泛素化结构域。在病毒的感染与复制过程中,PLpro可抑制宿主细胞的泛素化、干扰素诱导基因15(interferon-stimulated gene 15,ISG15)表达,促进病毒的免疫逃逸,PLpro还参与调控SARS-CoV-2子代病毒的生成,已成为抗新冠病毒药物开发的重要靶标。但目前还少有PLpro抑制剂的报道,且其有关的免疫逃逸机制尚未十分明确[11-12]。
本研究利用DNA重组技术,优化PLpro在大肠杆菌原核表达系统中的表达条件,制备高纯度的PLpro。并以PLpro作为抗原免疫大鼠,制备灵敏度高、特异性强的大鼠抗PLpro多克隆抗体,为PLpro的免疫学功能研究奠定基础。
1 材料与方法
1.1实验材料 重组质粒pET-28a-PLpro、重组大肠杆菌丝状热敏蛋白Z(FtsZ)、新冠病毒主蛋白酶(Mpro)、重组谷胱甘肽巯基转移酶融合的人淋巴细胞增强因子(GST-LEF1)为本实验室制备和保存;蛋白胨、酵母粉购于Oxoid公司(英国);琼脂糖、琼脂粉、蛋白质标准分子量、牛血清蛋白(BSA)购于北京全式金生物技术有限公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)购于上海阿拉丁生化科技股份有限公司;HisTrap层析柱购于Cytiva公司(美国);二辛可酸(BCA)蛋白质浓度定量试剂盒购于Thermo公司(美国);Wistar大鼠购自南京市青龙山实验动物繁殖场;Freund完全佐剂、Freund不完全佐剂购自Sigma公司(美国);HRP标记的山羊抗小鼠IgG、HRP标记的山羊抗大鼠IgG、小鼠抗组氨酸(His)标签单克隆抗体购自BOSTER公司(美国);96孔酶标板购自康宁公司;四甲基联苯胺(TMB)购自Tiangen公司(德国);其他试剂为国产分析纯试剂。
1.2PLpro原核表达的鉴定 使用本实验室已构建的重组质粒pET-28a-PLpro,按照参考文献所述方法[13],将重组质粒pET-28a-PLpro转化到大肠杆菌E.coli Rosetta(DE3)感受态细胞中,并将转化后的菌液均匀涂布于含卡那霉素抗性的LB固体培养基中,于37 ℃培养10 h。随机挑选6个重组子接种至LB液体培养基(含50 μg/mL卡那霉素,下同),37 ℃培养10 h,以1 mmol/L IPTG(1‰比例,下同)在30℃温度中诱导8 h,收集菌体。采用10%十二烷基硫磺钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定PLpro原核表达,并以未加诱导剂前菌体作为阴性对照。
1.3PLpro表达条件的优化 诱导最佳时间的确定:挑取单菌落接种至LB液体培养基中,置于37 ℃培养10 h,将其标识为工作种子:工程菌。将工程菌以2‰ 接种比例转接到6 mL LB液体培养基中37 ℃培养8 h(下述内容以同种方法培养工程菌),加入IPTG,设置诱导温度为20 ℃,继续培养12 h,并分别于0、2、4、6、8、10、12 h收集0.8 mL菌体,以SDS-PAGE确定PLpro在20 ℃上述各时间点的表达量。诱导温度更改为25 ℃、30 ℃,重复实验。
诱导最佳温度的确定:工程菌接种至50 mL LB液体培养基同法培养,加入IPTG,20 ℃培养。收集菌体,使用超声波细胞粉碎仪对菌体进行破碎,分别收集上清液与沉淀,以SDS-PAGE法鉴定PLpro可溶表达量。将诱导条件设置为25 ℃培养、30 ℃培养,同法操作实验。
最佳IPTG诱导浓度的确定:将工程菌转接至6 mL LB液体培养基中同法培养,设置诱导温度为20 ℃,分别加入0、0.2、0.4、0.6、0.8、1 mmol/L IPTG,培养10 h。以SDS-PAGE确定IPTG浓度对PLpro表达的影响。
1.4PLpro的分离纯化与鉴定 工程菌接种至50 mL LB液体培养基中同法培养,加入IPTG后,调整温度至20 ℃,培养10 h,菌体以超声波法破碎,收集上清液。由于PLpro含多聚组氨酸标签,以HisTrapTM亲和层析柱对PLpro分离纯化[13-14]。纯化的PLpro以SDS-PAGE法进行纯度鉴定,经浓缩超滤管浓缩和透析后,再以BCA法进行浓度测定。
1.5大鼠抗PLpro多克隆抗体的制备 改进文献所述方法,以纯化的PLpro作为抗原免疫Wistar大鼠,制备抗PLpro多克隆抗体[15-16]。首先,将纯化的PLpro(200 μg/次/只)与等量Freund完全佐剂进行充分乳化,皮下注射,免疫大鼠。每次免疫间隔设定为3周,在第2次和第3次免疫程序中,使用PLpro与等量Freund不完全佐剂进行乳化后,对大鼠进行接种。每次免疫后一周,尾部静脉微量取血,分离血清,ELISA测抗血清效价。抗血清效价大于1∶70 000时,取大鼠全血,分离血清备用。
1.6ELISA法检测大鼠抗PLpro多克隆抗体的效价与抗原特异性 参考文献[17]所述方法对大鼠抗PLpro多克隆抗体的效价进行鉴定。使用碳酸盐包被缓冲液将PLpro稀释成10 μg/mL,加入96孔酶标板中(加样量为:100 μL/孔),4 ℃过夜。次日,96孔酶标板以PBST溶液洗涤,再以含5% BSA的PBST溶液进行室温封闭2 h后,加入抗血清稀释液。抗血清以PBS溶液进行2倍比稀释,起始稀释浓度为1∶2 000,共稀释10个浓度梯度。每孔加样量为100 μL,每个浓度设置3个复孔,室温孵育1 h,设定免疫前血清作为阴性对照组。酶标板经PBST洗涤后,以HRP标记的山羊抗大鼠IgG(1∶4 000)作为二抗,室温孵育1 h。每孔加入50 μL TMB溶液,避光显色5 min后,加入50 μL 2 mol/L H2SO4终止反应,检测A450值。设定S/N=A稀释抗血清/A阴性对照,按文献[15]所述阳性样品判断标准为S/N ≥3。
将FtsZ、Mpro和GST-LEF1代替PLpro分别包被到96孔酶标板中,同法操作,检测大鼠抗PLpro多克隆抗体的抗原交叉反应,确定其抗原特异性。
1.7免疫印迹法检测大鼠抗PLpro多克隆抗体的灵敏性 将400、200、100、50、25、12.5、6.25 ng PLpro经SDS-PAGE电泳,电泳后的凝胶利用半干法转膜仪进行转膜。电转结束后,将免疫印迹膜经甲醇活化后,以含5% BSA的PBST溶液封闭过夜。次日,以制备的抗PLpro多克隆抗体(1∶10 000)作为一抗、HRP标记的山羊抗大鼠IgG作为二抗,分别进行室温孵育反应,以化学发光法显影成像。
2 结果
2.1PLpro原核表达的鉴定 由于PLpro含多聚组氨酸标签,分子量从36 kD增加至36.8 kD,工程菌经IPTG诱导后,SDS-PAGE实验结果显示,在分子量36.8 kD位置有明显的目的蛋白条带,说明在大肠杆菌中成功地对PLpro进行了原核表达。见图1。
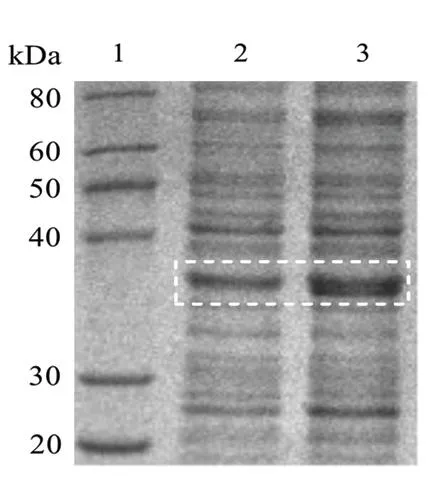
图1 PLpro原核表达的鉴定
2.2PLpro最佳表达条件的确定 等量收集0、2、4、6、8、10、12 h时间点的菌体,在20 ℃温度下,随诱导时间的延长,表达的PLpro量逐渐增多。当为10 h时,表达的PLpro量达到最大值(图2A)。在25 ℃诱导条件下,诱导时间为8 h时,PLpro表达量达到最大值(图2B)。在30 ℃诱导条件下,诱导时间为6 h时,PLpro表达量达到最大值(图2C)。
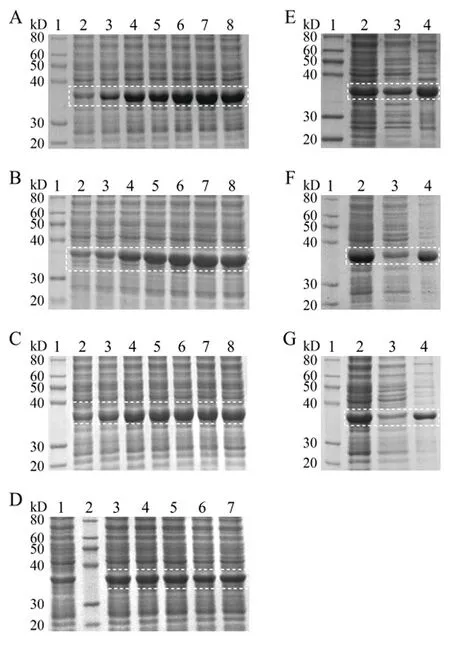
图2 PLpro表达条件的优化
SDS-PAGE电泳结果显示,在20 ℃诱导10 h条件下,裂解上清液中可观察到明显的PLpro条带,此时PLpro可溶表达量最多(图2E)。在25 ℃诱导8 h条件下,裂解上清液中PLpro含量相对于20 ℃诱导10 h条件下有所减少,包涵体表达有所增加(图2F)。在30 ℃诱导6 h条件下,裂解上清液中PLpro表达量最少,说明其可溶表达量较少(图2G)。另外,PLpro在大肠杆菌中的表达量受IPTG诱导浓度的影响较小,0.2 mol/L IPTG即可诱导PLpro的大量表达(图2D)。
综上所述,PLpro最佳表达条件为:工程菌以0.2 mmol/L IPTG在20 ℃中诱导培养10 h。
2.3PLpro的分离纯化与鉴定 工程菌以所确定的最佳表达条件(0.2 mmol/L IPTG在20 ℃中诱导培养10 h)诱导菌体,以HisTrapTM亲和层析柱进行分离纯化,由于含His标签,分子量增加0.8 kD,经SDS-PAGE显示在分子量36.8 kD处获得了PLpro的单一条带,此时纯化的PLpro纯度大于90%,浓度为1.1 mg/mL。见图3。
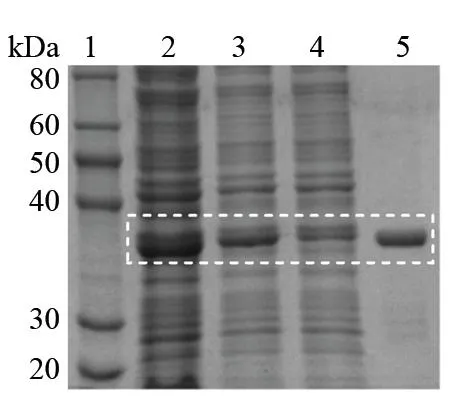
图3 PLpro的分离纯化与鉴定
2.4大鼠抗PLpro多克隆抗体的效价与抗原特异性测定 以纯化的PLpro作为抗原,对大鼠进行3次免疫后,收集抗血清。采用ELISA法对抗血清进行效价测定。实验结果表明,当抗血清稀释倍数为1∶256 000时,S/N值为3.8,若继续稀释时,则S/N值小于3,故此抗血清的效价为1∶256 000;将抗血清依次与FtsZ、Mpro和GST-LEF1进行反应后,ELISA实验结果表明,抗血清与上述蛋白质均无明显的交叉反应,表明制备的大鼠抗PLpro多克隆抗体具有较好的抗原特异性。见图4。
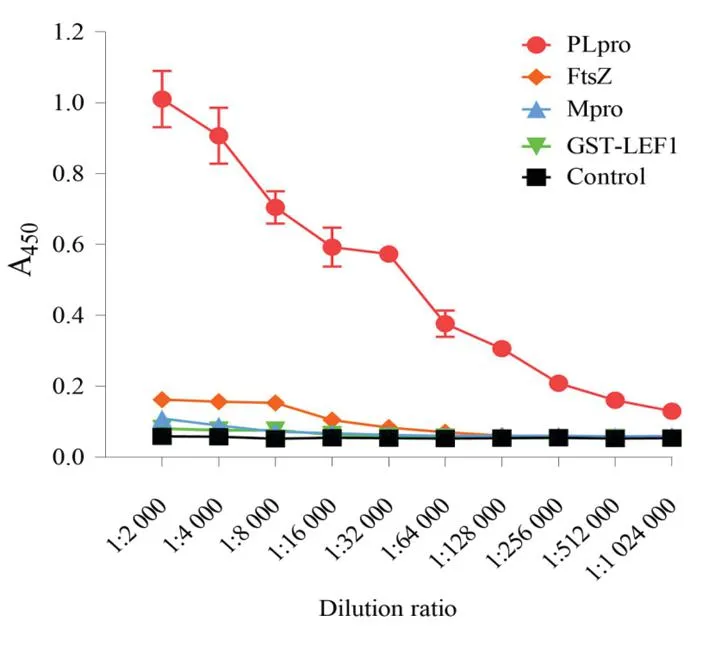
图4 大鼠抗PLpro多克隆抗体的效价与抗原特异性的测定
2.5大鼠抗PLpro多克隆抗体的灵敏性测定 将大鼠抗PLpro多克隆抗体作为一抗,以Western blot法进行抗血清的灵敏性测定。实验结果表明,当PLpro剂量从400 ng梯度依次递减时,抗血清的最低检测剂量为12.5 ng,说明制备的大鼠抗PLpro多克隆抗体具有良好的灵敏性。见图5。
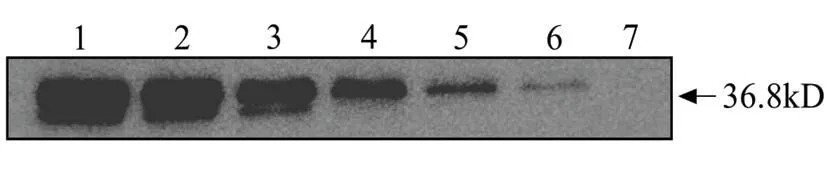
图5 大鼠抗PLpro多克隆抗体的灵敏度测定
3 讨论
目前,SARS-CoV-2引发的新冠疫情在全球持续蔓延,不断出现的变异毒株造成了病毒的免疫逃逸现象,使得疫苗保护效力下降,感染病例呈现出反复性增多的趋势,医疗卫生系统仍面临着巨大挑战。尽管已上市了抗SARS-CoV-2的特效药物,但面对SARS-CoV-2的高频突变和感染人数的数次激增,仍需开发更多的抗病毒药物来应对病毒变异导致的药物耐受和药物供需不足的临床需求。相对保守的PLpro在SARS-CoV-2感染与复制的过程中发挥着关键作用,在病毒侵入机体时,PLpro可抑制机体的磷酸化和泛素化过程,促进病毒对机体的免疫逃逸[18-21]。在病毒RNA的转录与翻译过程中,PLpro可参与病毒非结构蛋白NSP1、NSP2和NSP3的生成,调控SARS-CoV-2的复制。PLpro已成为抗病毒药物开发的热门靶标之一,深入研究PLpro的免疫学功能具有重要意义。因此,原核表达PLpro,制备抗PLpro多克隆抗体,可对PLpro药物的开发和免疫学功能研究奠定物质基础。
本研究采用的大肠杆菌原核表达系统具有操作简单、成本低廉、蛋白产率高等特点,在动物蛋白、植物蛋白、细菌蛋白等的异源表达中被广泛应用[13-14,22-23]。本研究采用的重组质粒pET-28a-PLpro,在前期的研究中已进行了蛋白表达的鉴定,并初步证实了表达的PLpro具有良好的生物活性[13]。考虑到异源蛋白在大肠杆菌中的表达受温度、时间和IPTG浓度的影响,为高效化制备PLpro,我们在实验室条件下对PLpro的表达条件进行优化。通过SDS-PAGE进行蛋白表达和可溶性鉴定可知,诱导温度16 ℃与20 ℃上清表达量无差异,并考虑实验室初步纯化条件,最终优化的PLpro最佳诱导温度为20 ℃、诱导时间为10 h、最佳IPTG诱导浓度为0.2 mmol/L。同时,本研究利用构建重组质粒时附加的多聚组氨酸标签,以HisTrapTM亲和层析柱进行纯化,通过调整咪唑含量,降低无关蛋白对HisTrapTM层析柱的非特异性吸附,分离纯化出了纯度可达90%、蛋白浓度超过1 mg/mL的PLpro(1.1 mg/mL),为大鼠抗PLpro多克隆抗体的制备奠定了良好的物质基础。
多克隆抗体具有制备工艺简单、灵敏度高、特异性强等特点,研究者多以纯化后的蛋白免疫大鼠、小鼠、家兔等制备多克隆抗体用于蛋白功能学研究。本研究以高浓度的PLpro(1.1 mg/mL)免疫大鼠,经多次抗原刺激加强免疫,增强了大鼠抗PLpro血清的抗体滴度。经分离后,以ELISA实验和Western blot实验对大鼠抗PLpro的抗体效价和检测限进行评价,证实制备的多克隆抗体ELISA效价可达1∶256 000,Western blot最低检测限为12.5 ng,证明所制备的大鼠抗PLpro多克隆抗体具有良好的灵敏度和特异性[24]。同时,我们观察到PLpro的蛋白纯度还可进一步提高,而蛋白纯度可影响多克隆抗体特异性。在下一步的工作中,我们将进一步优化PLpro纯化条件,提高PLpro纯度,制备特异性更高的抗PLpro多克隆抗体,以期更好满足PLpro的研究需求。
综上所述,PLpro是SARS-CoV-2复制和免疫逃逸过程中的重要功能分子,已成为极具吸引力的药物治疗靶点,进一步研究PLpro的功能具有重要意义。本研究基于蛋白的原核表达策略,成功进行了PLpro的原核表达条件优化及其多克隆抗体的制备,并采用ELISA和Western blot法对PLpro多克隆抗体的灵敏度和特异性进行了鉴定,为PLpro的抗病毒药物开发和免疫学功能研究奠定了实验和物质基础。
