布氏田鼠盲肠中纤维素分解菌的分离鉴定及其产酶条件优化
2024-01-10顾明慧范瑞洋王道晨于明浩魏万红杨生妹
顾明慧, 范瑞洋, 王道晨, 顾 晨, 于明浩, 魏万红, 杨生妹
(扬州大学生物科学与技术学院, 江苏扬州 225009)
纤维素是自然界中数量最多的可再生资源之一[1]。由于其特殊的晶体结构在自然条件下难以被水解,仅少量纤维素能被降解利用[2]。纤维素酶是一组能将纤维素分子降解为纤维二糖和葡萄糖等小分子物质的复合酶[3]。利用微生物产纤维素酶降解纤维素是一种较有效的纤维素处理方法,该方法温和、产物产率高、无二次污染[4]。
目前已从土壤[5]、堆肥[6]、反刍动物胃肠道[7]等环境中分离出多株高产纤维素酶的菌株,但对布氏田鼠胃肠道纤维素分解菌的研究尚未见报道。布氏田鼠是主要分布在我国内蒙古草原上的一种植食性哺乳动物[8-9], 每只每天可食用约40 g鲜草[10], 是典型的盲肠发酵动物。Ye等[11]研究表明布氏田鼠盲肠内微生物数量和种类复杂多样。鉴此,本研究以布氏田鼠盲肠内容物为材料,通过刚果红染色初筛、酶活力测定复筛等方法筛选出高酶活性纤维素分解菌株,并对菌株进行形态学及分子生物学鉴定,研究其酶学特性,为纤维素资源的开发利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
布氏田鼠捕捉于内蒙古锡林浩特草原,饲养于扬州大学生物科学技术学院实验动物房,并建立繁殖系。随机选100日龄健康布氏田鼠雌雄各2只作为研究对象。布氏田鼠饥饿12 h后行安乐死,随后解剖取出盲肠,放入无菌EP管中,于-80 ℃冰箱中保存备用。
1.1.2 主要试剂
蛋白胨、酵母提取物(济南金华峰辉生物科技公司); MgSO4·7H2O、NaCl、K2HPO4、琼脂(国药集团化学试剂公司); 刚果红、3,5-二硝基水杨酸(DNS) (上海生工生物工程公司)。
1.1.3 主要仪器及设备
台式高速冷冻离心机(德国Eppendorf公司); 电热恒温干燥箱(上海市实验仪器总厂); 酶标仪(上海精密科学仪器公司); 高压蒸汽灭菌锅(日本Tomy公司); 电子天平(上海精密科学仪器公司); PCR 扩增仪(德国Christ-Elektronik公司); 凝胶成像分析仪(BIO-RAD Laboratories-Segrate)(美国Bio-Rad公司); 恒温培养摇床(上海福玛实验仪器公司)等。
1.2 培养基与配方
1) 羧甲基纤维素钠(CMC-Na)筛选培养基: CMC-Na 10 g, K2HPO41.5 g, 蛋白胨5 g, 酵母粉5 g, NaCl 5 g, MgSO4·7H2O 0.2 g, 琼脂16 g, 纯化水1 000 mL。
2) LB培养基: 蛋白胨10 g, 酵母5 g, NaCl 10 g, 纯化水1 000 mL。
3) 发酵产酶培养基: 蛋白胨10 g, 酵母5 g, NaCl 10 g, CMC-Na 10 g, 纯化水1 000 mL。
1.3 试验方法
1.3.1 纤维素分解菌初筛
在超净工作台上将盲肠内容物挤入50 mL无菌生理盐水中,在摇床上震荡30 min。摇完后菌液混匀,梯度稀释至10-5级,取各浓度稀释肠液0.2 mL, 分别涂布于CMC-Na平板上, 于37 ℃恒温培养箱中培养48 h, 向培养皿中加入适量的1 mg·mL-1刚果红溶液,染色1 h后弃去染液,再加入适量1 mol·L-1NaCl溶液洗涤[12], 并测量水解圈的大小。
1.3.2 纤维素分解菌复筛
将初筛菌株接种到液体发酵产酶培养基中,培养24 h后离心取上清液,即为粗酶液。以葡萄糖作为标准,采用3,5-二硝基水杨酸(DNS)试剂法测定纤维素酶活性, CMC-Na在纤维素酶的作用下,水解产生纤维二糖和葡萄糖等还原糖,还原糖能将DNS中的硝基还原成棕红色氨基化合物,在波长540 nm处测定吸光度D值,吸光度与酶活性呈正比。纤维素酶活性定义: 以每毫升粗酶液每分钟产生1 mg葡萄糖所需的酶量作为1个酶活性单位(U·mL-1)。
1.3.3 菌株鉴定
1) 形态学鉴定: 经初筛、复筛出1株纤维素酶活性最高的菌株T1, 观察菌落的形态特征,并通过革兰染色观察菌体的染色特征[13]。
2) 分子生物学鉴定: 菌株T1培养过夜后用细菌基因组提取试剂盒提取DNA, PCR反应的引物为细菌通用引物, PCR反应体系体积为25 μL, 反应条件见文献[14]。测序由上海生工生物工程公司完成。将测序结果在GenBank数据库中用BLAST比对获得相似性高的序列。利用MEGA6.0 构建系统进化树,根据菌株间的亲缘关系确定菌株的种属。
1.3.4 菌株生长曲线
将菌株T1接种到LB培养基中,培养至D值为1.0, 得种子液。按1%种子液接入50 mL新配制的LB培养基中, 37 ℃摇床培养, 每4 h用酶标仪测1次D600 nm值, 直至60 h。
1.3.5 产酶条件优化
将种子液接入发酵培养基中,依次优化培养基中碳源(高粱、玉米、大豆、羧甲基纤维素钠、水稻、小麦)、氮源(蛋白胨、硫酸铵、硝酸铵、明胶)的种类和浓度(0.5%、1%、1.5%、2%、2.5%)以及接种量(1%、2%、3%、4%、5%、6%、7%), 37 ℃、160 r·min-1振荡培养24 h, 将菌液在上述确定的最佳条件下进行纤维素酶活性测定,试验重复3次,结果取平均值。
1.3.6 纤维素酶的酶学特性研究
1) 酶反应最适pH: 将1.0% CMC-Na的底物分别溶于pH 3.0~7.0的缓冲液中, 40 ℃反应30 min 后测定该纤维素酶活性,试验重复3次, 结果取平均值,最终确定纤维素酶反应的最适pH值。
2) 酶的酸碱稳定性: 将pH 4.0~8.0 缓冲液与粗酶液按同等量混匀, 40 ℃水浴中保温1 h, 在最适pH反应条件下,测定相对纤维素酶活性,试验重复3次, 结果取平均值,并评价酶的酸碱稳定性。
3) 酶反应最适温度: 将粗酶液分别置于不同温度(40、50、60、70和80 ℃)反应30 min, 测定该纤维素酶活性,试验重复3次,结果取平均值,最终确定纤维素酶反应的最适温度。
4) 酶的热稳定性: 将粗酶液分别在30、40、50、60和70 ℃的水浴中保温1 h, 在最适温度和最适pH下测定相对酶活性,试验重复3次,结果取平均值,并评价该酶的热稳定性。
5) 最适反应时间: 将粗酶液与CMC-Na底物在最适 pH及最适温度条件下分别反应10、20、30、40和50 min, 测定不同反应时间纤维素酶活性,确定纤维素酶反应的最佳时间。
2 结果与分析
2.1 纤维素分解菌株的筛选
在CMC-Na选择培养基上挑取菌落形态不同的菌株共8株,经纯化培养,利用刚果红染色后菌落周围可见清晰的透明水解圈。将获得的菌株进行摇瓶发酵复筛,筛选结果见表1。最终选取纤维素酶活性最高的菌株T1用于酶学特性及产酶条件的探究。
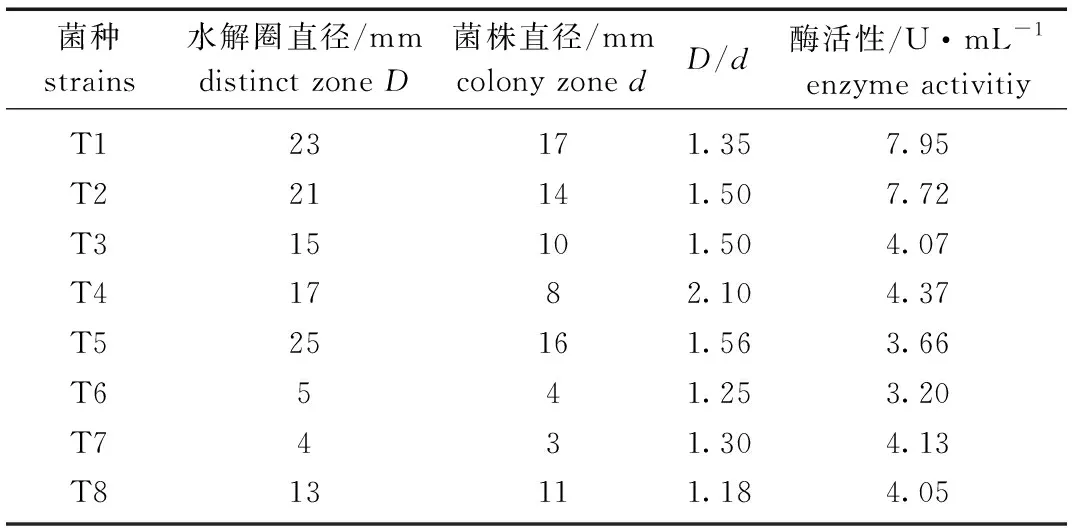
表1 纤维素分解菌的分离筛选Tab.1 Isolation and screening of cellulose-degrading bacteria
2.2 菌株T1的鉴定
2.2.1 菌株T1的形态学鉴定
经观察表明,菌株T1在固体培养基上扁平,表面褶皱,形成灰白色不透明的菌落(图1.A)。经革兰染色,菌株T1为革兰阳性杆状菌,有芽孢(图1.B)。

图1 菌株T1的菌落形态特征及革兰染色Fig.1 Morphology characteristic and gram staining of strain T1
2.2.2 菌株T1的分子生物学鉴定
测序结果显示,该纤维素分解菌T1的16SrDNA基因序列长为1 374 bp左右。序列同源性分析显示,菌株T1与芽孢杆菌属细菌的16SrDNA序列相似性在99%以上。系统进化树分析显示,该菌株与Bacillussubtilisstrain亲缘关系最近(图2)。综合该菌株的菌落形态、生化特性和分子生物学鉴定结果,确定获得的纤维素分解菌T1为枯草芽孢杆菌。

图2 菌株T1 16S rDNA基因序列的系统发育树*Fig.2 Phylogenetic tree of strain T1 based on its 16S rDNA gene* 图中节点处数字为重复1 000次所得到的自举百分率。* The number at the node shows the bootstrap percentage obtained by repeating 1 000 times in the figure.
2.3 菌株T1的生长特性
图3为菌株T1的生长规律,当发酵培养4~16 h时,菌株 T1 进入对数生长期; 培养16~48 h 时处于缓慢增长期; 40 h 后进入衰退期。

图3 菌株T1的生长曲线Fig.3 Growth curve of strain T1
2.4 菌株T1产纤维素酶条件的初步优化
2.4.1 碳源种类及浓度对菌株酶活性的影响
由图4.A可知,菌株T1可利用高粱、玉米、大豆、水稻、小麦及CMC-Na等碳源,但以玉米粉作为碳源时,酶活性最高(8.83 U·mL-1), 以小麦为碳源时,酶活性最低(5.34 U·mL-1)。由于玉米粉来源广,价格低廉,因此选择玉米粉作为最佳碳源。由图5.B可知,当玉米粉浓度为1.5%时, 酶活性最高(9.48 U·mL-1), 随着浓度的上升,酶活性降低。因此选择浓度为1.5%的玉米粉作为最佳碳源进行后续研究。
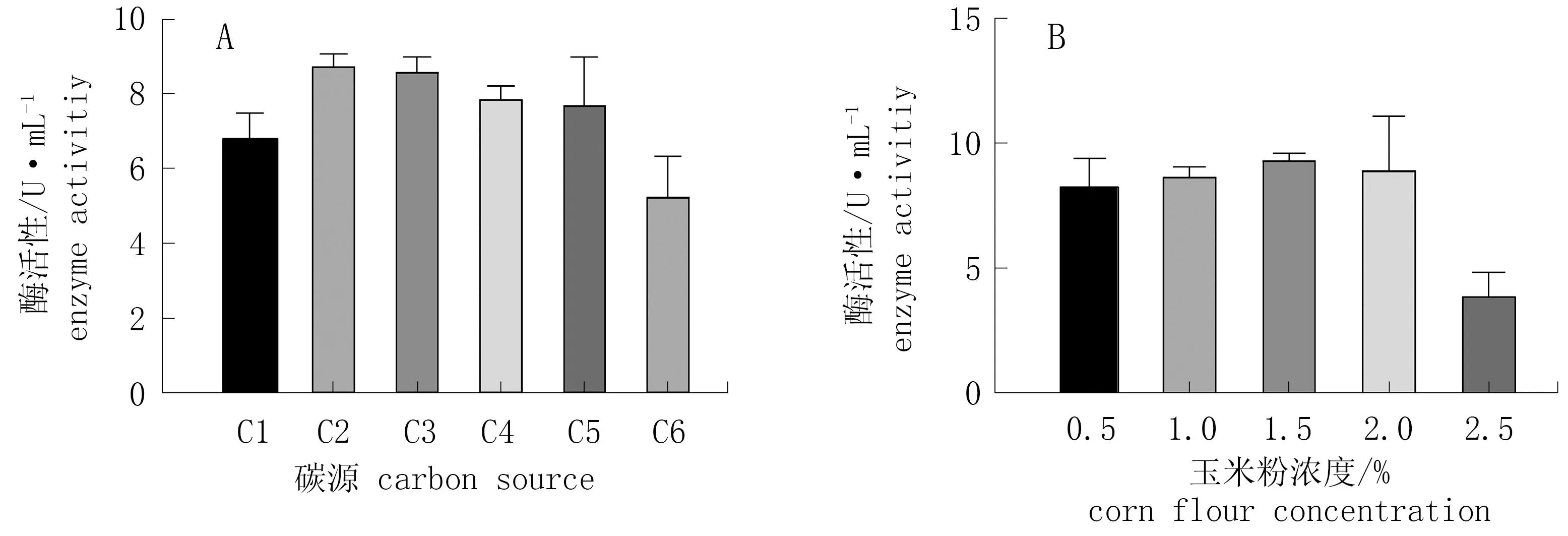
图4 不同碳源和玉米粉浓度对酶活性的影响*Fig.4 Effect of carbon source and corn flour concentration on enzyme activity* C1. 高梁; C2. 玉米; C3. 大豆; C4. CMC-Na; C5. 水稻; C6. 小麦。* C1. sorghum; C2. millet; C3. bean; C4.CMC-Na ; C5. rice; C6. wheat.

图5 不同氮源和蛋白胨浓度对酶活性的影响*Fig.5 Effect of nitrogen source and peptone concentration on enzyme activity* N1. 蛋白胨; N2. 硫酸铵; N3. 硝酸铵; N4. 明胶。* N1. peptone; N2. (NH4)2SO4; N3. NH4NO3; N4. gelatin.
2.4.2 氮源种类及浓度对菌株酶活性的影响
由图6.A可知,菌株T1可利用蛋白胨、硫酸铵、明胶、硝酸铵等氮源,其中以蛋白胨为氮源时酶活性最高,以硝酸铵为氮源时酶活性最低。由图6.B可知,当蛋白胨浓度为1%时酶活性最高。因此以1%蛋白胨作为最佳氮源进行后续研究。
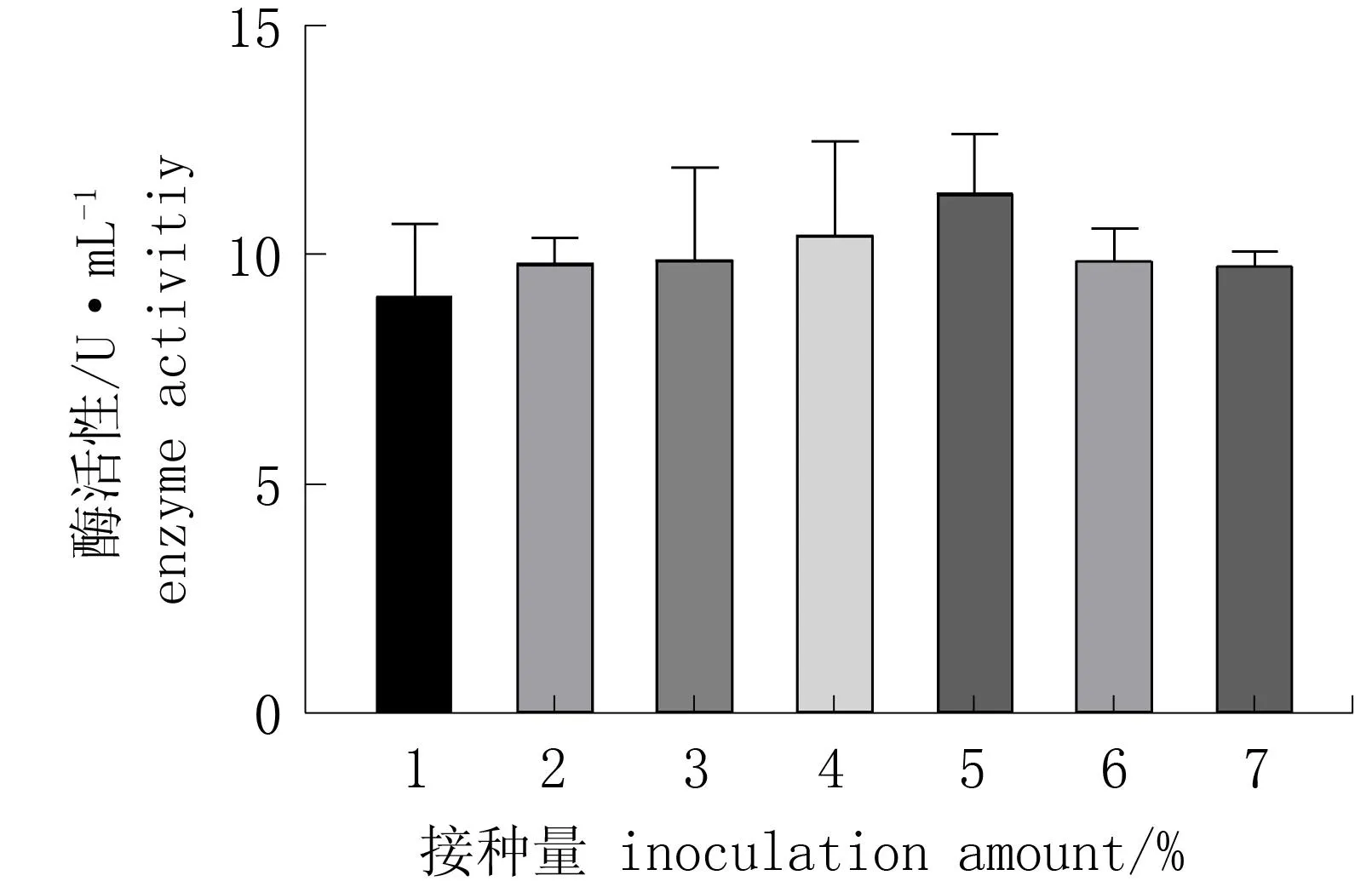
图6 不同接种量对菌株T1酶活性的影响Fig.6 Effect of different inoculation amount on enzyme activity
2.4.3 菌液接种量对菌株酶活性的影响
由图6可知,菌液接种量明显影响酶活性,当接种量为5%时酶活性最高(11.49 U·mL-1); 接种量超过5%后,酶活性降低,因此最佳接种量为5%。
2.5 菌株T1分泌纤维素酶的酶学特性
2.5.1 纤维素酶的最适pH和pH稳定性
以CMC-Na为底物,在缓冲溶液中测定纤维素酶的最适pH。由图7.A可知,菌株T1分泌的纤维素酶最适pH为4.8, 在pH 3~4.8时,随着pH的增加酶活性升高,当pH超过4.8后酶活性降低。在37 ℃条件下,将纤维素酶在不同缓冲液中保温1 h, 以未处理的粗酶液为100%计算残存酶活性百分比,即相对酶活性。由图7.B所示,在pH 4~8范围内酶活性均保持在60%以上,说明菌株T1分泌的纤维素酶具有良好的耐酸碱性。

图7 不同pH对酶活性和酶稳定性的影响Fig.7 Effect of different pH on activity and stability of cellulase
2.5.2 纤维素酶的最适温度和热稳定性
由图8.A可知,在温度40 ℃时酶活性最高,且随着温度的升高,酶活性逐渐降低。由图8.B可知,当温度为40~50 ℃时,酶活性保持在80%以上,稳定性强; 当温度为50~80 ℃时,酶活性迅速下降。
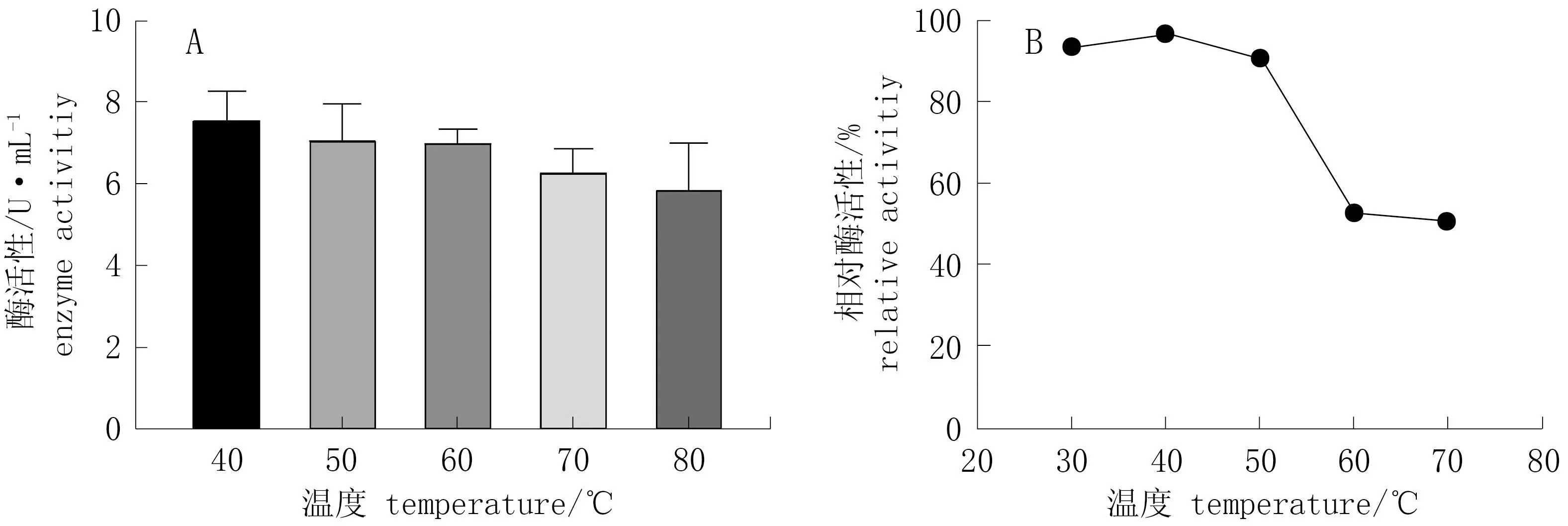
图8 不同温度对酶活性和酶稳定性的影响Fig.8 Effect of different temperature on activity and stability of cellulose
2.5.3 纤维素酶的最佳反应时间
由图9可知,随着反应时间的延长,酶活性增高,在反应时间40 min 时酶活性最高,此后酶活性降低。

图9 不同反应时间对酶活性的影响Fig.9 Effect of different reaction time on enzyme activity
3 讨论
本研究采用以CMC-Na为唯一碳源的选择培养基,通过刚果红染色初筛, DNS法测定酶活性复筛出1株纤维素分解菌,这是一种简单、快捷、低成本的方法。最终确定T1菌株为布氏田鼠盲肠内产纤维素酶的优势菌,并对其进行16SrDNA分子生物学鉴定,鉴定确认菌株T1为枯草芽孢杆菌的一种。本研究结果丰富了布氏田鼠肠道源纤维素降解菌的种类,为高效菌株T1的纤维素酶利用提供了理论基础。
目前,国内已有较多纤维素分解菌的相关研究报道。何静等[15]从双峰驼粪便中筛选出多株纤维素分解菌,其中酶活性最高的一株是纤维化纤维微菌(Cellulosimicrobiumcellulans), 经过优化后酶活性可达0.66 U·mL-1。苏少锋[16]从蒙古马肠道中获得一株高产纤维素酶的细菌,经鉴定该菌为解淀粉芽孢杆菌(Bacillusamyloliquefaciens), 优化后酶活性可达0.92 U·mL-1。 也有研究从落叶土壤、高温好氧堆肥中分离出能降解纤维素的细菌,如短小芽孢杆菌[17]、嗜热脂肪芽孢杆菌[18]等。
枯草芽孢杆菌属于好氧、嗜温、产芽孢的革兰阳性短杆菌[19], 广泛存在于动物肠道、土壤以及腐败的有机物中[20]。吴丽娟等[21]研究表明,枯草芽孢杆菌可拮抗肠道中有害菌群增殖,具有维护肠道内环境平衡和增强免疫力等功能。本研究经条件优化后酶活性可达11.49 U·mL-1, 高于陈龙等[22]从梅花鹿新鲜粪便中分离出的枯草芽孢杆菌酶活性(1.106 U·mL-1), 以及高于徐荣[23]从白蚁肠道中分离出的枯草芽孢杆菌酶活性(3.6 U·mL-1), 因而具有广阔的应用前景。
诸多研究表明,菌株的发酵条件,如碳源、氮源、温度、pH和接种量等均会影响纤维素酶活性[24]。关于产酶条件的优化,高云航等[25]从白蚁肠道中分离出最强菌株MX5, 以0.5%秸秆为碳源、0.5%酵母粉和硫酸铵混合物为氮源、接种量1%时,产酶活性最高。杨伟平等[26]从藏猪肠道中分离出BacillussublitisBY-2, 其发酵所需的最佳碳源为1%玉米粉、最佳氮源为2%蛋白胨和酵母粉的复合物,在发酵起始pH值5.5、接种量4%时产纤维素酶量高且稳定。本研究结果表明,在产酶发酵基础培养基中以1.5%玉米粉为碳源、1%蛋白胨为氮源、5%接种量时酶活性最高。这与高云航等[25]研究结果不同。虽然菌株均从肠道中分离得到,但由于存在不同菌株以及不同菌株来源等原因,使得最佳产酶条件差异很大。该酶最适温度为40 ℃、最适pH为4.8, 具有一定的耐酸性和耐热性,因此在食品行业或废料处理等方面具有较广的应用前景。
4 结论
以布氏田鼠盲肠内容物为研究对象,初筛出8株具有分解纤维素能力的菌株,发酵法复筛出分解能力最强的菌株T1, 经鉴定确定为枯草芽孢杆菌(Bacillussubtilisstrain)。菌株T1以1.5%玉米粉作为碳源、1%蛋白胨作为氮源、接种量为5%时产纤维素酶量最高。该纤维素酶最适反应pH为4.8, 最适反应温度为40 ℃, 最佳反应时间为40 min, 且具有一定的酸碱耐受性和热稳定性。
