改性壳聚糖吸附剂的制备及其对Cu2+的吸附性能
2024-01-10王曦宇哈斯
王曦宇,哈斯
(呼和浩特民族学院 化学与环境学院,内蒙古 呼和浩特 010051)
随着科学技术的快速发展,水污染问题日益严峻,特别是工业废水和生活废水的排放量激增,导致水体污染加剧严重,不仅对动植物造成污染,而且对人类健康也造成了巨大的威胁[1]。当工业废水和生活废水中的重金属离子被排放到环境中时,不但会对环境产生一定的影响,而且通过食物链和食物网的物质循环、生物累积、生物放大的作用,最终重金属离子一定会直接或间接地进入到人体,一旦过量的重金属离子进入人体,就会给人体带来很大的危害。在现实生活中已经有许多因含重金属离子的废水排放到环境中而使人类患病的事件发生,例如日本的“水俣病”就是由于含汞金属的废水排入江河大海,经食物链富集到鱼类体内,使鱼体内含汞量剧增,最后被人类食入,从而使大量人群中毒患病甚至死亡,类似事件还有“痛痛病”、“河南济源血铅儿童事件”等。
重金属如铅、汞、镉等对人体健康有着不可逆的影响,长期接触这些重金属会导致神经系统、免疫系统、生殖系统、肝脏、肾脏等多种器官受损。这些受损具体表现为头痛、记忆力下降、行动不便、感染、过敏、癌症风险增加、不育、性功能障碍、肝病、肾病等疾病。此外,当人体摄入过量的铬:可以引起人的肢体麻痹和心理失常;摄入过量的砷导致皮肤不正常地角质化,对皮肤造成损伤;摄入过量的铅会对人的脑细胞造成一定伤害;摄入过量的铜可能引起人体内的铜中毒,进而对人体的代谢功能产生影响,引起肝、肾功能损害。因此,随着人们生活水平的提高,对自身健康意识的增强,工业废水中重金属离子的去除问题越来越受到大家的关注。
目前,有多种方法可用于处理重金属污水,主要包括化学沉淀法、离子交换法、膜分离法、电化学法、生物化、吸附法[2]。化学沉淀法因其具有操作简便、易于控制变量、不会造成额外的污染、技术成熟等特点,受到大家的一致好评,成为目前应用最广泛、技术最为成熟的工业废水处理方法,但其也具有较多的缺点,例如多用于处理重金属初始质量浓度较高的废水,对于质量浓度较低的重金属废水去除效率偏低[3],选择重金属离子能力较差,容易发生二次污染,花费成本也较高。离子交换法因其离子交换树脂存在强度低、易氧化失效、再生频繁、运行成本高等[4]一系列缺点很难应用于大型废水处理项目中。膜分离技术虽然对污水的处理效率高、占地面积小、操作简便、不需要过多的投资,也不需要再投加化学药剂对环境造成额外的污染,但因其膜的通量较小,需要定期更换新膜,后续维护成本较高、较复杂的缺点限制了其广泛应用。生物法虽然不会产生二次污染,还能改善生态环境,前期投资成本也不高,但因其存在微生物培养、保存困难、受环境影响较大、修复过程缓慢等缺点,造成很少有人会去使用这种方法[5]。吸附法是目前最高效也是应用范围最广的污水处理工艺,这种方法不仅操作简单、高效,而且对金属离子具有选择吸附性,可以很好地去除想要去除的离子,同时使用成本低廉,可再生吸附剂还能够做到循环使用,这在一定程度上减少了环境污染的问题,此方法也逐渐受到大家的关注[6]。所以,从环境保护、资源回收等方面来看,利用吸附剂进行选择性吸附是处理含重金属废水的一种行之有效的方法。
壳聚糖作为一种储量丰富,未得到充分利用的有机聚合物,得到众多学者的广泛研究与应用,其在重金属吸附领域也占据一定的主导地位,因而壳聚糖受到越来越多人的关注与使用,具有良好的应用前景。然而,壳聚糖在酸性介质中易溶解、吸附选择性差、吸附容量低等缺点限制了其进一步应用,因此若要改善这种性能,对壳聚糖的改性成为近年来研究的热点[7]。目前,常见的壳聚糖改性方法有酰基化、羧基化、醚化、烷基化、季铵化、交联、共聚改性[9-10]等,壳聚糖的改性也是今后研究侧重的趋势。本课题采用戊二醛为交联剂,二硫化碳黄原酸化,制备出戊二醛交联黄原酸化壳聚糖吸附剂,并对Cu2+的吸附效果进行探讨。
1 材料与制备方法
1.1 实验仪器及试剂
1.1.1 实验试剂
实验试剂为表1。
1.1.2 实验仪器
实验仪器如表2。

表2 实验仪器
1.2 改性壳聚糖的制备
1.2.1 戊二醛交联
称取2 g壳聚糖原料,加入400 mL甲醇溶剂,再加入0.5 mL 质量分数25%戊二醛水溶液,使用加热磁力搅拌器50 ℃搅拌反应6 h,等待反应结束后进行抽滤处理,室温下干燥,所得产物为交联壳聚糖。
1.2.2 黄原酸化
称取2 g交联壳聚糖,加入100 mL 0.2 mol/L的氢氧化钠水溶液,再加入4 mL二硫化碳,使用加热磁力搅拌器40 ℃搅拌反应4 h,抽滤,所得滤渣用蒸馏水洗涤至中性后再用无水乙醇洗涤[11],洗涤完成后对其进行抽滤,滤渣在室温下干燥24 h,所得产物为戊二醛交联黄原酸化壳聚糖(Glutaraldehyde crosslinked xanthan acidified chitosan,GCXCS),此后简写将戊二醛交联黄原酸化壳聚糖称为GCXCS。
2 吸附实验
2.1 Cu2+初始pH值对吸附量的影响
称取0.1 g GCXCS,加入50 mL 2 mg/L Cu2+模拟废液,调节pH值分别为1,2,3,4,5,6,使用加热磁力搅拌器25 ℃ 搅拌吸附2 h,等待反应结束后进行抽滤处理,抽滤结束后使用原子吸收分光光度计测定滤液中Cu2+的浓度[12],由下式(1)计算吸附剂吸附量。
Q=(C0—C)V/W
(1)
式中:Q:单位吸附量,mg/g;
C0:吸附前溶液中Cu2+的初始质量浓度,mg/L;
C:吸附后溶液中Cu2+的质量浓度,mg/L;
V:金属离子溶液体积,L;
W:吸附剂的用量,g。
2.2 Cu2+初始质量浓度对吸附量的影响
称取0.1 g GCXCS加入50 mL Cu2+模拟废液,调节Cu2+模拟废液质量浓度分别为1,3,5,7,9 mg/L,使用加热磁力搅拌器25 ℃ 搅拌吸附2 h,抽滤,抽滤结束后使用原子吸收分光光度计测定滤液中Cu2+的浓度[13],由公式(1)计算吸附剂吸附量。
2.3 吸附温度对吸附量的影响
称取0.1 g GCXCS加入50 mL 2 mg/L Cu2+模拟废液,调节温度分别为25,35,45,55 ℃,使用加热磁力搅拌器在pH值为6条件下搅拌吸附2 h,等待反应结束后进行抽滤处理,抽滤结束后使用原子吸收分光光度计测定滤液中Cu2+的浓度[14-15],由公式(1)计算两种吸附剂吸附量。
2.4 吸附剂的循环吸附性能
称取吸附过Cu2+的GCXCS 0.1 g,加入100 mL 0.2 mol/L的HCl溶液,使用恒温振荡器加热至40 ℃,震荡反应12 h,等待反应结束后进行抽滤,用蒸馏水洗涤四次,然后加入0.4 mol/L氢氧化钠水溶液,再次使用恒温振荡器加热至40 ℃,震荡反应4 h,反应结束后抽滤,将滤渣用蒸馏水清洗至中性,之后再次进行抽滤,滤渣60 ℃烘干,得到再生吸附剂GCXGS。重复在25 ℃、Cu2+初始质量浓度为2 mg/L、pH值为6、搅拌吸附时间为2 h的条件下,对再生吸附剂GCXCS进行Cu2+吸附实验。将上述再生、吸附实验重复进行三次,研究分析吸附剂GCXCS的循环吸附性能。吸附量由公式(1)计算。
3 结果与分析
3.1 改性壳聚糖的扫描电镜分析
为了深入了解吸附剂的吸附性能,并且更好地观察样品改性前后的样貌结构,用SEM对吸附剂进行了表征,并在放大倍数为4 000倍的扫描电镜下进行了观察和分析。图1分别为CS(A)、GCXCS(B)、GCXCS吸附Cu2+后(C)的扫描电镜照片。由照片(A)可知,壳聚糖表面均匀且光滑。相比之下,GCXCS(B)的表面结构更为粗糙疏松,且表面出现大量沟壑和众多孔洞,这是因为戊二醛作为交联剂使原本为线形高分子结构的壳聚糖变为网状高分子结构,增大了它的比表面积,从而使壳聚糖上氨基的利用率增大[16-17],所以大量孔洞的出现表明经交联改性后的壳聚糖更有利于其对金属离子吸附。对比(B)和(C)可以看出,GCXCS表面覆盖有大量明显的细小碎片,说明GCXCS有效并均匀地吸附了Cu2+。

图1 CS和GCXCS的扫描电镜图
3.2 Cu2+初始pH值对GCXCS吸附量的影响
图 2为不同Cu2+初始pH值对吸附剂GCXCS吸附量的影响趋势图,吸附条件为25 ℃,搅拌反应2 h,吸附Cu2+模拟废液浓度为2 mg/L。由图可知,随着 pH值的增大吸附剂GCXCS对废液中Cu2+的吸附量逐渐升高。这是因为当 pH值较低时,溶液中存在大量的H+,H+会先与GCXCS中的-NH2发生质子化,从而使其变为-NH3+,故GCXCS中-NH2的数量变少,-NH2数量的减少致使Cu2+与 -NH2和-OH-的螯合能力降低,所以pH值较低时吸附能力较低。当pH值升高后,溶液中H+的数量减少,-OH-的数量增加,GCXCS中的-NH2被质子化的现象降低,-NH2的数量增多,有利于促进 Cu2+与其形成螯合物,所以吸附量也随之增加。同时,OH- 的增多,有利于Cu2+与其结合生成氢氧化铜絮凝到壳聚糖粒子的孔隙中,也会对Cu2+起到一定的吸附作用。当pH值为6时,GCXCS的吸附量最高为0.967 5 mg/g,因此GCXCS的最佳吸附pH值为6。

图2 pH值对GCXCS吸附量的影响
3.3 Cu2+初始质量浓度对GCXCS吸附量的影响
在25 ℃,吸附时间为2 h,吸附pH值为6的条件下,图3展示了不同Cu2+初始质量浓度对吸附量的影响趋势。由图可知,吸附剂GCXCS对Cu2+的吸附量随着Cu2+初始质量浓度的增大而逐渐增加,但当Cu2+初始浓度超过7 mg/L时,增长速度变缓。这是因为当Cu2+浓度较小时,由于吸附剂的质量一定,吸附剂上活性位点的数量也一定,此时吸附剂上的活性位点足够多,可以完全满足其对Cu2+的吸附,因此吸附量会随Cu2+浓度的增大而增加。但当溶液中Cu2+浓度过高时,因大多数活性点位都达到饱和状态,可吸附Cu2+的活性位点的数量逐渐变少,所以吸附剂对Cu2+的吸附效率就会随之减缓,这一现象限制了吸附量的增加。当Cu2+模拟废液质量浓度为7 mg/L时,GCXCS吸附效率最高为3.071 5 mg/g,因此GCXCS的最佳吸附浓度为7 mg/L。

图3 Cu2+初始质量浓度对GCXCS吸附量的影响
3.4 吸附温度对GCXCS吸附量的影响
在吸附时间为2 h,吸附pH值为6,吸附Cu2+模拟废液质量浓度为2 mg/L的情况下,以不同吸附温度进行实验,得到了如图4所示的变化趋势图,展示了不同吸附温度对吸附量的影响趋势。由图4可以看出,GCXCS的吸附量随着温度上升而减少,这可能是由于吸附为放热反应,高温不利于吸附[18]。据此推断,该吸附剂的最佳吸附温度为25 ℃。
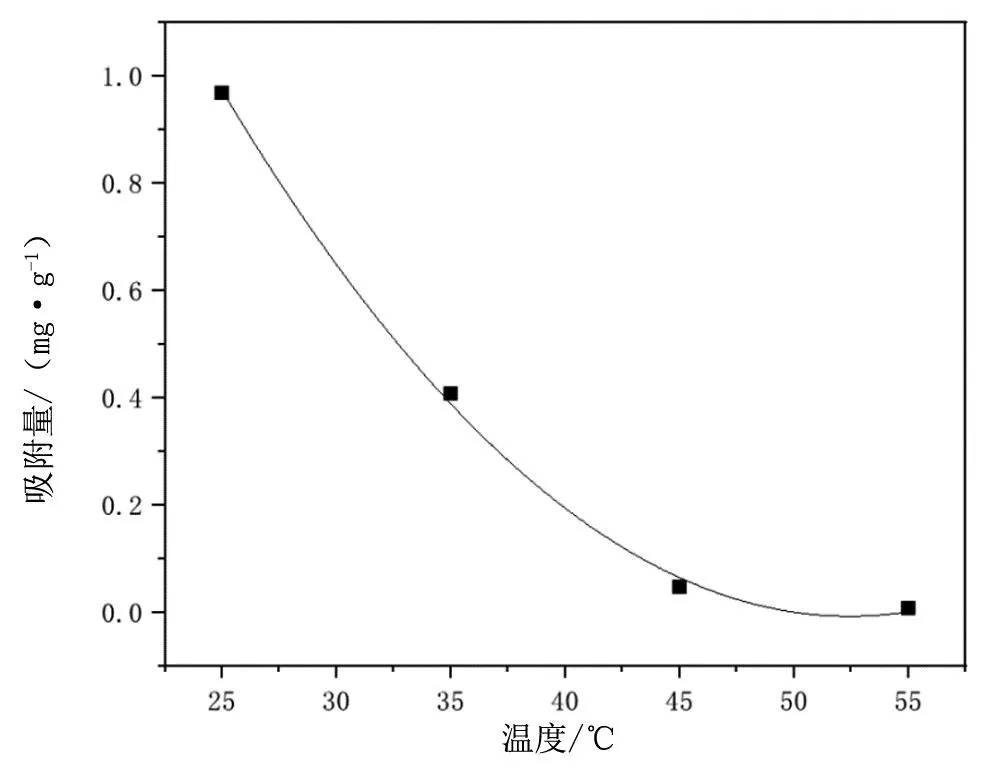
图4 吸附温度对GCXCS吸附量的影响
3.5 吸附剂的循环吸附性能
实验结果显示,经再生过的GCXCS外观仍为淡黄色,无明显变化。由图5知,再生吸附剂GCXCS的吸附量随再生次数的增加而减少,但仍具有吸附效果。这可能是因为HCl溶液仅能洗脱吸附剂表面的离子,而无法洗脱内部的一些少量离子。当再生次数为1时吸附量最大,再生次数为2~3时,吸附量有所减少但减少不多,仍具有吸附效果。所以吸附剂GCXCS具有比较好的再生吸附性能。
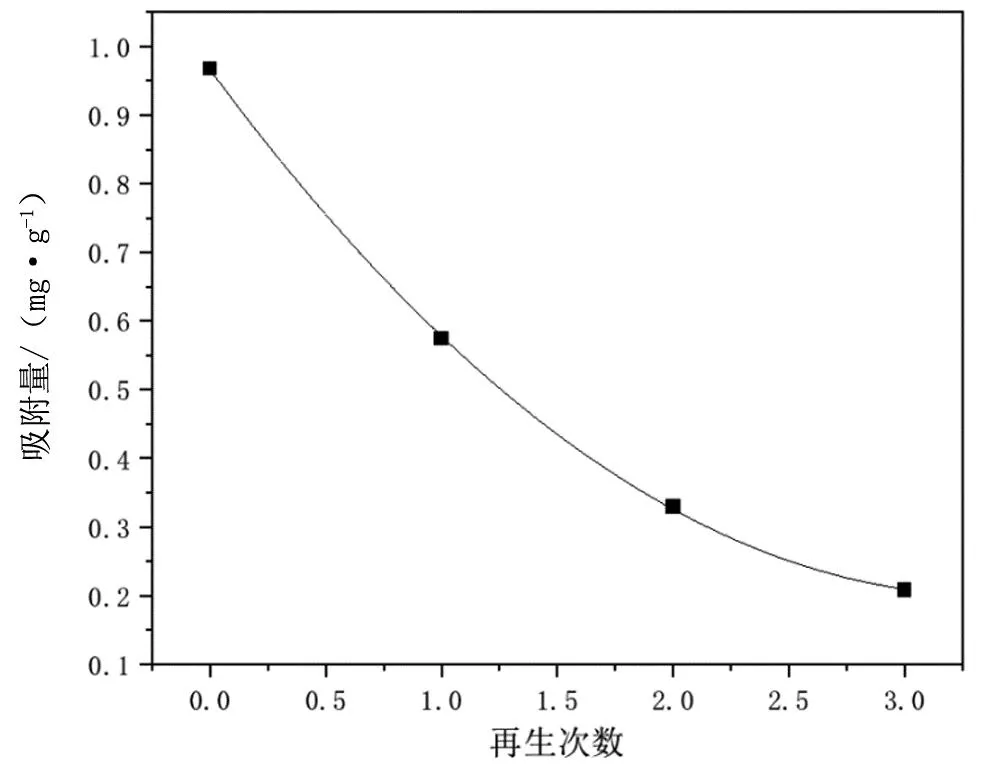
图5 GCXCS的循环吸附性能
4 结论
以戊二醛为交联剂,二硫化碳黄原酸化法对壳聚糖(CS)进行了化学改性制备出戊二醛交联黄原酸化壳聚糖(GCXCS),并分析了吸附剂对Cu2+的吸附效果。分别从pH值、Cu2+初始质量浓度、温度、循环吸附性能四个方面对改性吸附剂进行吸附试验。实验结果表明,吸附剂GCXCS的最佳吸附条件为25 ℃,pH值为6,Cu2+初始质量浓度7 mg/L。
