禽腺病毒4型fiber-2与8b型fiber截短融合蛋白的原核表达及其免疫原性分析
2024-01-10迟丽丽王君娜张宇名陈志远李树凡尹燕博徐守振
迟丽丽,王君娜,张宇名,刘 健,陈志远,李树凡,尹燕博,徐守振
(青岛农业大学动物医学院,青岛 266109)
禽腺病毒(fowl adenovirus, FAdV)分为5个种(A~E),12个血清型[1]。临床上与FAdV感染相关的主要是FAdV-4引起的心包积液综合征(HPS)及FAdV-8b引起的包涵体肝炎(IBH),给我国养禽业造成了巨大的经济损失[2-4]。纤突蛋白(Fiber)是FAdV的主要结构蛋白,能够编码中和抗原表位,参与体液免疫,使动物产生中和抗体[5-7]。其中,FAdV-4有两个Fiber(Fiber1和Fiber2),FAdV-8b只有一个Fiber[8-10]。Gupta等[11]研究表明重组fiber蛋白临床保护率可达到82.7%,能够很好地阻止包涵体肝炎的发生,对预防由FAdV-8b引起的包涵体肝炎具有很好的防制效果。Luca等[9]研究表明FAdV-8b的Fiber蛋白免疫后对子代有一定的保护效果。研究证实重组fiber2蛋白作为免疫原对FAdV-4引起的心包积液综合征的防控具有很好的效果[12-14],可作为FAdV亚单位疫苗的候选蛋白,具有很好的应用前景。我们前期将制备的FAdV-4和FAdV-8b单因子血清进行细胞交叉中和试验,结果表明FAdV-4和FAdV-8b的血清不能相互中和[15]。目前,尚未见有关禽腺病毒FAdV-4和FAdV-8b二价亚单位疫苗的研究,研发针对FAdV-4和FAdV-8b的二价疫苗具有重要的应用价值。本研究将FAdV-4 fiber2和FAdV-8b fiber的全长蛋白、截短蛋白及二价融合蛋白成功在大肠杆菌中表达,并对其免疫原性进行了评价,以期为禽腺病毒FAdV-4和FAdV-8b二价亚单位疫苗的研发奠定基础。
1 材料与方法
1.1 主要材料与试剂
1.1.1 主要试剂 Ⅰ群禽腺病毒FAdV-4和FAdV-8b为青岛农业大学预防兽医实验室分离、鉴定并保存;pCold-TF载体,大肠杆菌DH5ɑ、BL21(DE3),FAdV-4和FAdV-8b阳性血清均由青岛农业大学预防兽医实验室保存;T3 Super PCR Mix购自北京擎科生物科技有限公司;T4 DNA连接酶购自TaKaRa公司;His-Tagged蛋白纯化试剂盒购自康为世纪生物科技有限公司;HRP标记兔抗鸡IgG抗体、7号白油、BCA蛋白浓度试剂盒均购自北京索莱宝科技有限公司;反转录试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒购自湖南艾科瑞生物工程有限公司。
1.1.2 实验动物 150枚SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司;SPF雏鸡由SPF鸡胚自行孵化并在负压隔离器中饲养至所需日龄。
1.2 重组表达质粒的构建及鉴定
根据FAdV-4 fiber2和FAdV-8b fiber基因序列设计截短片段(FP和BP)、融合片段(BP-FP)及全长(FL和BL)引物,引物送生工生物工程有限公司合成,引物序列见表1。

表1 FAdV-4 fiber-2和FAdV-8b fiber基因扩增引物Table 1 Primers of FAdV-4 fiber-2 and FAdV-8b fiber gene
以实验室保存的FAdV-4和FAdV-8b毒株的DNA为模板,使用FP、FL、BP、BL引物扩增目的基因,PCR反应程序为95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃终延伸10 min。PCR产物经琼脂糖凝胶回收。使用BP-F和F-Linker引物、Linker-F2和FP-R引物分别进行PCR扩增,PCR产物经琼脂糖凝胶电泳回收后各取1 μL混合当模板,使用BP-F和FP-R引物扩增BP-FP目的基因,PCR反应程序同上,进行琼脂糖凝胶回收。将FP、FL、BP、BL、BP-FP回收产物和pCold-TF空载体用XbaⅠ和Hind Ⅲ双酶切,用T4 DNA连接酶连接纯化回收的酶切产物,转化DH5ɑ感受态细胞,提取转化子质粒,进行酶切验证和测序鉴定。
1.3 重组蛋白的表达及纯化
将测序正确的5个重组质粒转化BL21(DE3)感受态细胞,涂布于氨苄抗性的LB平板,37 ℃过夜培养。挑单菌落接种于氨苄抗性的LB培养基中,37 ℃、220 r·min-1培养至OD600 nm为0.6左右,加入1 mol·L-1的IPTG,16 ℃诱导表达12 h。收集表达后的菌体沉淀,冰浴超声破碎菌体,12 000 r·min-1离心5 min,SDS-PAGE分析蛋白表达情况。超声破碎后菌体上清按照His-Tagged蛋白纯化试剂盒说明书进行目的蛋白纯化。
1.4 重组蛋白的Western blot鉴定
纯化后的蛋白经SDS-PAGE电泳后湿转至PVDF膜,使用FAdV-4和FAdV-8b阳性血清为一抗,HRP标记兔抗鸡IgG抗体为二抗,对纯化蛋白进行Western blot鉴定,用ECL化学发光后,凝胶成像系统观察并拍照。
1.5 重组蛋白免疫效果评价
1.5.1 动物分组及处理 将纯化后的蛋白与油相1∶2混合。108只1日龄SPF鸡随机分成9组。1~6组(FL、FP、BP-FP4、BP-FP8b、BL、BP)为免疫组,7日龄皮下注射疫苗100 μg·只-1,14日龄进行二免;7~8组(C4、C8b)为攻毒对照组,9组(C)为空白对照组。二免后7 d,FL、FP、BP-FP4、C4组肌肉注射FAdV-4(107.5TCID50·mL-1),BL、BP、BP-FP8b、C8b组肌肉注射FAdV-8b(107.5TCID50·mL-1),攻毒剂量为0.2 mL·只-1。在免疫前,免疫后7、14、21 d心脏采血并分离血清;攻毒后3、7 d采集攻FAdV-8b组的泄殖腔拭子;攻毒后7 d采集各组鸡肝脏样品。
1.5.2 抗体水平检测 用间接ELISA进行抗体水平检测,采用浓度为1 μg·mL-1的BP-FP蛋白包被过夜,用1% BSA 37 ℃封闭1 h,洗后加入1∶1 000稀释的血清37 ℃孵育1 h,洗后加入1∶5 000稀释的兔抗鸡 IgG-HRP 37 ℃孵育1 h,洗后加入显色液避光孵育30 min,终止显色后读取OD450 nm值。
1.5.3 免疫攻毒保护 攻毒后每天观察鸡的健康状况,记录死亡数量,计算存活率。
1.5.4 排毒量检测 所有攻FAdV-8b的鸡在攻毒3、7 d后取泄殖腔拭子置于含有抗生素的无菌生理盐水中,提取DNA,经qPCR检测排毒量。根据FAdV-8b Hexon基因与其它血清型禽腺病毒差异显著的保守区域设计引物,引物序列为F 5′-CTACGGCAACAGCTGGGGCAA-3′;R 5′-TGTGCAGTGGTGTCTAAC-3′,引物由生工生物工程(上海)股份有限公司合成。反应体系:模板1 μL,上、下游引物各0.4 μL,2×SYBR Mix 10 μL,加水至20 μL。反应程序:95 ℃预变性30 s;95 ℃5 s,60 ℃30 s,40个循环;熔解曲线反应条件为95 ℃10 s,65 ℃ 60 s,97 ℃1 s。每个样本设3个重复。按照公式拷贝数(拷贝·μL-1)=6.02×1023(拷贝·mol-1)×质粒浓度(ng·μL-1)×10-9/[(载体分子量+插入片段分子量)×660](g·mol-1)绘制标准曲线。
1.5.5 细胞因子mRNA表达水平检测 根据文献[16-17]合成IL-4、TNF-α、IFN-γ和内参基因β-actin引物。取攻毒7 d后所有鸡的肝脏进行研磨,提取RNA,经RT-PCR反转录成cDNA,以β-actin作为内参基因经qPCR检测IL-4、IFN-γ和TNF-α mRNA表达水平。qPCR反应程序同“1.5.4”。
1.6 数据分析
抗体水平、排毒量及细胞因子mRNA表达水平检测数据均用Prism 5.0软件进行统计分析,使用t检验法进行差异性显著分析,P<0.05代表差异显著。
2 结 果
2.1 重组表达载体的构建及鉴定
如图1所示,重组质粒经双酶切后,均出现载体片段和目的片段,FL、FP、BP-FP、BL和BP基因大小与预期一致,表明原核重组质粒构建成功。经测序进一步确定重组表达质粒构建成功。
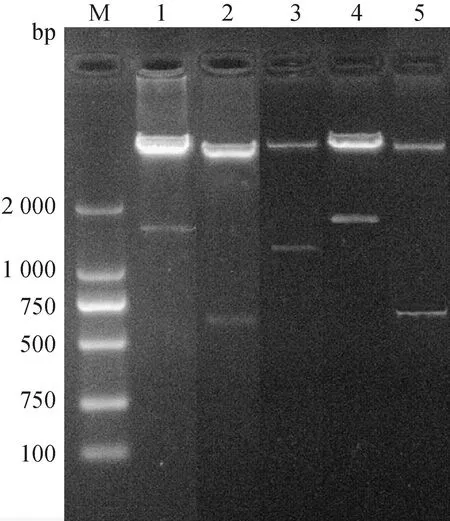
M.相对分子质量标准;1.FL;2.FP;3.BP-FP;4.BL;5. BPM. Standard molecular weight; 1.FL; 2.FP; 3.BP-FP; 4.BL; 5.BP图1 重组表达质粒的双酶切鉴定Fig.1 Results of double digestion of recombinant expression plasmids
2.2 重组蛋白的表达及纯化
经SDS-PAGE检测,结果如图2A所示,成功表达出大小为104.9、70.6、92.3、100.3 和69.2 ku的重组蛋白,且均在上清中以可溶性形式表达。将BP-FP、BL、BP、FL 和FP蛋白上清用蛋白纯化试剂盒纯化,纯化后的蛋白样品进行SDS-PAGE分析(图2B)。
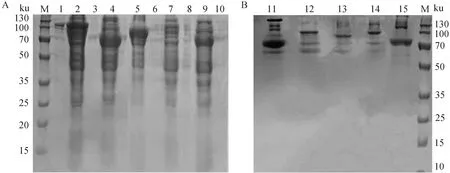
M.标准分子质量;1.BL沉淀;2.BL上清;3.BP沉淀;4.BP上清;5.BP-FP上清;6.BP-FP沉淀;7.FL上清;8.FL沉淀;9.FP上清;10.FP沉淀;11.FP;12.FL;13.BP-FP;14.BL;15.BPM. Standard molecular weight; 1.BL precipitation; 2.BL supernatant; 3.BP precipitation; 4.BP supernatant; 5.BP-FP supernatant; 6.BP-FP precipitation; 7.FL supernatant; 8.FL precipitation; 9.FP supernatant; 10.FP precipitation; 11.FP; 12.FL; 13.BP-FP; 14.BL; 15.BP图2 各样品中重组蛋白(A)及其纯化后(B)的 SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinant proteins in each sample (A) and their purified proteins (B)
2.3 重组蛋白的Western blot鉴定
重组蛋白Western blot鉴定结果如图3,FP、FL、BP-FP、BP、BL蛋白条带大小分别为69.2、100.3、92.3、70.6、104.9 ku,与预期大小一致,表明重组蛋白在原核系统中成功表达。

A.FAdV-4阳性血清作一抗;B.FAdV-8b阳性血清作一抗;M.标准分子质量;A1~A3.FP、FL和BP-FP;B1~B3.BP、BL和BP-FPA. FAdV-4 positive serum as primary antibody; B. FAdV-8b positive serum as primary antibody;M.Standard molecular weight; A1-A3.FP, FL, and BP-FP; B1-B3.BP, BL, and BP-FP图3 重组蛋白的Western blotFig.3 Western blot of recombine protein
2.4 重组蛋白免疫效果评价
2.4.1 抗体水平检测 ELISA抗体检测结果如图4所示,BL、FL、BP-FP、BP和FP组在免疫后7~14 d各组抗体均呈上升趋势,免疫后14~21 d抗体水平没有明显变化,免疫组抗体水平显著高于阴性对照组(P<0.05),但免疫组抗体水平无显著差异(P>0.05)。
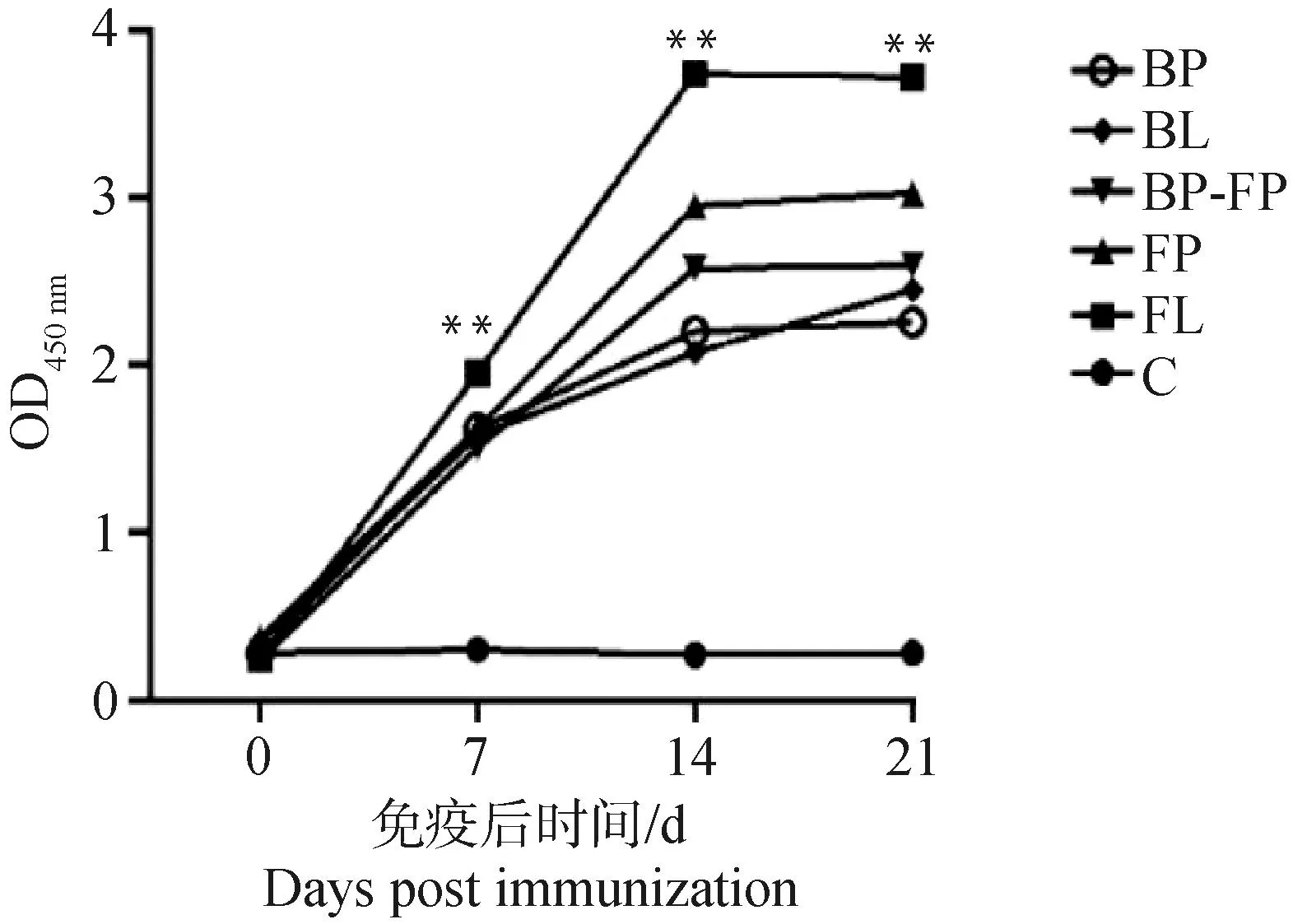
“**”表示差异显著,无标注表示差异不显著。下同“**”means significant difference, and no mark means insignificant difference. The same as below图4 鸡免疫后血清抗体水平Fig.4 Serum antibody levels of chickens after immunization
2.4.2 免疫攻毒保护 攻毒后各组SPF鸡的存活情况如图5所示,C4组存活率为25%,BP-FP4组存活率为58.3%,其它组鸡存活率均为100%。

图5 攻毒7 d后鸡存活率Fig.5 Survival rate of chickens at 7 d post-challenge
2.4.3 排毒量测定 以log(X)为X轴,Ct值为Y轴绘制标准曲线,结果如图6,标准曲线为y=-2.956 1x+38.826,R2=0.99。
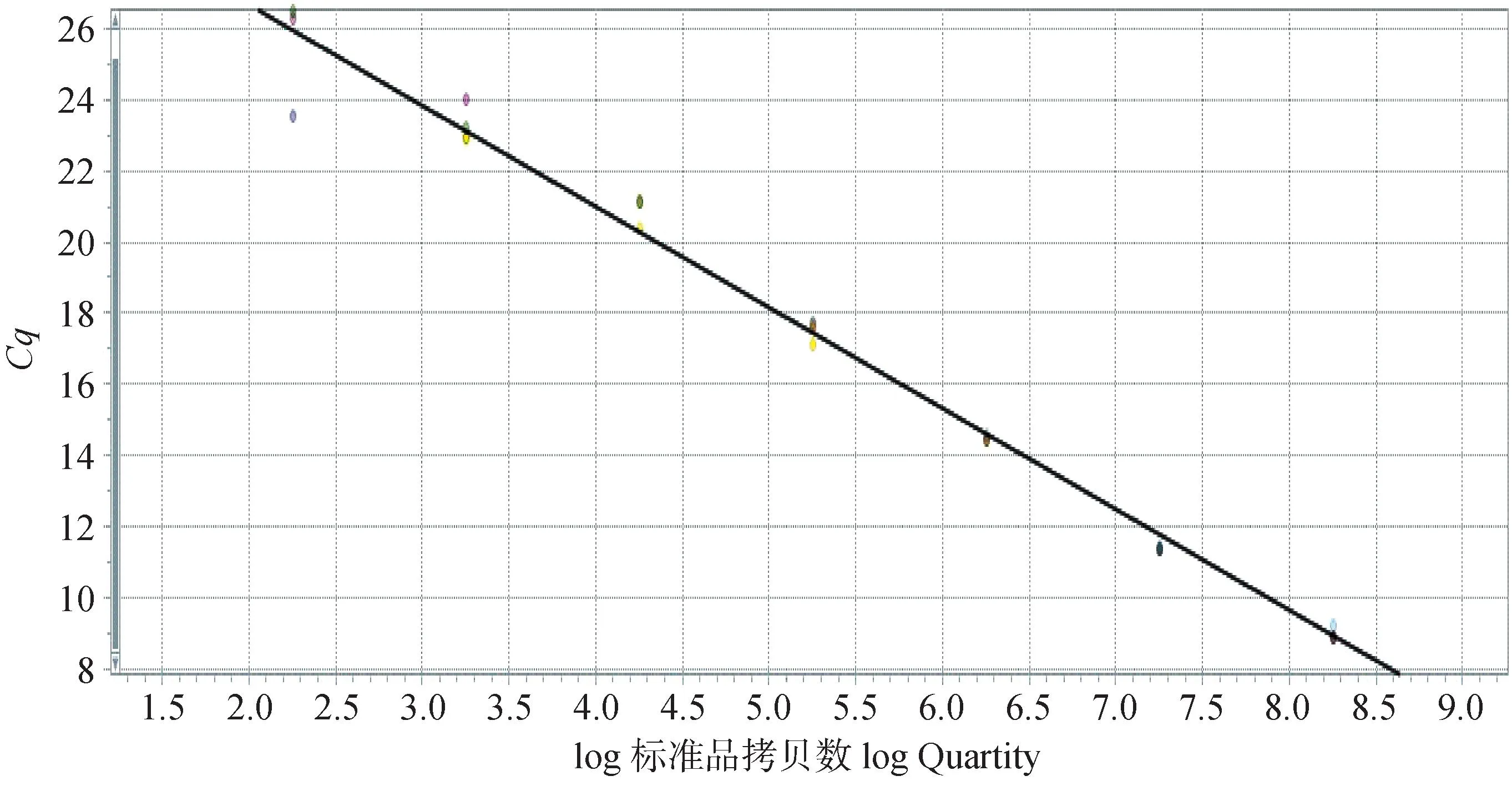
图6 FAdV-8b实时荧光定量PCR标准曲线Fig.6 The standard curve for Real-time PCR of FAdV-8b
排毒量检测结果如图7,在攻毒3、7 d后,C8b组排毒量分别为9.48×105和3.24×107拷贝·μL-1, BL、BP和 BP-FP8b 组排毒量显著低于C8b组(P<0.05)。攻毒后7 d BL和BP组排毒量分别为6.4×105和1.1×106拷贝·μL-1,显著低于BP-FP8b组(P<0.05),BP与BL组之间差异不显著(P>0.05)。

图7 FAdV-8b攻毒后泄殖腔拭子排毒量Fig.7 Viral loads of cloacal swabs challenged with FAdV-8b
2.4.4 细胞因子mRNA表达水平测定 qPCR检测肝脏中IL-4、IFN-γ和TNF-α mRNA表达水平,结果如图8。免疫组细胞因子mRNA表达水平均显著高于阴性对照组(P<0.05),FP组IL-4和IFN-γ mRNA表达水平分别为5.7和8.5,显著高于FL组(P<0.05);BP组IL-4 mRNA表达水平为10.4,显著高于BL组(P<0.05);BL组和BP组TNF-α mRNA表达水平分别为5.73和4.45,二者差异不显著(P>0.05)。

A~C.不同免疫组FAdV-4攻毒;D~F.不同免疫组FAdV-8b攻毒A-C. Different immune groups post FAdV-4 challenge; D-F. Different immune groups post FAdV-8b challenge图8 各免疫组攻毒后细胞因子mRNA表达水平Fig.8 mRNA expression level of cytokines in different immune groups post challenge
2.4.5 肝脏组织病理观察 肝脏病理组织切片如图9所示,C4组肝细胞严重充血、水肿,肝细胞空泡变性、坏死,存在嗜碱性包涵体和严重的炎性细胞浸润,C8b组肝细胞中存在包涵体和大量空泡变性。C组无病变。FL组与BL组未见明显空泡变性,无炎性灶。FP组与BP组有轻微炎性细胞浸润。BP-FP4与BP-FP8b组肝细胞能观察到轻微空泡变性。
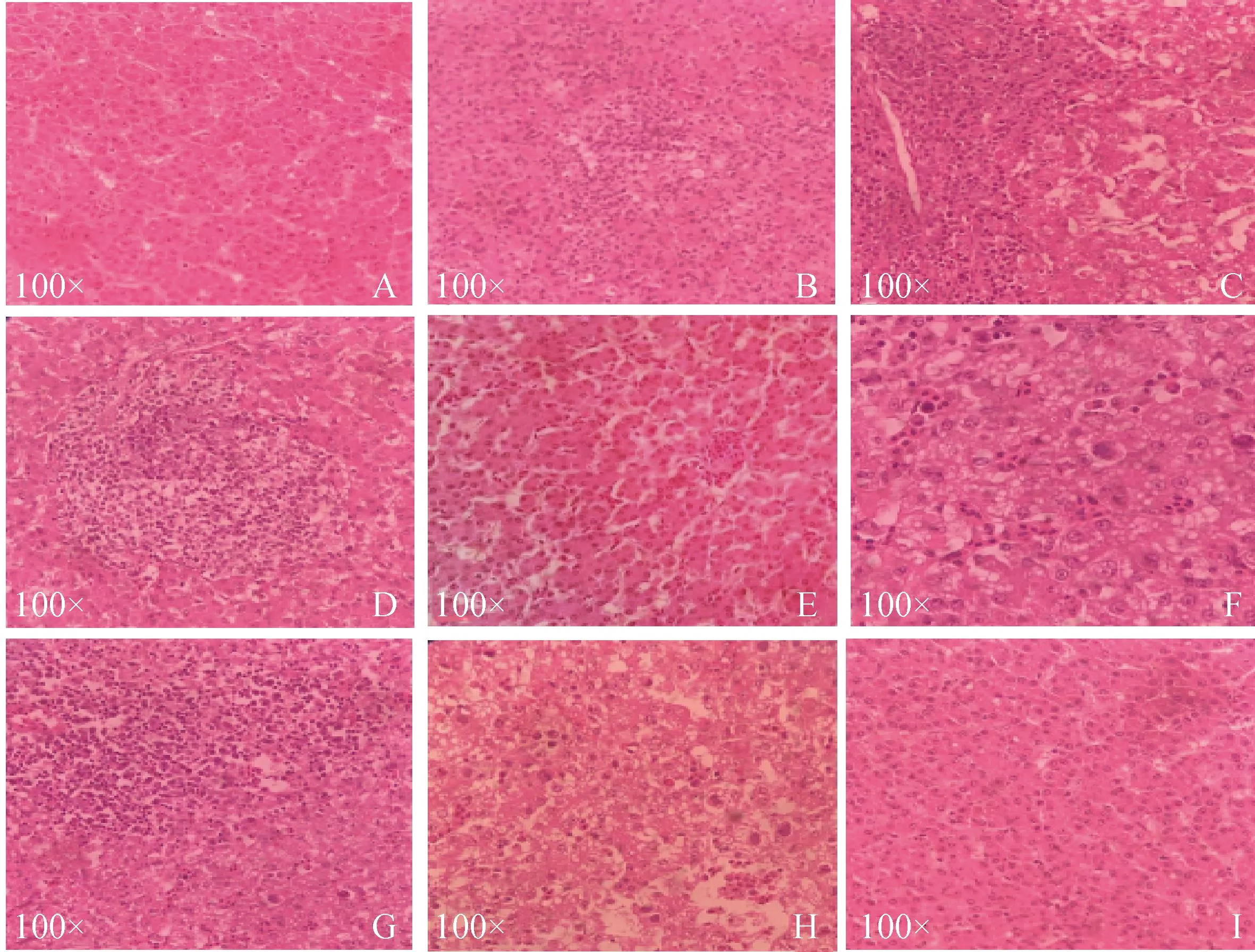
A.FL组;B.FP组;C.BP-FP4组;D:BL组;E.BP组;F.BP-FP8b组;G.C4组;H.C8b组;I.C组A. FL group; B. FP group; C. BP-FP4 group; D: BL group; E. BP group; F. BP-FP8b group; G. C4 group; H. C8b group; I. C group图9 肝组织病理观察(100×)Fig.9 Histopathological observation in liver (100×)
3 讨 论
近年来,由FAdV-4引起的HPS和FAdV-8b引起的IBH在肉鸡中有流行暴发趋势[18-21],给养禽业带来了巨大的经济损失。不同血清型FAdV混合感染的情况在养殖场普遍存在。疫苗是防控疫病的有效手段之一,目前我国还未有同时防控HPS和IBH的商品化疫苗,研制防控FAdV-4和FAdV-8b的二价疫苗具有重要意义[22-24]。
本研究通过软件分析得到FAdV-4 fiber2和FAdV-8b fiber亲水性和抗原性较好的区域位于后半段,与knob-s区域所在位置一致。因此选取了fiber2基因片段850~1 440 bp和fiber基因片段937~1 566 bp,并通过(GGGGS)315个氨基酸的linker串联表达。5种重组蛋白均能在上清液中稳定可溶表达,避免了包涵体复性对蛋白结构的影响。BP和FP的表达量明显高于BL和FL,表明截短的蛋白比全长蛋白更易表达,这可能与所选基因片段的长度有关,这些结果与Fingerut等[25]研究结果一致。本研究基于大肠杆菌表达的FL、FP、BP-FP、BL、BP 5个蛋白制备了亚单位疫苗,攻毒免疫保护显示,除BP-FP4组存活率为58.3%,其它组存活率均为100%;肝脏病理切片观察发现,攻毒组肝脏病变最严重,FP组与BP组次之,FL组与BL组无明显病变,表明截短蛋白和全长蛋白免疫保护效果优于二价融合蛋白。FAdV-8b泄殖腔拭子排毒量结果显示,BP-FP8b排毒量显著高于BL和BP,但仍显著低于FAdV-8b攻毒对照组,表明BP-FP重组蛋白的保护效果弱于单价蛋白。BP-FP4组的存活率为58.3%,低于单价蛋白,但高于对照组,表明BP-FP重组蛋白可诱导一定程度的免疫保护。
间接ELISA法检测重组蛋白免疫后鸡的抗体水平,具有特异性强、灵敏度高、重复性好等优点[26-27]。5种重组蛋白均能有效诱导体液免疫反应,仅经过首免即可获得较高水平的抗体,具有良好的免疫原性。与对照组相比,5种重组蛋白抗体水平均显著升高,免疫组在受免后14 d血清抗体水平下降,与第二次免疫后抗体水平相似。抗体水平达到峰值后,依次为FL>FP>BP-FP>BL>BP, BL组与BP组差异不显著。由此可见,全长蛋白刺激SPF鸡产生抗体的能力优于截短蛋白,这可能与全长蛋白具有其他重要的表位有关。Th1细胞主要分泌IFN-γ和TNF-ɑ等细胞因子,参与调节细胞免疫,介导细胞免疫应答;Th2细胞主要分泌IL-4和IL-10,可以激活B细胞,促进中和抗体的产生[28-29]。研究表明,FAdV-4灭活苗可刺激动物机体产生较高水平的IL-4和IFN-γ且显著高于阴性对照组[30]。本研究结果显示,免疫组均显著高于阴性对照组,表明全长蛋白、截短蛋白和二价融合蛋白均能诱导产生细胞免疫,FP组IL-4和IFN-γ mRNA表达水平显著高于FL组,表明FP蛋白刺激机体产生IL-4和IFN-γ的水平高于FL蛋白。
4 结 论
FAdV-4 fiber2和FAdV-8b fiber截短蛋白和全长蛋白免疫保护效果优于二价融合蛋白,截短蛋白可替代全长蛋白用于禽腺病毒亚单位疫苗的制备。
