肠道菌群抗病毒机制研究进展
2024-01-10宫浩阳吴佳鑫杨晓钰解伟纯王雪莹李佳璇姜艳平李一经唐丽杰
宫浩阳,吴佳鑫,杨晓钰,解伟纯,王雪莹,李佳璇,2,姜艳平,2,崔 文,2,李一经,2,唐丽杰,2*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.农业部动物疫病病原生物学重点实验室东北科学观测实验站,哈尔滨 150030)
人和动物肠道寄居有数以亿计的微生物,种类多达500~1 000种,包括细菌、病毒、古生菌和真菌,其中绝大多数是细菌,这些肠道微生物与宿主互利共生,共同组建了肠道的微生态系统[1]。人和动物肠道微生物的作用主要有:参与胃肠道中物质的分解及转化,促进免疫系统的成熟和免疫功能的发挥以及保护机体免受病原的感染。例如,肠道菌群中的益生菌具有维持胃肠道健康,并且对急性腹泻、便秘和抗生素相关腹泻具有积极的调节作用[2]。机体肠道菌群最初的来源是母体,随着机体的不断发育肠道中的菌群逐渐趋于稳定,但也会存在个体间的差异。肠道菌群易受外界环境等因素影响造成菌群失调,导致相关疾病的发生。随着人类的社会活动的增加,病毒感染对于全球的公共卫生事业也造成了巨大的威胁,相关病原体包括严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)、人类免疫缺陷病毒(human immunodeficiency virus, HIV)、脊髓灰质炎病毒、轮状病毒、流感病毒、诺如病毒等,这些病毒能够对人和动物的健康以及经济造成巨大的损失。不同机体对病毒入侵的耐受性与其肠道菌群组成有着密切的联系,肠道菌对病毒的抑制作用主要体现在以下几个方面:肠道菌群可以维持肠黏膜屏障;肠道菌群与病原产生直接作用,可以抑制病原体的感染;肠道菌群通过对机体免疫系统的影响以干扰病毒感染宿主;通过肠道菌群代谢物或产生有益物质起到抗病毒作用。本文对肠道菌群抗病毒感染机制进行综述,以期为预防和治疗病毒性疾病提供参考。
1 肠道菌群对肠黏膜屏障的调控
胃肠道黏膜屏障是宿主内部与外界直接沟通的“门户”,在宿主免疫调节、营养代谢和抵御病原菌的侵入等方面发挥着积极的作用。当皮肤和黏膜屏障无法阻挡病毒入侵,进入宿主体内入侵宿主细胞时,宿主细胞的遗传系统就会成为病毒进行自我复制的工具,而后进行组装,最终产生致病作用[3]。
肠道上皮细胞(intestinal epithelial cells, IECs)是动物机体与外界沟通的媒介,其能够在机体免疫系统和外部环境之间构建一个抵御病原微生物入侵的物理屏障,正因为有这个屏障,机体才能井然有序的与外界进行物质交换,IECs的完整性和功能性至关重要,尤其决定着营养物质的消化吸收,并且可以阻止病原微生物等有害物质入侵。肠黏膜屏障功能的发挥离不开紧密连接蛋白的作用,紧密连接蛋白主要由咬合蛋白(occludin)、闭合蛋白(claudins)、闭锁小带蛋白(zonula occludens, ZOs)组成[4],这三种蛋白决定着肠上皮细胞的通透性和选择性,并且共同维系着上皮屏障功能的发挥[5]。所谓“肠漏”,就是紧密连接蛋白受损或者其表达及定位发生改变,从而损害这种由紧密连接蛋白组成的物理屏障,就可能会出现“肠漏”[6]。当出现“肠漏”时,上皮细胞对小分子物质的通透性增加,如果这些外界的物质渗透到固有层,就会诱发炎症性肠病、肠易激综合征和乳糜泻等,这些病理状态导致持续的炎症和组织损伤[7]。肠道菌通过对上皮细胞紧密连接蛋白的表达或定位产生影响来增强肠黏膜屏障[8],通过调节IRF3和NF-κB信号通路来维持紧密连接蛋白功能,起到增强肠黏膜功能的作用(图1A)。例如,鼠李糖乳酪杆菌GG(Lactobacillusrhamnosus,LGG)可以改善由轮状病毒(rotavirus,RV)感染引起的仔猪腹泻情况,提高空肠绒毛及空肠绒毛和隐窝深度比、空肠总超氧化物歧化酶活力,增强空肠的抗氧化能力,此外,还可以提高肠道中IL-4和分泌型IgA(secretory IgA,sIgA)以及闭锁小带蛋白-1(zonula occludens-1,ZO-1) 、occludin、黏蛋白1(mucin-1)和黏蛋白4(mucin-4)的表达水平。因此,LGG可能通过维护空肠黏膜屏障功能来缓解RV感染引起的腹泻,其机制可能是通过活化Akt(也称蛋白激酶B,protein kinase B)从而抑制IL-38α、TNF-α以及MPK-1诱导的肠上皮细胞凋亡;LGG的代谢产物色氨酸可以激活孕烷X受体(pregnane X receptor,PXR)和芳烃受体,而PXR可以通过抑制N端蛋白激酶( c-Jun N-terminal kinase,JNK)的磷酸化来促进紧密连接蛋白表达[9-11]。当给由葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠服用尼氏大肠杆菌(EscherichiacoliNissle,EcN)后并且分离小肠上皮细胞,观察ZO-1和ZO-2的基因和蛋白质表达发现,与对照组相比EcN能够上调小鼠肠上皮细胞中的ZO-1表达,可见EcN可以通过上调ZO-1的mRNA的表达来维持黏膜的通透性,以缓解结肠炎引起的肠黏膜损伤[12]。Madsen等[13]的研究表明,当给IL-10基因缺陷小鼠口服复合益生菌VSL#3时发现,可以恢复小鼠因基因缺陷而受损的结肠屏障功能,维持上皮细胞的完整性。Thoreux等[14]在给小鼠感染RV后服用干酪乳杆菌发现可以减轻腹泻程度,肠组织中的RV载量明显降低,表明益生菌可以减轻病毒对肠道的损伤。Freitas等[15]发现拟杆菌属的多形拟杆菌可以和干酪乳杆菌DN114001生成一种可溶性复合物,这种复合物可以通过对细胞糖基化模式的位点进行调节来保护感染RV的肠上皮细胞。
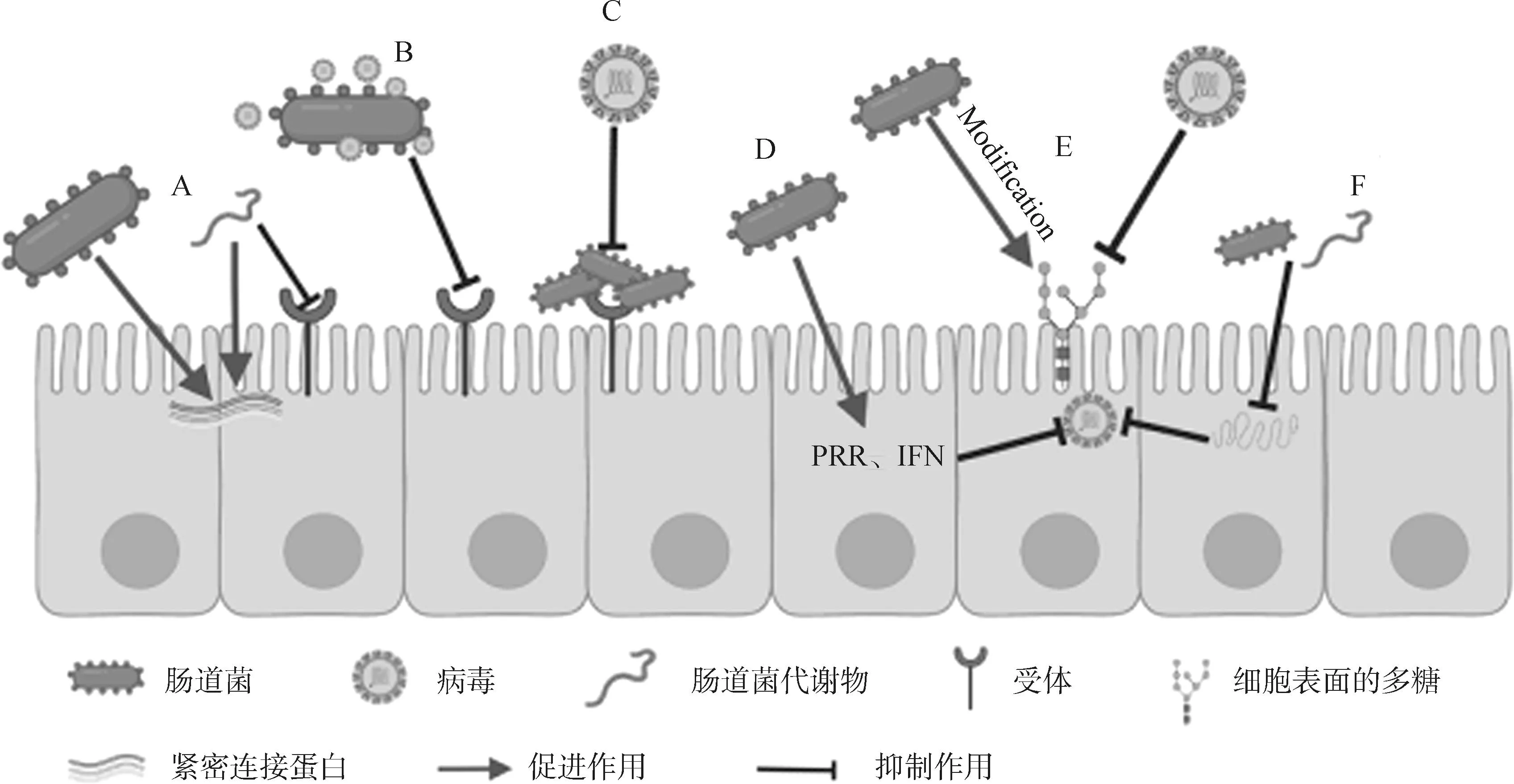
A. 肠道菌或其代谢产物维护紧密连接蛋白以及代谢物屏蔽病毒受体;B. 肠道菌与病毒相互作用抑制感染;C. 肠道菌屏蔽病毒受体;D. 肠道菌调节免疫系统抑制病毒感染;E. 肠道菌修饰细胞表面多糖抑制病毒感染;F. 肠道菌或其代谢物抑制病毒复制A. Intestinal bacteria or their metabolites maintain tight junction proteins and metabolites shield virus receptors; B. The interaction between intestinal bacteria and virus inhibits infection; C. Intestinal bacteria screen virus receptors; D. Intestinal bacteria regulate immune system and inhibit virus infection; E. Intestinal bacteria modify cell surface polysaccharides to inhibit virus infection; F. Intestinal bacteria or their metabolites inhibit virus replication.图1 肠道菌群抗病毒机制Fig.1 Antivirus mechanism of intestinal microflora
肠黏液层是覆盖在肠上皮细胞上的一层黏性液体,能够对入侵的病原微生物起到很好的抵御作用,是除肠上皮细胞外的另一屏障[16]。肠黏液层的黏液主要由杯状细胞分泌,其主要成分为黏蛋白,分为分泌型和跨膜型两种黏蛋白,前者主要负责黏液层的形成,后者的功能尚不清楚。肠道菌能够通过对黏蛋白表达的调节而影响黏液层屏障,进而间接影响机体的免疫系统。Engevik等[17]发现双歧杆菌可调节黏液合成,并通过刺激杯状细胞自噬来上调MUC2的分泌。Rokana等[18]的研究表明益生菌可与肠细胞表面的TLR4结合,通过MyD88途径刺激NF-κB产生,从而上调MUC2的表达。
2 肠道菌可以直接与病毒相互作用来抑制病毒感染
有些肠道菌可以通过阻止病毒与宿主细胞吸附的方式来保护机体,从而减轻病毒对机体的侵害。其机制是肠道菌可以通过竞争病毒的结合位点的方法来阻断病毒吸附。肠道菌还可通过立体位阻或者增加细胞间节点的屏蔽作用的方式来阻止病毒对细胞的吸附作用。
猪流感病毒(swine influenza virus,SIV)可以直接被粪肠球菌(Enterococcusfaecalis)NCIMB10415株捕获,与对照组相比,粪肠球菌处理组的病毒滴度降了约2个数量级,且细菌沉淀物中可检测到大量的病毒粒子,证明了粪肠球菌对SIV具有直接捕获的作用(图1B)[19]。枯草芽胞杆菌(Bacillussubtilis)是一种具有良好的抗病毒和免疫调节作用的益生菌。目前的研究证明,BacillussubtilisOKB105通过竞争进入受体来抑制传染性胃肠炎病毒(TGEV)进入猪肠道上皮细胞系(IPEC-J2)(图1C)[20]。但是肠道菌与病毒的直接作用也存在着特异性,例如,格氏乳杆菌(Lactobacillusgasseri)CMUL57株可以捕获有囊膜的单纯疱疹病毒2型(herpes simplex virus type 2,HSV-2),但对无囊膜的柯萨奇病毒(Coxsackie virus,CV)的入侵没有保护作用[21]。
另外,Varyukhina等[22]证明了类杆菌和干酪乳杆菌可以修饰细胞表面的糖蛋白,从而介导RV结合,发现这些细菌及其无细胞上清液在体外通过阻断半乳糖化来修饰HT-29细胞表面的多糖,以增加半乳糖水平和减少RV感染(图1E)。因此,可将细胞表面多糖的细菌修饰作为治疗RV感染的一种方法。这一机制也可能是鼠李糖乳杆菌(Lactobacillusrhamnosus)对RV感染具有保护作用的基础。有研究表明,对患有RV感染相关性腹泻的儿童使用上述细菌显著缩短了腹泻持续时间,并减少了长期腹泻病例。因此,细菌和病毒的相互作用可以阻止或者减轻病毒对机体的感染,但是其具体机制需要更深入地研究[23]。
除上述机制以外,目前已发现多种肠道细菌表达组织血型抗原(histo-blood group antigens, HBGA)样物质,HBGA样物质是许多病毒的受体,如诺沃克病毒和轮状病毒。先前的研究表明,细菌病毒通过类HBGA物质结合促进病毒入侵[24]。在体外对人诺如病毒(human norovirus,HNoV)替代物(P-颗粒)的相关研究表明,HBGA与特定病毒的结合在不同情况下既是病毒感染的抑制者,也是病毒感染的促进者[25]。当HBGA在阴沟肠杆菌定殖的猪中表达时,感染性被抑制,阻断了病毒粒子的附着。试验表明,表达HBGA的益生菌可以通过上述类似的机制来减轻病毒感染[26]。EcN和人轮状病毒(human rotavirus, HRV)[27]也可能通过细菌病毒的相互作用使病毒对细胞的附着产生抑制作用,HRV的细胞附着和HRV脱落也明显减少。因为EcN主要与VP4相互作用,VP4是HRV的主要病毒吸附蛋白。此外,在P-颗粒和HNoV替代物上的试验也表明,在某些情况下,特定的微生物区系可能通过与病毒粒子结合来抑制HNoV的入侵。
3 肠道菌调节免疫系统抑制病毒感染
肠道菌群中的益生菌对免疫系统的调节尤为重要,当病毒穿过皮肤和黏膜屏障感染机体细胞后,机体主要通过免疫系统来抵抗并清除病毒,以防进一步对宿主造成伤害。益生菌可以刺激机体的免疫系统,通过免疫反应来调节因病毒感染而引起的过度炎症反应和免疫紊乱现象,从而起到抗病毒的作用[28]。
3.1 肠道菌对天然免疫的调节
一般来说,胃肠道中的淋巴组织和免疫细胞数量比身体其他部位的总和还要多。黏膜免疫系统又称黏膜相关淋巴组织(mucosa associated lymphoid tissue, MALTS),主要由免疫组织、细胞和分子组成,黏膜与外部环境直接相连,参与复杂的免疫反应[29]。各种免疫细胞参与先天免疫反应,自然杀伤细胞(natural killer cell, NK)是天然免疫的关键成员,在识别和杀伤靶细胞以及对免疫反应调节方面发挥着关键作用。NK细胞的激活和增殖能有效地抑制病毒复制。根据Matsusaki等[30]的研究,植物乳杆菌(Lactobacillusplantarum) 06CC2降低小鼠大脑中乳酸对HSV-1的产量。L.plantarum06CC2通过增加派尔集合淋巴结(Peyer patch)中IL-12和IFN-γ的mRNA表达量进而增强免疫调节活性。IL-12和IFN-γ能有效激活NK细胞和巨噬细胞,巨噬细胞和NK细胞相互协作以清除病毒。
模式识别受体(pattern recognition receptor, PRR)在微生物和宿主之间具有广泛的相互作用。PRRs是宿主细胞识别病原体的特殊分子,截至目前,发现的PRRs主要包括Toll样受体(TLRs)、核苷酸结合寡聚结构域(NOD)样受体(NLRs)、维甲酸诱导样受体(RLRs)、C型凝集素受体(CLRs)、黑色素瘤缺失的AIM2样受体(ALRs)和环状GMP-AMP合成酶(CGAs)。TLRs的成员可以识别广泛的病原体,如细菌、病毒和真菌。Aoki-Yoshida等[31]的试验表明,鼠李糖乳杆菌能够通过TLR3信号通路治疗RV感染引起的腹泻。木质乳杆菌(LigilactobacillusLG)、唾液乳杆菌(Lactobacillussalivary)FFIG35和FFIG58也通过激活TLR3信号通路展现出抗病毒作用[32]。TLR3主要识别内体中的核酸,TLR3的激活增加了IFN-I的表达。除了激活TLR3,益生菌还可以激活其他PRR。例如,嗜酸乳杆菌(Lactobacillusacidophilus)可以通过诱导小鼠树突状细胞(DC)中病毒免疫防御基因的表达来增强抗病毒效果[33]。病毒诱导的免疫防御基因的表达依赖于TLR2通路的激活,此外,L.plantarum可通过NLR(NOD2)和TLR(TLR2)途径抑制小鼠的肺炎病毒(pneumonia virus of mice, PVM)感染[34]。NOD2和TLR2都介导了重要的先天性免疫反应,以抑制病毒感染。多项研究表明,益生菌混合物也具有免疫调节活性,益生菌混合物(Helveticus R0052、双歧杆菌R0033和双歧杆菌R0071)可以显著下调IL-6、IL-8和IL-1β等促炎细胞因子的表达,上调TLR3、丝裂原活化蛋白激酶和NF-κB的表达[35]。L.salivary可通过调节TLR2、HMGB1、p-p65/p65、NLRP3、Caspase-1蛋白表达缓解鸡毒支原体(Mycoplasmagallisepticum,MG)感染肉鸡肺部炎性损伤[36]。此外,L.plantarum、W.cibaria和L.Sakei可以通过激活TLRs和NF-κB通路来调节IECS中Poly(I:C)诱导的先天抗病毒免疫反应(图1D)[8]。NF-κB信号通路与促炎细胞因子的产生有关,在病毒感染期间激活NF-κB信号通路可以增加促炎细胞因子的产生,调节免疫细胞的功能。
干扰素是抗病毒免疫和调节免疫系统动态平衡的重要媒介[37]。Steed等[38]在肠道菌代谢物脱氨基酪氨酸通过刺激细胞产生IFN-I抗流感病毒感染的试验中发现,酪酸梭状芽胞杆菌通过降解黄酮类物质,产生脱氨基酪氨酸进而上调IFN-I信号通路和ISG的表达,从而增强天然免疫反应;Schaupp等[39]发现肠道菌群能够促使浆细胞样树突状细胞产生IFN-I。此外,L.Plantarum通过在早期诱导大量的IFN-β和在晚期激活JAK-STAT1通路而在IPEC-J2细胞中发挥抗TGEV的作用,并且激活的JAK-STAT1通路还可以使一些抗病毒蛋白的转录和表达增加[40]。
3.2 肠道菌对获得性免疫的调节
病毒的清除并不仅局限于宿主的先天性免疫,还和获得性免疫反应有着重要关系。越来越多的证据表明,益生菌可以通过刺激适应性免疫反应来保护宿主免受病毒感染。Karaffova等[41]的研究中,罗伊乳杆菌(Lactobacillusreuteri)显著降低了粪便、回肠和肠系膜淋巴结(mesenteric lymph nodes, MLN)中的PCV2病毒载量,并增加了回肠中的IgA的含量。IgA是黏膜免疫系统的主要组成部分,广泛分布于宿主黏膜组织的黏膜分泌物中,可抑制病毒与上皮细胞的黏附,减缓病毒复制,在免疫屏障中发挥重要作用。越来越多的证据表明,不仅活的益生菌,而且热灭活的益生菌也具有免疫调节作用。例如,热灭活菌L.CaseiDK128通过诱导病毒特异性抗体,通过鼻腔治疗,对乙型流感病毒(influenza virus,IFV)感染具有广泛的保护作用[42]。而且,sIgA可与病毒特异性结合,抗体捕获的病毒可被吞噬细胞吞噬破坏。
4 肠道菌群代谢物抑制病毒感染
机体需要肠道菌群提供重要的生物酶来实现将摄入的食物转化为营养物质,将未消化的大分子物质进行厌氧发酵,转化为可被吸收且数量庞大的小分子物质。肠道菌群代谢物抑制病毒感染的方式主要是通过调节肠黏膜屏障和宿主的天然免疫体系来实现的。肠道菌群可以通过产生的短链脂肪酸、色氨酸代谢物、细菌素、胞外多糖等代谢物实现对肠道病毒或非肠道感染病毒的抑制。
4.1 短链脂肪酸
短链脂肪酸(short chain fatty acids, SCFAs)具有丰富的生物学功能,可促进机体免疫细胞分化成熟、参与机体的免疫调节、维持机体菌群平衡、抑制或杀灭有害菌生长繁殖、促进有益菌生长、促进胃肠道消化与吸收、调节机体糖脂代谢。人体内的绝大部分SCFAs都是肠道菌群发酵肠道内容物而来,其中含量较多的为乙酸、丙酸、丁酸。当给哺乳小鼠连续口服丙酸后,通过增加ERK1、MAPK的表达来增强ZO-1、Claudin-1、Claudin-8的表达,以促进结肠上皮屏障功能的发挥(图1A)[43]。在仔猪日粮中添加丁酸可减轻断奶仔猪的腹泻情况,降低肠上皮细胞的通透性,其机制是以GPR109A依赖性方式上调结肠中Claudin-1、Occludin、ZO-2,起到维持肠上皮屏障的作用[44]。SCFAs被认为是肠道微生物群和免疫系统之间交流的介质。主要通过G蛋白偶联受体(G protein-coupled receptor,GPCRs)的激活以及组蛋白去乙酰化酶(histone deacelylase,HDAC)的抑制来调节T细胞的功能[45]。GPCRs发挥免疫调节的受体主要包括GPR41、GPR42、GPR43。SCFA通过激活GPR41和抑制HDAC来促进CD4+T细胞和ILCs产生IL-22,以维持肠道稳态[46]。研究表明,肠道菌代谢物乳酸和丙酮酸通过诱导CX3CR1+细胞中的GPR31诱导树突突起,有助于增强肠黏膜免疫反应[47]。SCFAs作为能量物质,可通过抑制NLRP3炎症小体和自噬,刺激肠道屏障的形成以保护肠道屏障免受LPS的破坏[48]。杨晓炼[49]的研究显示,布劳特菌(Blautia)代谢产生的乙酸能够通过IRF3、IFNAR通路上调IFN-I,从而抑制脑心肌炎病毒(encephalomyocarditis virus, EMCV)感染。
4.2 色氨酸代谢物
色氨酸(tryptophan,Trp)又称β-吲哚基丙氨酸,它是人体必需氨基酸之一。肠道菌群将食物中的Trp转化为吲哚乙酸(IAA)、吲哚-3-乙醛(IAAld)、吲哚硫酸(ISA)、吲哚-3-醛(IAld)、吲哚-丙烯酸(IA)等吲哚衍生物和色胺[50],上述大部分的吲哚衍生物都是芳香烃受体激动剂。罗伊氏乳杆菌代谢色氨酸产生的吲哚衍生物能够激活CD4+T中的AhR,并且下调Thpok基因家族,分化成为CD4+CD8αα+双阳上皮内淋巴细胞(DP ILE),因此,罗伊氏乳杆菌和含色氨酸的食物一同服用可将上皮内CD4+T细胞重新编程为免疫调节T细胞。上述的其它吲哚衍生物可能也有这样的效果[51]。
色氨酸羟化酶可将色氨酸催化生成5-羟色氨酸,再经脱羧酶转化为5-羟色胺。5-羟色胺能够在结肠上皮中特异表达,并能诱导色胺的生物学功能,其中就包括对免疫系统的调节[52]。研究发现,小檗碱能影响肠道屏障功能,其机制是通过调节肠道菌群相关的色氨酸代谢物来激活AhR,能够改善由DSS引起的结肠炎,维护肠道屏障功能[53]。如果肠道中5-羟色胺的过度生成也会扰乱肠道免疫系统平衡,影响上皮内淋巴细胞水平、CD4+/CD8+T淋巴细胞和B淋巴细胞增殖以及sIgA和细胞因子的分泌[54-57]。
虽然肠道菌群对于一些疾病的治疗确实展现出很大的优势,但在一些特定条件下,对机体有益的肠道菌也会变成机会性致病菌[58]。此外,高湿高温环境会降低肠道屏障功能,影响色氨酸代谢和AhR/IL-22信号通路,NOD2、NF-κB、pIgR等相关基因表达增加,导致肠道附近相关炎症因子增多,局部炎症加重,肠道通透性增加,如果继续使用肠道菌则会导致疾病滞留,病程延长[59]。
4.3 细菌素
细菌素是肠道菌产生的蛋白类代谢物,具有抗肿瘤、抗菌、抗病毒、抗生物膜功能的抗菌肽[60]。肠球菌产生的肠菌素B被证明可以抑制流感病毒(H1N1和H3N2亚型)在犬肾细胞中的细胞病变效应[61]。据推测,细菌素可能导致病毒颗粒聚集,通过与宿主细胞受体结合或抑制病毒复制周期中的关键步骤来阻断病毒颗粒(图1F)[62]。
乳酸菌的细菌素抗病毒研究已成热点。在德氏乳杆菌中分离提纯出的细菌素能够显著抑制H7N7和H7N1亚型流感毒株感染,这种作用机制可能是细菌素抑制了病毒复制中的关键步骤[63]。SARS-CoV-2,俗称新冠病毒,是近几年传染性最强、危害程度最大的病毒,它的入侵细胞机制是通过其表面的刺突蛋白(spike glycoprotein, S蛋白)与宿主细胞表面的血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)受体识别结合入侵机体上呼吸道细胞,通过软件模拟发现,S蛋白结构域的细胞受体结合区(receptor binding domain, RBD)能够被植物乳杆菌产生的细菌素屏蔽(如BN、plantaricin D、plantaricin W等),从而阻止SARS-CoV-2的感染(图1F)[64]。
近几年,越来越多的细菌素抗病毒机制被发掘,这对预防和治疗病毒性感染又开拓出一个新的方向,像细菌素这种绿色、健康、安全、易于取得的抗病毒物质有望被广泛应用于医疗和养殖业中。
4.4 胞外多糖
胞外多糖(exopolysaccharides, EPS)是由益生菌产生的单糖或寡糖的重复单元[65],具有多种不同的化学成分和性质,因其免疫调节、抗氧化、抗病毒作用而被广泛的研究[66]。肠球菌属(Enterococcus)产生的EPS具有免疫调节活性,Sharma和Ghosh[67]证实了MG6 EPS具有促进巨噬细胞产生一氧化氮(NO)、TNF-α、IL-6和IL-β的免疫活性。此外粪肠球菌在TLR-2、IL-10水平和吞噬活性方面也表现出良好的免疫活性[68]。Huang等[69]的研究证实L.PlantarumEPS(LPE)可通过下调IL-1β、IL-6、IL-8、MCP-1炎症因子的转录水平以降低猪流行性腹泻病毒(PEDV)感染所致的炎症反应。
4.5 其它代谢物
除上述4种代谢物外,肠道菌代谢的乳酸(lactic acid,LA)、外膜囊泡(outer membrane vesicles, OMV)或胞外囊泡(extracellular vesicle, EV)对病毒的入侵均有抑制作用。
在阴道黏膜中起保护作用的肠道菌以乳杆菌属为主。乳杆菌释放的代谢物对人类免疫缺陷病毒(HIV)具有抗病毒作用,LA是乳酸杆菌在阴道黏膜中产生的主要抗病毒因子[70]。产乳酸菌抗HIV感染机制可能是多方面的,首先LA可能与病毒结合并影响病毒的功能,从而限制病毒入侵细胞。其次,LA可能会破坏病毒包膜并裂解包膜病毒的病毒粒子以实现抗病毒作用[71]。肠道菌可以分泌含细菌DNA的OMV通过血液循环输送到远端宿主细胞来激活cGAS-STING-IFN-I轴,从而促进DNA病毒和RNA病毒的清除,细菌可通过这一途径介导全身IFN-I的启动,研究人员已从小鼠粪便中分离出载有厚壁菌门、拟杆菌门、变形菌门和放线菌门的OMV[72]。肠道菌群也可通过血液循环、肝肠循环等将其组分或代谢产物运送到非肠道的其他部位,形成“肠-肺轴、肠-肝轴、肠-肾轴、肠-脑轴、肠-心轴”,以调节机体免疫系统[73-74]。卷曲乳杆菌(L.crispatusBC3和L.crispatusBC12)能够通过产生EV保护人类宫颈阴道和扁桃体组织免受HIV-1的吸附和入侵[75]。
5 展 望
本文综述了肠道菌群抵抗病毒感染的最新研究进展以及肠道菌群干扰病毒感染的最常见机制,无论是直接与病毒作用还是通过调节免疫系统间接阻止病毒感染,不可否认肠道菌群以其绿色、安全、成本低的优势有望成为抗病毒治疗的靶点。然而,肠道微生物区系与病毒相互作用的具体机制还需要进一步研究,如肠道菌群抑制病毒感染是否在病毒增殖周期的其他几个阶段,如穿入、脱壳、生物合成、组装及释放等过程发挥作用,还亟待深入解析。近年来,随着分子生物学技术的发展,尤其是高通量测序技术的成熟,将单细胞测序与空间转录组测序技术联合应用于抗病毒机制的研究,将有望深入阐释肠道菌群的抗病毒机制,将为肠道菌和肠道菌群移植作为促进机体健康的预防和治疗手段,提供坚实的数据基础。
