地西他滨对猪圆环病毒2型的体外抑制作用
2024-01-10范锦全张宇航唐午阳赵欣宇李丕顺郑晓峰
范锦全,张宇航,唐午阳,赵欣宇,李丕顺,郑晓峰
(湖南农业大学动物医学院,长沙 410125)
猪圆环病毒(porcine circovirus, PCV)是环状单链DNA病毒,无囊膜,属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),在禽类、犬类、企鹅、狐狸、熊类和猪中均能引起疾病。1998年Allan发现了一种全长为1.76 kb的环状病毒,其与PCV1结构相似,但二者序列相似性小于80%,因此将其命名为PCV2[1]。直至今日,PCV2仍是一种全球传播的频发病原,感染的猪会出现多系统衰竭症、肠炎、肺炎和生殖障碍等症状,这些症状统称为猪圆环病毒病(porcine circovirus desease,PCVD)或猪圆环病毒相关疾病(porcine circovirus associated disease, PCVAD)[2]。PCV2是严重影响全球养猪业经济效益的重要疫病之一,尽管商品化的兽用疫苗已广泛使用,有效降低了宿主感染后的亚临床症状,减少了养殖场的经济损失;但更多证据表明,使用PCV2灭活疫苗免疫,临床的抗原阳性率仍然较高,对疫病防控仍是一种挑战[3-4]。因此,新的PCV2防控手段的研发迫在眉睫。抗病毒药物是控制病毒性疾病的一个重要研究方向,老药新用因其安全性、有效性以及给药方式较为明晰,不仅能够降低成本、节约时间、还能提高研发的成功率[5]。地西他滨(decitabine,DAC),又名5-氮杂-2′-脱氧胞嘧啶核苷(5-aza-2′-deoxycytidine),2006年5月经美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于骨髓增生异常综合征(myelodysplastic syndromes, MDS)治疗,是一种具有口服活性的脱氧胞苷类似物和 DNA 甲基转移酶抑制剂[6-7]。目前,已有研究表明DNA甲基化与先天免疫反应密切相关,地西他滨作为最有效的DNA甲基转移酶抑制剂,已证明对多种病毒具有抑制作用,包括人类免疫缺陷病毒(human immunodeficiency virus, HIV)、乙型肝炎病毒(hepatitis B virus, HBV)、丙型肝炎病毒(hepatitis C virus, HCV)、人乳头瘤病毒(human papillomavirus, HPV)和马疱疹病毒1型(equid herpesvirus-1, EHV-1)[8-13]。但DAC对PCV2是否具有抑制作用尚未可知,因此研究DAC对PCV2增殖的影响并确定其机制,能够为PCV2预防和控制提供理论依据。
1 材料与方法
1.1 细胞和病毒
猪肾上皮细胞 PK-15 传代细胞系由本实验室冻存;PCV2病毒毒株(GenBank 登录号:KJ867555)由湖南农业大学动物医学院杨毅教授惠赠。
1.2 主要试剂与仪器
地西他滨购自美国GLPBIO有限公司;CCK-8试剂盒购自APExBIO有限公司;PCV2 Cap蛋白抗体和Rep蛋白抗体均购自GeneTex有限公司;5-methylcytosine(5 mC)单克隆抗体购自Epigentek有限公司;RNA提取试剂盒Gene JET RNA Purification Kit,DMEM培养基、青链霉素、胰酶和荧光二抗抗体[Goat anti-Rabbit IgG (H+L) Secondary Antibody, DyLightTM488]均购自赛默飞世尔科技有限公司;DNA提取试剂盒购自天根生化科技公司;反转录试剂盒和qPCR酶均购自北京全式金生物有限公司;胎牛血清购自美国Life Technologies公司;RIPA裂解液、DAPI、Triton X-100购自索莱宝科技有限公司。荧光PCR仪(Roche,light cycler 480);酶标仪(Tecan,Infinite E plex);化学发光成像仪(GE,Amersham Imager 600);荧光显微镜(Leica,DMi8)。
1.3 细胞培养与病毒感染
将PK-15细胞培养于含10% 胎牛血清和1%青链霉素的DMEM培养基中,在37 ℃,5% CO2细胞培养箱中进行培养。细胞密度达到80%左右时进行传代或接种PCV2(MOI=1),根据试验需求,在感染24、48或72 h后收样进行检测。
1.4 CCK-8法测定细胞毒性
将100 μL PK-15 细胞悬液以 1.3×104·孔-1接种到96孔板中,培养16 h后加入不同溶度的地西他滨,以DMSO组作为对照,孵育48 h后每孔加入10 μL CCK-8溶液,继续培养4 h,使用酶标仪测定450 nm处的吸光度,再根据试剂盒说明书中的公式计算细胞活力。
1.5 RNA提取及荧光定量PCR
使用Gene JET RNA Purification Kit提取总RNA,再根据Revert Aid First Strand cDNA Synthesis Kit说明书反转录合成 cDNA,以此作为模板进行qRT-PCR。以GAPDH作为内参基因,对目的基因进行验证。通过NCBI设计定量引物(表 1),由湖南擎科生物有限公司合成。PCR反应体系:qPCR Mix 5 μL,上下游引物各0.4 μL,ddH2O 4.1 μL,cDNA 0.1 μL。PCR程序:95 ℃预变性5 min;95 ℃10 s,60 ℃35 s,40个循环。通过2-ΔΔCt方法计算目的基因的相对表达量,使用GraphPad Prism 8.0进行t检验。
1.6 间接免疫荧光试验
待检细胞弃去培养上清液,用PBS洗涤3次。加入4%多聚甲醛进行固定10 min,而后弃去固定液,PBS清洗,加入1% Triton-X 100的PBS进行通透,15 min后吸尽,弃上清后PBS清洗。加入5% BSA,于37 ℃封闭1 h。弃掉封闭液,加入PCV2病毒蛋白Rep的多克隆抗体(1∶500稀释)或5 mC的多克隆抗体(1∶1 000),37 ℃孵育1 h。PBS洗涤3次,加入荧光二抗(1∶1 000),37 ℃孵育1 h。PBS洗涤后,DAPI(1∶1 000)孵育5 min,PBS洗涤3次,封片后于荧光显微镜下观察。
1.7 Western blot
弃去细胞培养基,PBS 洗涤后加入预冷的 RIPA 裂解细胞,提取细胞总蛋白,测定蛋白浓度后进行 SDS-PAGE 凝胶电泳、转膜,50 g·L-1脱脂奶粉室温封闭 2 h,PCV2 Cap 蛋白抗体(1∶1 000)、PCV2 Rep蛋白抗体(1∶1 000)β-Actin 抗体(1∶5 000)4 ℃孵育过夜,HRP 标记二抗(1∶5 000)室温孵育 1 h,化学发光显色后,在超灵敏多功能成像仪(GE Amersham Imager 600)中曝光成像。
1.8 TCID50试验
PCV2病毒液从10-1~10-7作10倍倍比稀释。每孔100 μL体系,10%的病毒液与90%的细胞悬液,每孔重复8次,正常细胞作为对照。37 ℃培养96 h。而后经免疫染色,对感染情况进行观察,通过Spearman-Karber法计算TCID50[14-15]。
1.9 RNA干扰
从NCBI数据库中检索猪DNMT1 mRNA序列(NM_001032355.1),根据shRNA设计原则,设计并合成shRNA序列,shRNA序列为5′-CCGGGTCTCTTGAAGGTGGTGTTAACTCGA-GTTAACACCACCTTCAAGAGACTTTTTG-3′,阴性对照序列为5′-AAGTTCATCTCGAGATGA-ACTTCAGGGTCAGCTTGCTTTTTG-3′,序列由北京擎科生物科技有限公司合成,采用化学合成方法合成单链寡核苷酸,退火后得到双链DNA,将双链DNA片段与经EcoRⅠ和AgeⅠ双酶切的pLKO.1进行连接制备pDNMT1-shRNA重组载体。通过转染试剂Lipo Fiter介导慢病毒包装质粒psPAX2、pMD2.G和目的质粒pDNMT1-shRNA、pLKO.1-shGFP共转染至293 T细胞中,48 h后收集含有慢病毒颗粒的上清液,经0.45 μm过滤后获得慢病毒纯化液。试验分为三组:试验组(pDNMT1-shRNA)为感染含有pDNMT1-shRNA的慢病毒,阴性对照组(pLKO.1-shGFP)为感染含有pLKO.1-shGFP的慢病毒,空白对照组(Mock)不感染慢病毒。将2 mL慢病毒液以及2 μL polybrene(终质量浓度为1 μg·mL-1)加入已接种PK-15细胞的6孔板中,每孔细胞汇合度为60%。慢病毒感染12 h后换成含10%胎牛血清的新鲜完全培养基,感染24 h后加入4 μL嘌呤霉素(终质量浓度为2 μg·mL-1)进行筛选。
1.10 统计学方法

2 结 果
2.1 猪圆环病毒2型细胞感染模型的鉴定
为了探究地西他滨对PCV2的抑制作用,实验室需要对病毒进行分离培养,并建立细胞感染模型。在此,作者使用特异性引物通过 PCR 扩增验证了 PCV2的特异条带(图 1A)。通过Western blot和免疫荧光进一步检测PCV2在PK-15细胞中的感染效率(图1B、C),证明使用的PCV2毒株能正常感染PK-15细胞系。
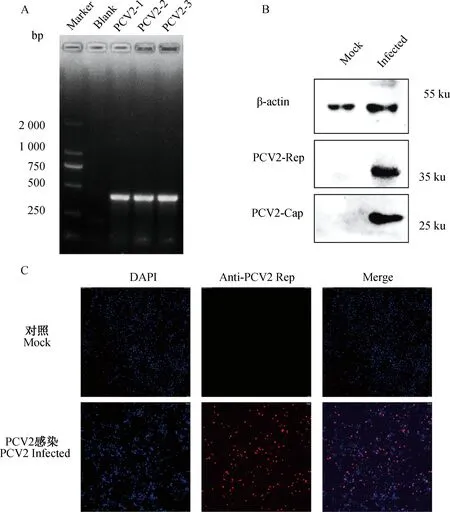
A. PCR验证PCV2的特异性扩增条带;B. Western blot检测PCV2的感染;C. 免疫荧光检测PCV2的感染效率A. PCR identification results of PCV2; B. Detection of PCV2 viral protein by Western blot; C. Immunofluorescence results of PCV2 infected PK-15 cell图1 PCV2细胞感染模型的建立Fig.1 Establishment of PCV2 infected PK-15 cell model
2.2 地西他滨具有抗PCV2活性
DAC的结构式如图2A所示,分子大小为228.08。用不同浓度DAC溶液处理PK-15细胞,通过CCK8试验检测细胞毒性,结果显示:当DAC浓度>20 μmol·L-1时才对细胞具有显著的毒性,(图2B)。选取10 μmol·L-1的DAC处理PK-15细胞2 h后接种PCV2(MOI=1),再于37 ℃含DAC的培养基中共培养48 h。给药组TCID50的结果显示DAC可以抑制PCV2的增殖(图2C)。通过间接免疫荧光法检测PCV2的感染效率,结果如图2 D显示,DAC处理组中PCV2的Rep蛋白荧光信号显著降低。
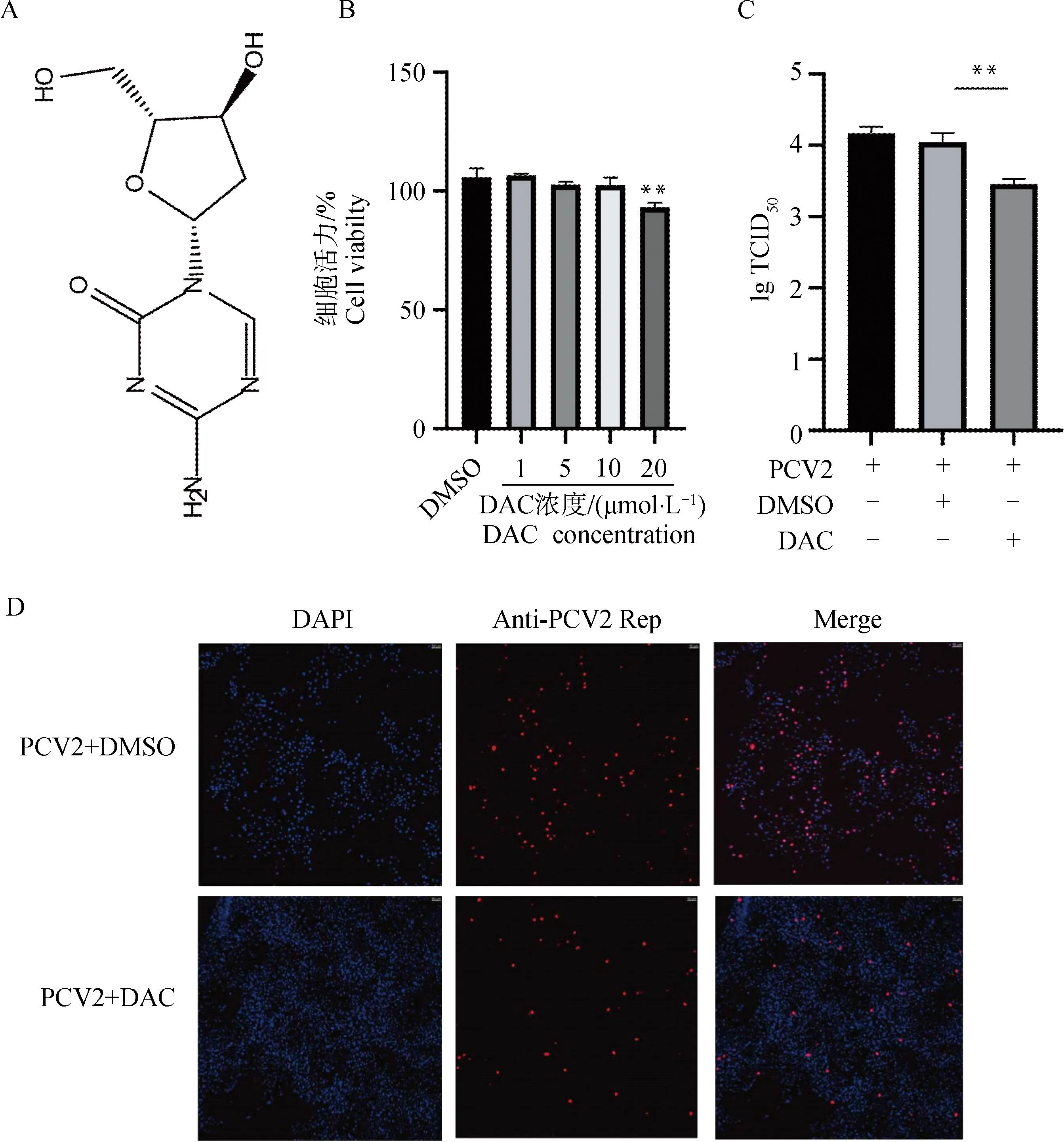
A.地西他滨的结构式;B. 地西他滨的细胞毒性;C. TCID50检测地西他滨的抗PCV2活性;D.免疫荧光检测地西他滨的抗PCV2活性。**.P<0.01A. Chemical formula of DAC; B. Cytotoxicity of DAC; C. Anti-PCV2 activity of DAC detected by TCID50; D. Anti-PCV2 activity of DAC detected by immunofluorescence.**.P<0.01图2 DAC的抗PCV2活性Fig.2 Anti-PCV2 activity of DAC
检测DAC在PCV2增殖的不同时间的作用,分别在病毒接种后的24、48、72 h进行Western blot和qPCR,比较DAC处理组和未处理组细胞内的Cap蛋白的表达量和病毒的拷贝数。结果如图3所示,与对照组相比,同一时间点的DAC给药组中PCV2的Cap蛋白表达量(图3A)与PCV2的拷贝数(图3B)显著降低。结果表明DAC在PCV2增殖的不同时期均具有抑制病毒增殖的作用。
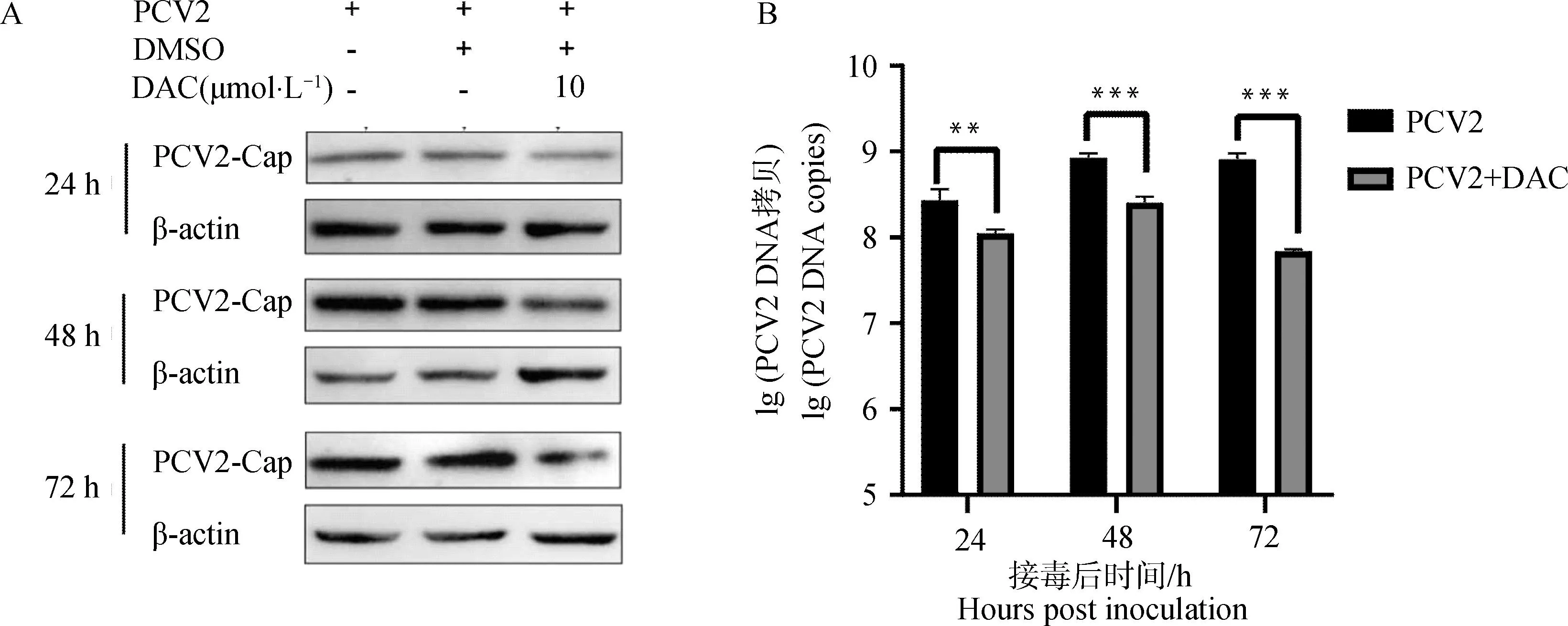
A. Western blot检测Cap蛋白含量;B. qPCR检测病毒的拷贝数。**.P<0.01,***.P<0.001A. Western blot detection of Cap protein content; B. Detection of PCV2 copies by qPCR method.**.P<0.01,***.P<0.001图3 DAC抑制不同时间的PCV2增殖Fig.3 DAC inhibits PCV2 proliferation at different time
2.3 地西他滨下调细胞DNA甲基化水平
DAC作为一种去甲基化药物,能显著抑制DNA甲基化转移酶的甲基化功能。通过间接免疫荧光试验表征细胞的甲基化程度,结果显示DAC给药组的细胞中5-甲基胞嘧啶(5-methylcytosine, 5 mC) 的甲基化水平显著降低(图4A)。此外,通过qPCR检测细胞中的Ⅰ型干扰素(interferons,IFNs)和干扰素刺激基因(interferon-stimulated genes,ISGs),发现DAC处理组的Ⅰ-IFN和ISGs均发生了显著上调(图4B)。

A. 免疫荧光检测DNA甲基化程度;B. qPCR检测抗病毒因子的转录水平。ns. P>0.05,***.P<0.001,****.P<0.000 1A. Detection of DNA methylation level using immunofluorescence assay; B. Transcription level of antiviral factors were detected by qPCR. ns. P>0.05,***.P<0.001,****.P<0.000 1图4 DAC抑制DNA甲基化并活化抗病毒免疫通路Fig.4 DAC inhibits DNA methylation and activates antiviral immune pathway
2.4 敲低DNMT1显著抑制PCV2的体外增殖
DNMT1作为DAC的作用靶点,是哺乳动物中主要的DNA甲基转移酶,可将甲基转移到基因组DNA的胞嘧啶核苷酸上。为了进一步确定DAC抗PCV2活性的作用机制,采用RNA干扰技术沉默DAC的作用靶点DNMT1。通过显微镜成像观察细胞形态变化,qPCR检测shRNA的敲低效率。结果显示,RNA干扰并未对细胞的形态造成影响(图5A),且敲低效率十分明显(图5B)。
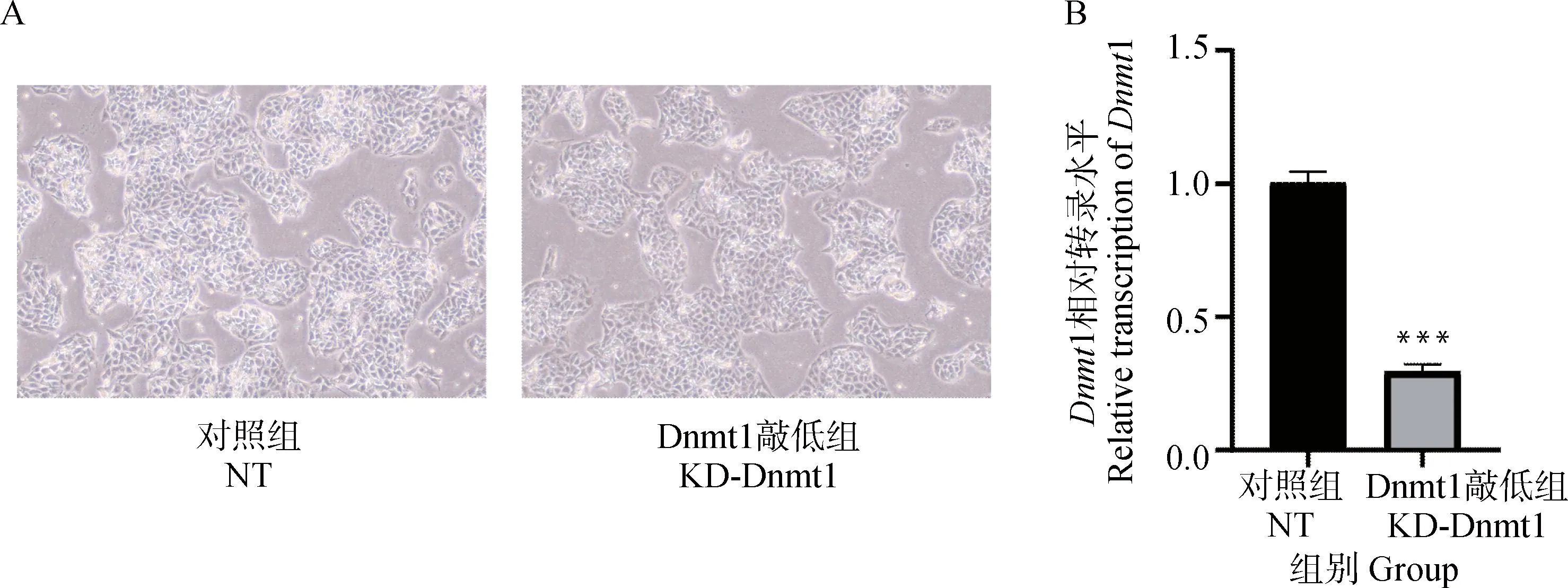
A. 显微镜明场观察细胞形态;B. qPCR检测Dnmt1敲低效率。***.P<0.001A. Observation of cell morphology by microscopic bright field; B. Dnmt1 knockdown efficiency was detected by qPCR.***.P<0.001图5 Dnmt1敲低效率的验证Fig.5 Validation of Dnmt1 knockdown efficiency
检测在PK-15细胞中沉默Dnmt1后PCV2不同时间的增殖情况,分别在病毒接种后的24、48、72 h进行Western blot和qPCR,比较Dnmt1敲低组和对照组细胞内的Cap蛋白的表达量和病毒的拷贝数。结果显示,同一时间点的Dnmt1敲低组中PCV2的Cap蛋白表达量(图6A)与PCV2的拷贝数(图6B)显著降低。表明Dnmt1在PCV2增殖的不同时期均发挥重要作用。此外,敲低Dnmt1后,发现Ⅰ-IFN和ISGs均发生了显著的上调(图6C)。
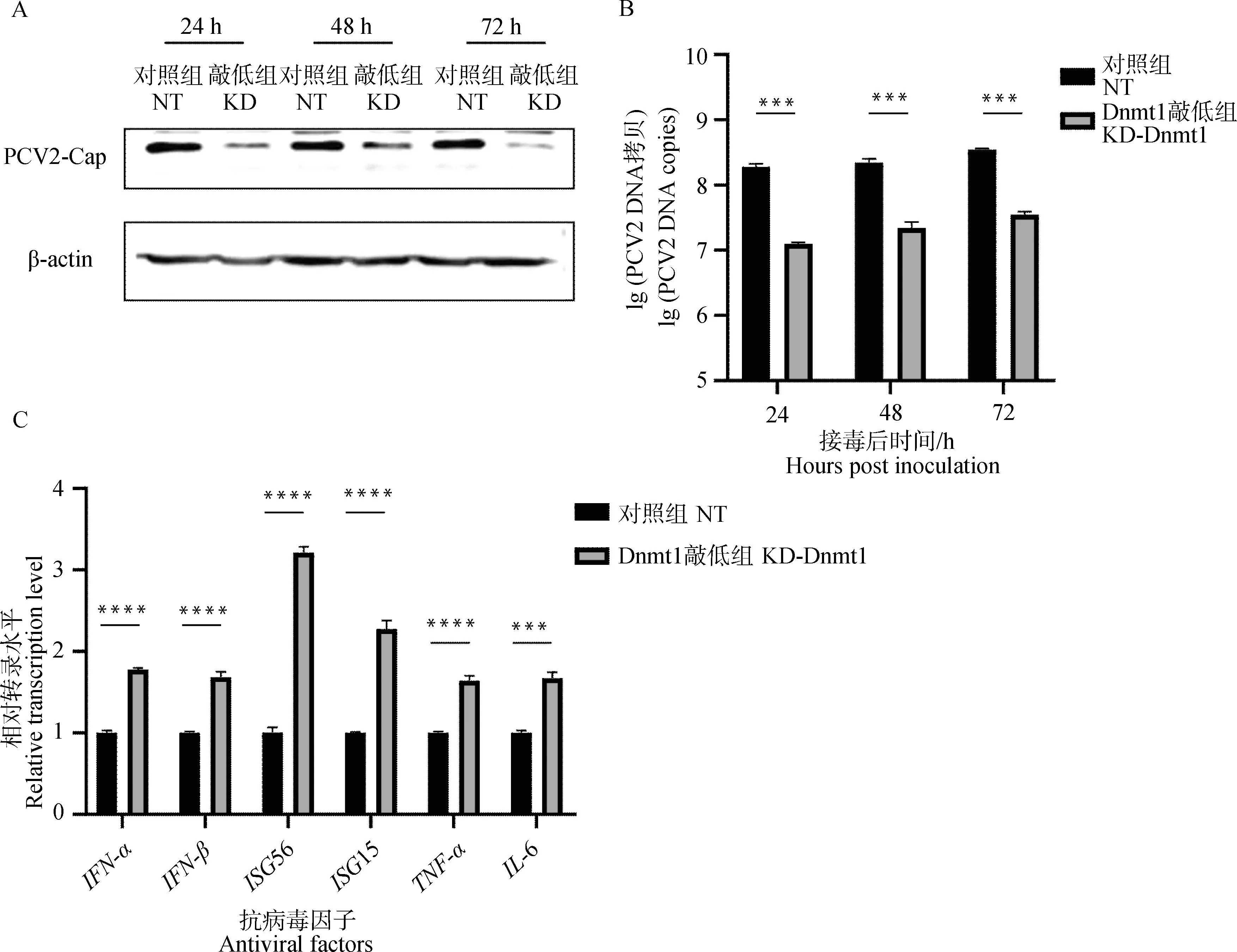
A. Western blot检测Cap蛋白含量;B. qPCR检测PCV2的病毒拷贝数;C. qPCR检测抗病毒因子的转录水平。***.P<0.001,****.P<0.000 1A. Western blot detection of Cap protein content; B. Detection of PCV2 copies by qPCR method; C. Transcription level of antiviral factors were detected by qPCR.***.P<0.001,****.P<0.000 1图6 敲低Dnmt1可抑制PCV2的增殖并活化抗病毒免疫通路Fig.6 Knockdown of Dnmt1 inhibits PCV2 proliferation and activates antiviral immune pathway
3 讨 论
PCV2作为一种普遍存在的病毒,当前商品化疫苗的广泛使用有效降低了PCV2发病率和病毒血症水平,但亚临床感染以及新基因型的出现仍然威胁着现代养猪业[16-17]。因此,抗病毒药物的开发与应用是降低该病毒对养殖行业影响的重要手段。地西他滨作为一种核酸类似物,多项研究指出其不仅能有效对抗多种癌症,还能通过上调固有免疫反应发挥抗病毒功能[8,18-19]。此外,一系列研究表明DAC处理和DNMT1敲低能诱导抗病毒反应,如低剂量的化疗药物DAC可以通过诱导病毒拟态来开启结直肠癌干细胞抗病毒反应等[20-23]。PCV2作为已知最小的感染动物的DNA病毒,DAC抑制PCV2的作用靶点究竟是宿主DNA还是病毒DNA暂时未知,但多篇已发表的研究均指出宿主DNA去甲基化能诱导免疫信号的激活进而发挥抗病毒功能。因此,人们有理由相信DAC主要作用于宿主细胞的DNA,但也可能对病毒基因组产生一些影响,具体的作用机制和作用靶点仍然需要进一步的研究来确定。
PCV2对宿主的免疫系统有很强的抑制作用,能够抑制干扰素生成细胞中IFN-α和TNF-α的生成,这是其常合并感染其他病原体的重要原因。本研究对DAC是否具有抑制PCV2增殖的作用进行了初步探究,证明了DAC在较低浓度时可有效抑制PCV2在PK-15细胞中的增殖,其抗病毒机制依赖于DAC导致的去甲基化及其上调的固有免疫反应。沉默DAC的作用靶点Dnmt1,能有效激活I-IFN和ISGs的表达且抑制PCV2的增殖,进一步证明了DAC的抗病毒功能与其抑制DNA甲基化息息相关,揭示Dnmt1是防治PCV2的潜在靶点。同时,本研究证明DAC能有效抑制不同时期PCV2的增殖,指明DAC具有作为PCV2治疗药物的潜力,为丰富PCV2抗病毒药的研发拓宽方向。
4 结 论
本研究证明DNA甲基化抑制剂地西他滨在体外对PCV2的感染具有抑制作用,且该抑制作用依赖于地西他滨的已知靶点DNMT1,为地西他滨在临床上治疗PCV2奠定理论基础。
