鸡骨骼肌卫星细胞系的建立及分析
2024-01-10王燕星张雨时姬海港牛玉芳韩瑞丽刘小军田亚东康相涛李转见
王燕星,张雨时,姬海港,刘 阳,牛玉芳,韩瑞丽,刘小军,田亚东,康相涛,李转见
(河南农业大学动物科技学院,郑州 450046)
骨骼肌是畜禽机体重要组成部分之一,对畜禽运动的维系具有重要作用[1]。肌肉组织的终生维持是由卫星细胞介导的[2],骨骼肌卫星细胞(muscle satellite cells, MSCs)是位于细胞膜和基膜之间的一类肌源性干细胞[3],通常情况下,处于静止状态仅零星增殖[4]。而当机体损伤,骨骼肌卫星细胞被激活,进行分裂以重建纤维完整性和功能[5]。分离培养PMSCs对于禽类骨骼肌研究来说是一个复杂且耗时的过程,并且每次试验中细胞产量有限。同时,得到的细胞通常在一次或两次传代后停止生长,且存在内源性污染[6]。细胞永生化是指通过自发或人为诱导原代细胞[7],使其度过复制衰老期,持续增殖分裂。永生化细胞系保留了原代细胞所具有的特定免疫标记和功能特性[8],且能够提供均一的细胞群和可重现的结果[9-10]。常用于建立永生化细胞系的外源基因包括EB病毒[11]、猿猴病毒 40 Large T (SV40-LT)[12]和人端粒酶逆转录酶[13]等。SV40 是一种双链DNA病毒,因其能够快速且使原代细胞稳定转化为永生化细胞而应用广泛[14-15]。
本试验通过慢病毒转染SV40-LT以培养鸡骨骼肌卫星细胞系,从而为家禽骨骼肌的功能研究及永生化细胞系的建立提供参考。
1 材料与方法
1.1 试验材料
DMEM:F12、多聚甲醛(PFA)、胶原酶I、牛血清白蛋白、红细胞裂解液、嘌呤霉素、Triton X-100、马血清购自索莱宝公司;胎牛血清FBS购自Gibco公司;PAX7购自DSHB公司;CY3、山羊血清购自博奥森公司;Fluoromount-G荧光封片剂购自SourthernBiotech公司;质粒无内毒素提取试剂盒购自天根公司;动物总RNA快速提取试剂盒购自GENERay公司;5×All-In-One RT MasterMix购自Abm公司;SYBR Green qPCR Master、CCK-8试剂购自vazyme公司;Agarose购自擎科生物公司;pHY-SV40-Puro病毒液购自赛百慷公司。
1.2 试验方法
1.2.1 原代鸡骨骼肌卫星细胞的分离、培养 取15胚龄的鸡胚20~30枚常规消毒后,超净台内分离胸部肌肉于平皿;PBS缓冲液冲洗3次,剔除血管、脂肪、结缔组织等非肌肉组织;平皿中加入少量消化酶(0.1% I型胶原酶、2%牛血清白蛋白混合于DMEM/F12),将组织剪碎并移至50 mL离心管中;加入组织块5倍体积的消化酶溶液,封口,置于37 ℃水浴消化45 min左右;加入3倍体积的完全培养基终止消化;混合液依次过100目、200目、500目的细胞过滤筛,细胞悬液1 000 r·min-1离心5 min;弃上清,完全培养基重悬细胞接种于T75培养瓶,置于37 ℃,5% CO2培养箱中培养。4 h后进行差速贴壁,即可分离得到PMSCs。
1.2.2 PMSCs免疫荧光鉴定 取F1代细胞接种于24孔板中,每孔3×106个细胞。将细胞用PBS缓慢洗涤;4%多聚甲醛于4 ℃固定30 min;0.1%Triton X-100室温透膜10 min;PBS洗涤;滴加山羊血清[16]封闭1 h;弃封闭液,加入PAX7一抗,4 ℃过夜孵育;回收一抗,PBS洗涤;加入CY3二抗,37 ℃避光孵育1 h;PBS洗涤;加入DAPI染核5 min;PBS洗涤;荧光显微镜下观察。
1.2.3 最佳药物筛选浓度的确定 取F2代细胞接种于24孔板,将嘌呤霉素设置如下梯度:1、2、3、4、5、6、7 μg·mL-1对F2代细胞进行加压筛选,每2 d 换一次液;观察细胞状态,以细胞全部死亡的最低浓度为最佳筛选浓度。PMSCs的嘌呤霉素最佳筛选浓度为1 μg·mL-1。
1.2.4 慢病毒载体的包装 取HEK293T细胞接种于培养皿,将质粒pBobi-SV40-Puro与Lenti-Mix(pMDLg/pRRE∶pVSV-G∶pRSV-Rev=5∶3∶2 比例混合)混匀,加入0.25 moL· mL-1CaCl2吹匀;加入2×HBS,室温静置10 min;将Lenti-Mix-DNA转染体系液逐滴加入培养皿,置于37 ℃、5%CO2的细胞培养箱培养8~10 h;弃液,加入完全培养基继续培养24~48 h,收集上清,500 g离心10 min;取上清用0.45 μmoL·L-1过滤器过滤;加入慢病毒浓缩液,4 ℃过夜;4 ℃ 10 000 r·min-1离心30 min,用无血清培养基重悬,分装后冻存于-80 ℃。
1.2.5 永生化鸡骨骼肌卫星细胞的建立 取F2代细胞,加入病毒液;12 h后抽弃一半培养基并加入一半新鲜培养基,培养24~48 h;加入筛选培养基;显微镜下观察对照组细胞全部死亡,将筛选培养基中的嘌呤霉素浓度减半,直至有阳性细胞的出现;将阳性细胞不断连续培养后,获得鸡骨骼肌卫星细胞系IMSCs;将传代至第12代的鸡骨骼肌卫星细胞系称为IMSCs P12[17]。
1.2.6 细胞增殖分析 将细胞接种于96孔板,每孔5×102个细胞;设置8组,每组10个重复;依次在1~8 d将完全培养基与CCK-8试剂按照9∶1的比例混合;抽弃原有培养基,加入CCK-8试剂的培养液,孵育2 h;用酶标仪测定450 nm处吸光度值并绘制生长曲线。
1.2.7 细胞周期检测 将细胞接种于6孔板,每孔2×106个细胞;消化细胞,2 000 r·min-1离心4 min;弃上清,加入1 mL预冷的PBS,2 000 r·min-1离心4 min;弃上清,重复两次;加入1 mL预冷的70%乙醇,4 ℃固定12~24 h;1 200 r·min-1离心5 min,弃上清;加入PBS,1 200 r·min-1离心5 min;弃上清,碘化丙啶染色,37 ℃避光温浴30 min;用流式细胞仪在488 nm波长处检测细胞周期。
1.2.8 血清依赖性分析 将细胞接种于96孔板,培养12 h;配制0%、5%、10%、20%胎牛血清[18]的DMEM/F12培养基,加入细胞中,每个浓度至少3个重复;加入10 μL CCK-8试剂,孵育2 h。用酶标仪在450 nm波长处测定吸光度值并绘制柱状图。
1.2.9 软琼脂分析 将1.2%的Agarose培养基与20%FBS的DMEM/F12培养基混合,铺到6孔板;将IMSCs P12稀释至每毫升1 000个,HEK293T细胞稀释到每毫升200个;将0.7%的Agarose培养基与20%FBS的DMEM/F12培养基缓慢混合后加入细胞悬液,铺至下层胶;每隔2 d补加200 μL培养基[19];培养2周,待HEK293T细胞长出克隆后,显微镜拍照保存。
1.2.10 鸡骨骼肌卫星细胞诱导分化模型构建及分析 将细胞接种于24孔板;将培养基替换成诱导分化培养基(含2%马血清[20]的DMEM/F12培养基),分别收取增长至 70%,分化后 1~4 d的细胞。
1.2.11 实时荧光定量PCR检测基因的表达SV40-LT、PAX7、MyoD及MyHC的引物如表1所示,β-actin用作为内参基因。使用SYBR Green Master Mix试剂,cDNA作为模板,在QuantStudio 5实时荧光定量仪进行实时荧光定量PCR,参数如下:95 ℃预变性30 s;聚合酶链式反应95 ℃持续10 s,60 ℃持续30 s,共35个循环;95 ℃持续15 s,60 ℃持续1 min,95 ℃持续15 s。采用2—ΔΔCt方法计算基因的相对表达量。每组样品至少3个生物学重复。

表1 引物序列Table 1 Primer sequences
1.3 数据处理与分析
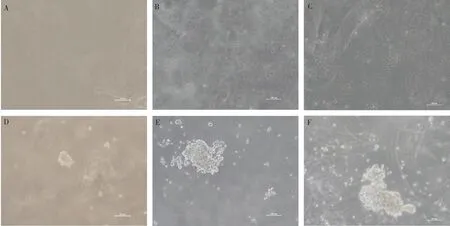
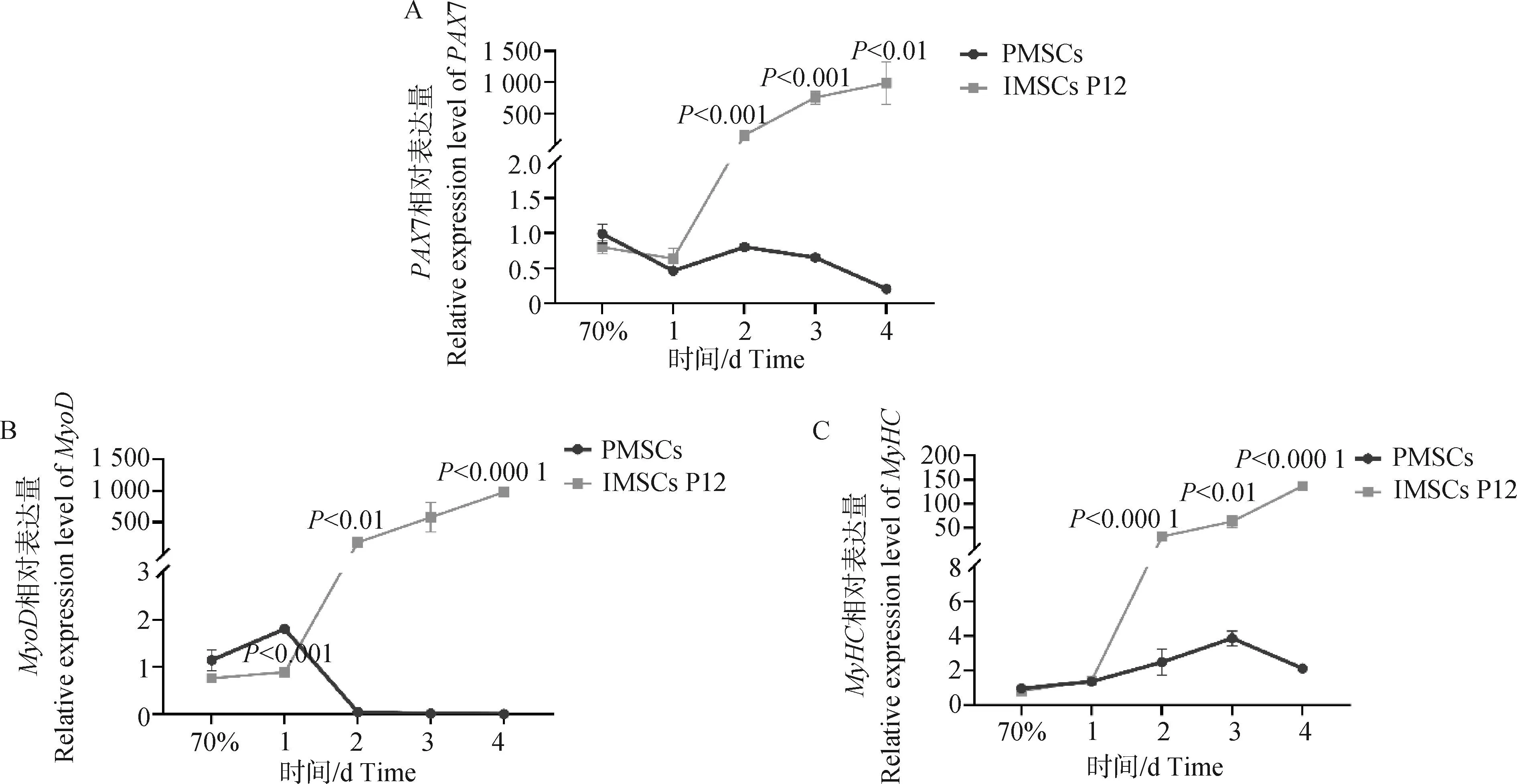
试验数据采用SPSS 27.0软件中的One-way ANOVA和多重比较进行统计分析,结果以“Mean±SEM”表示。0.01 在PMSCs中,有92%的细胞PAX7在细胞核中呈阳性表达(图1),可用于后续研究。 图1 PMSCs中PAX7免疫荧光染色结果(100×,标尺:100 μm)Fig.1 Immunofluorescence staining result of PAX7 in PMSCs (100×, Bar=100 μm) 对照GFP慢病毒包装24 h左右后,荧光效果显示GFP阳性率约90%以上,病毒滴度为1×108tu·mL-1(图2)。 图2 GFP对照病毒包装效果(200×)Fig.2 Comparison virus packaging rendering of GFP (200×) 鸡骨骼肌卫星细胞系连续传至12代(IMSCs P12)后仍具有与PMSCs相似的形态(图3),且SV40-LT基因在IMSCs P12中的表达是PMSCs的15倍(图4)。 A.PMSCs生长近融合状态;B.IMSCs P12生长状态A.PMSCs growth near fusion state; B.Growth state of IMSCs P12图3 PMSCs和IMSCs P12形态图(100×,标尺:100 μm)Fig.3 The morphology of PMSCs and IMSCs P12(100×, Bar=100 μm) 图4 IMSCs P12中SV40-LT mRNA表达Fig.4 SV40-LT mRNA expression in IMSCs P12 将PMSCs与IMSCs P12连续培养8 d,在1~5 d细胞处于生长潜伏期,5~6 d处于对数生长期,然后细胞进入平台期(图5)。 图5 PMSCs和IMSCs P12增殖曲线Fig.5 The growth curves of PMSCs and IMSCs P12 IMSCs P12处在S期的细胞明显多于PMSCs,二者差异极显著(P<0.01);IMSCs P12处在G2M期的细胞明显多于PMSCs,二者差异极显著(P<0.000 1)(图6)。说明与PMSCs相比,IMSCs P12具有更高的增殖活性。 图6 PMSCs和IMSCs P12细胞周期检测Fig.6 Cell cycle detection of PMSCs and IMSCs P12 本试验采用不同血清浓度来培养IMSCs P12,结果如图7所示,在无血清时,IMSCs P12不能正常生长;血清浓度为5%、10%、20%时,IMSCs P12能够增殖,且20%的血清浓度促进增殖的能力要明显高于5%的血清浓度,两者差异极显著(P<0.000 1);15%、20%的血清浓度促进细胞增殖的能力极显著高于5%时细胞增殖的能力(P<0.000 1)。 图7 IMSCs P12血清依赖性分析Fig.7 Serum dependence analysis in IMSCs P12 在培养5D、10D、14D后,显微镜下镜检结果表明,IMSCs P12在软琼脂中均为单独的细胞(图8A、B、C),没有形成细胞克隆,而HEK293T细胞形成了明显的独立细胞克隆团(图8D、E、F)。 A.软琼脂培养2 d的IMSCs P12;B.软琼脂培养5 d的IMSCs P12;C.软琼脂培养2周的IMSCs P12;D.软琼脂培养2 d的HEK293T细胞;E.软琼脂培养5 d的HEK293T细胞;F.软琼脂培养2周的HEK293T细胞A.Culture IMSCs P12 in soft agar for 2 days; B.Culture IMSCs P12 in soft agar for 5 days; C.Culture IMSCs P12 in soft agar for 2 weeks; D.Culture HEK293T in soft agar for 2 days; E.Culture HEK293T in soft agar for 5 days; F.Culture HEK293T in soft agar for 2 weeks图8 PMSCs和IMSCs P12软琼脂分析(100×,标尺:100 μm)Fig.8 Soft agar analysis of PMSCs and IMSCs P12 (100×, Bar=100 μm) 鸡骨骼肌卫星细胞经2%马血清诱导处理后,可以向成肌细胞、肌纤维进行分化。PAX7、MyoD、MyHC分别为鸡骨骼肌卫星细胞、成肌细胞、肌纤维的标志基因。PAX7在PMSCs与IMSCs P12增殖到70%、诱导分化1 d、2 d的表达趋势是一致的,先下降后上升(图9A);MyoD在PMSCs与IMSCs P12增殖到70%、诱导分化1 d的基因表达趋势一致,都是上升(图9B);MyHC在PMSCs与IMSCs P12增殖到70%、诱导分化1~3 d的基因表达趋势一致,都是上升(图9C)。 A.PAX7 mRNA在PMSCs和IMSCs P12中的表达变化;B.MyoD mRNA在PMSCs和IMSCs P12中的表达变化;C.MyHC mRNA 在PMSCs和IMSCs P12中的表达变化A. PAX7 mRNA expression in PMSCs and IMSCs P12; B.MyoD mRNA expression in PMSCs and IMSCs P12; C.MyHC mRNA expression in PMSCs and IMSCs P12图9 PMSCs和IMSCs P12诱导分化Fig.9 Induced differentiation of PMSCs and IMSCs P12 一般而言,原代细胞增殖传代到一定的代数后会停止分裂并伴有衰老、死亡[21]。原代细胞的分离过程比较复杂且不同批次的细胞会带来异质性,影响试验结果[22]。永生化细胞系因其可以提供均质的细胞材料、可重复的试验结果、避免了内源性污染的风险[23]并且具有更好的增殖特性等优势[24]。本研究成功培养了一种鸡骨骼肌卫星细胞系,其生长曲线与细胞周期结果显示增殖趋势与PMSCs保持一致,且IMSCs P12具有更高的增殖活性。 软琼脂试验是检测永生化细胞是否发生恶性转化的标准之一,正常的细胞在软琼脂中并不会生长,而肿瘤细胞可以在软琼脂中生长形成集落[25-27]。HEK293T细胞作为包装慢病毒载体常用的细胞系之一,比较适合作为软琼脂分析的的阳性对照[28]。血清依赖性分析是鉴定细胞是否发生恶性转化的另一标准,肿瘤细胞即使在低血清培养基中也会增殖[29]。SV40法构建的细胞系在低血清培养基中很难形成集落,增加血清浓度后,可见细胞增殖[30]。本研究中,IMSCs P12在软琼脂培养2周后,依旧为单独的细胞克隆,且随着血清浓度的升高,IMSCs P12的增殖能力在逐渐升高,可见IMSCs P12没有发生恶性转化。 干细胞具有多能分化潜能,可以通过外部因素诱导分化成其他细胞,这种能力使得干细胞的研究非常有价值[31-33]。在构建永生化细胞时,干细胞优先作为选择的对象之一[34]。已有许多研究表明,骨骼肌卫细胞可以向成肌、成脂等细胞分化,永生化细胞系的建立将为肌肉、脂肪分化相关调控过程提供体外细胞模型[35-39]。骨骼肌卫星细胞在未分化时主要表达PAX7基因,而MyoD、MyHC低表达;在分化过程中,PAX7的表达下调,MyoD、MyHC的表达上调[40-43]。本研究通过对IMSCs P12诱导分化,当IMSCs P12增殖到70%到诱导分化第1天这一段时期,PAX7基因表达下调,MyoD、MyHC基因表达上调。基于这些结果,该细胞系具有与PMSCs相似的分化能力。SV40-LT基因的转导可以使细胞越过复制衰老期,同时也保留许多原代细胞的分化特性[44-45]。有研究表明,转染SV40-LT可建立永生化细胞系[46],但由于宿主具有特异性,SV40-LT能否在鸡细胞中发挥作用还是未可知的[47]。在研究家禽骨骼肌功能方面,可供使用的细胞系相对有限[48-49]。本研究成功地建立了一种稳定传代至12代的鸡骨骼肌卫星细胞系,下一步将利用其来探究与骨骼肌发育和功能相关基因的表达和功能。但所建立的细胞系培养传代至后期细胞增殖较慢,并且在诱导分化2 d后,IMSCs P12中PAX7、MyoD、MyHC基因的表达显著高于PMSCs。由此推断,SV40-LT基因并不适用于鸡骨骼肌卫星细胞永生化的建立。 本研究通过慢病毒包装SV40-LT基因转染PMSCs得到连续传代、生长良好的鸡骨骼肌卫星细胞系,这为研究家禽骨骼肌相关的功能基因提供了新的细胞模型,也为家禽永生化细胞系的建立提供了研究依据。2 结 果
2.1 鸡骨骼肌卫星细胞细胞鉴定

2.2 慢病毒载体的构建

2.3 嘌呤霉素筛选阳性细胞
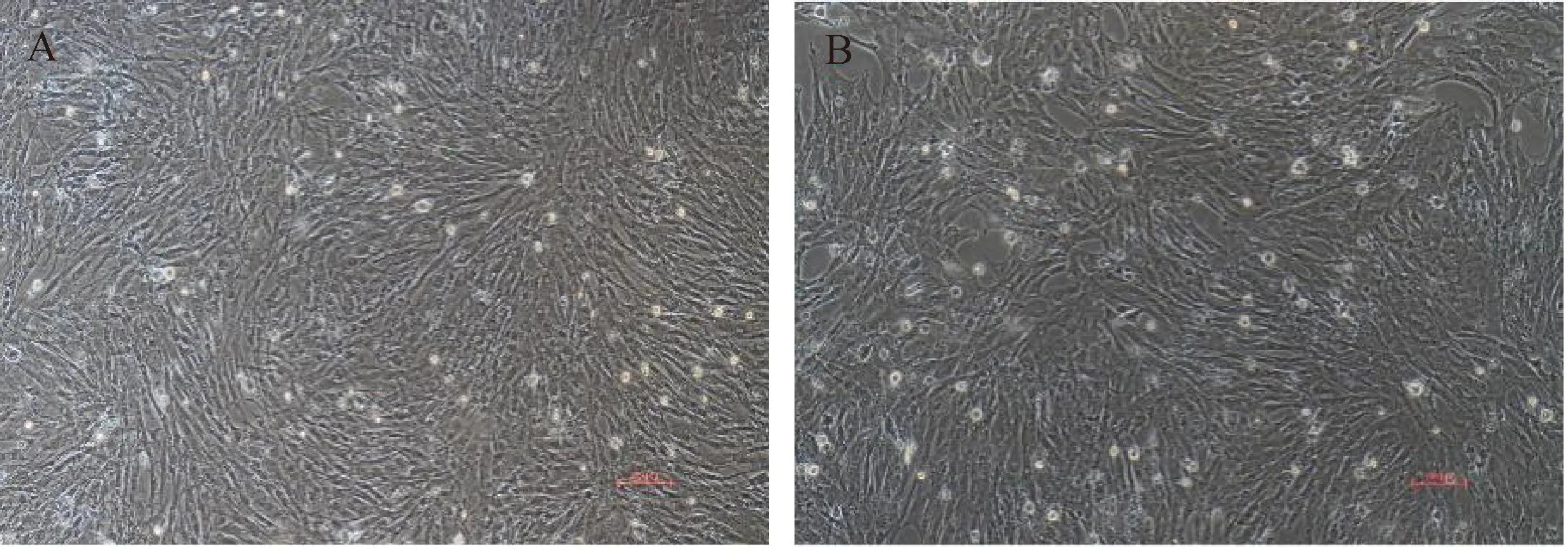

2.4 鸡骨骼肌卫星细胞生长曲线分析
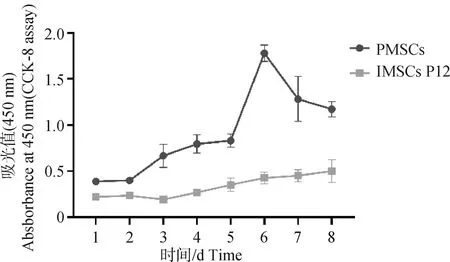
2.5 鸡骨骼肌卫星细胞周期分析

2.6 永生化鸡骨骼肌卫星细胞血清依赖性分析

2.7 鸡骨骼肌卫星细胞软琼脂分析
2.8 鸡骨骼肌卫星细胞诱导分化模型构建及分析
3 讨 论
4 结 论
