基于5-HT 探讨电针刺激天枢、足三里对IBS-D 大鼠的影响
2024-01-10张之涵刘羽彤赵旭宇陈美娟
张之涵,刘羽彤,顾 玲,赵旭宇,花 炀,葛 飞*,陈美娟*
1.南京中医药大学医学院,江苏 南京 210023;2.南京中医药大学附属海安市中医院,江苏 海安 226600
肠易激综合征(irritable bowel syndrome, IBS)是一种临床上较为常见的消化系统紊乱的功能障碍性综合征,病变部位以胃肠为主[1]。 其临床表现为慢性或间歇性的腹痛,腹部不适,并伴有大便性状和排便习惯的异常变化,且受环境、饮食、情绪等诸多因素影响。 临床上,根据排便特点和粪便性状分为腹泻型、便秘型和混合型3 种。 其中,腹泻型肠易激综合征(diarrheal irritable bowel syndrome, IBS-D)在我国IBS 患者中占比最多[2]。除消化系统症状外,IBS-D患者大多数还存在情绪易激动、烦躁易怒等精神心理症状,这对患者及其家属的生活质量、精神状态产生极大的影响[3]。
IBS-D 的发病机制较为复杂。目前认为,其发病机制与胃肠动力学异常、内脏超敏反应等相关[4]。 5-羟色胺(5-hydroxytryptamine, 5-HT)是一种重要的神经递质,与肠道运动和内脏感觉功能密切相关。5-HT 通过激活肠道神经元上的5-HT 受体,如5-羟色胺受体3A 型(5-hydroxytryptamine 3A receptor,5-HT3AR),增加肠道神经元的兴奋性。 导致肠道神经传导异常,使肠道对触摸、压力和其他刺激产生过度的反应,从而导致肠道高敏感[5]。 研究表明,可通过针刺天枢、内关、足三里等穴位,作用于白细胞介素-6(interleukin-6, IL-6)、5-HT、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)等多个靶点,保护肠黏膜抑制炎症反应,从而有效缓解肠道高敏感性[6]。
相关文献研究显示,针灸治疗消化系统疾病具有疗效佳、预后好、难复发、成本低、患者依从性强等优势[7]。 腧穴的选择作为针灸处方的第一组成要素,与针灸的治疗效果密切相关。 本研究在中医学“合募配穴”的指导思想下,基于IBS-D 发病机制的多样性,提出“同经异腑合募配穴”的刺灸方案,选择手阳明大肠经募穴天枢和足阳明胃经下合穴足三里,以期更好地改善IBS-D 的临床症状。 传统针灸是通过在人体穴位上针刺来刺激经络系统,以达到治疗疾病的目的。 而电针则在传统针灸的基础上引入了现代的电子设备,通过电流刺激穴位,从而增强治疗效果。电针是针灸的一种现代形式,是传统中医融入现代科技的典型代表,故本研究将采用电针来刺激穴位。
为进一步探究电针对IBS-D 降低肠道高敏感性、缓解腹泻症状等优势,本实验以IBS-D 大鼠作为研究对象,观察经“同经异腑合募配穴”电针干预后,对IBS-D 大鼠一般体征、内脏高敏感性及结肠组织形态学等影响,初步从5-HT/5-HT3R 通路探讨电针治疗IBS-D 的作用机制,以期为电针治疗IBS-D的临床应用提供科学客观的实验依据。
1 材料
1.1 实验动物
选取6~8 周龄SPF 级SD 雄性大鼠共24 只,体质量(190±90) g。 由南京市江宁区青龙山动物繁殖场提供,实验动物许可证号:SCXK(浙)2019-0002。实验大鼠饲养于南京中医药大学医学院动物房,饲养温度18~25 ℃,相对湿度为40%~70%,噪音低于50 dB,光照时间与黑暗时间各12 h,并给予正常饮食饮水,实验中对动物的所有处置均严格遵循2006年中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》[8]。 动物实验已通过南京中医药大学实验动物中心动物实验伦理委员会批准(伦理批号:202309A023)。
1.2 药物制备
根据需要进行造模的各组大鼠体质量计算所需番泻叶药液量(按10 mL/kg 计算),再计算出番泻叶(海安市中医院中药房,批号:20221008)生药量,称取后用约4 倍番泻叶体积的沸水浸泡番泻叶30 min,用纱布过滤网过滤药渣,再煎煮浓缩,制成生药含量为0.45 g/mL 的番泻叶药液。 称取一定质量的阿洛司琼(上海麦克林生化科技有限公司,批号:A125218),用纯水溶解最终配制成2 mg/mL 的浓溶液。 称取一定质量的乌来糖(上海源叶生物科技有限公司,批号:S30HS196618),用纯水溶解最终配制成20%的乌来糖溶液。 以上药液制备完成后放置于4 ℃冰箱保存备用,阿洛司琼使用时用纯水将2 mg/mL 的浓溶液稀释成1 mg/mL 的阿洛司琼溶液。
1.3 主要试剂及药品
Western 及IP 细胞裂解液、BCA 蛋白浓度定量试剂盒(上海碧云天生物技术有限公司,批号分别为:21309264、111622221213);5-HT ELISA 检测试剂盒(武汉Elabscience生物有限公司,批号:PA088P8J0805);5-HT3A 一抗(英国Abcam 公司,批号:1017902-1);GAPDH 单克隆抗体(美国Proteintech 公司,批号:00119680);HRP 山羊抗兔IgG二抗 (美国Cell Signaling Technology 公司,批号:C15140851)。
1.4 主要仪器
凝胶成像分析仪器、垂直电泳仪[伯乐生命医学产品(上海)有限公司,型号:Universal Hood Ⅱ、PowerPacTM Basic];酶标仪(美国伯腾仪器有限公司,型号:BioTek-Elx800);高通量组织研磨器(宁波新芝生物科技股份有限公司,型号:Scientz-48);电子分析天平(上海YEASEN 生物科技有限公司,型号:FA2004N);制冰机[斯科茨曼制冰系统(上海)有限公司,型号:AF100AS)];标准型旋转混匀仪、金属浴恒温器[大龙兴创实验仪器(北京)股份公司,型号分别为:MX-S、5012101200];台式低速离心机(湖南湘仪实验室仪器开发有限公司,型号:LX-100);低温高速离心机[赛默飞世尔科技(中国)有限公司,型号:D3024R];超纯水仪(南京易普易达科技发展有限公司,型号:PLUS-E2-10TJ);华佗牌毫针(苏州针灸用品厂,规格:0.25 mm×25 mm);华佗牌电针仪(苏州医疗用品有限公司,型号:SDZ-Ⅱ)。
2 方法
2.1 分组与造模方法
SD 雄性大鼠适应性喂养7 d 后开始进行实验,采用随机数字表法,将24 只大鼠随机分为4 组,分别为空白组、模型组、阿洛司琼组及电针组,每组各6 只。选择灌服番泻叶煎剂联合慢性束缚及避水应激建立IBS-D 动物模型。第1~21 天,将模型组、阿洛司琼组及电针组大鼠束缚在自制鼠瓶内,限制其活动,时长为2 h;第8~21 天,以上3 组大鼠束缚后灌服番泻叶溶液,给药体积为10 mL/kg;第15~21 天,在一个透明的塑料容器(73 cm×54 cm×44 cm)中心位置固定一个圆形平台(12 cm×12 cm×20 cm),在容器里加入室温以下的水,水面低于平台面1 cm,将大鼠放置在平台上1 h,并避免外界干扰,连续造模21 d。将每组大鼠分开放置于代谢笼中,分别记录各组大鼠6 h内排出的稀便数与总排便数。 以稀便率(稀便数/总排便数×100%)≥25%作为造模成功标准[9]。
2.2 干预方法
造模成功后,对空白组、模型组与电针组大鼠予以生理盐水按1 mL/100 g 体质量灌胃,对阿洛司琼组大鼠予以1 mg/mL 浓度的阿洛司琼溶液按1 mL/100 g 体质量灌胃,1 次/d,连续灌胃14 d。对电针组大鼠每日16:00 开始进行电针治疗,大鼠在5%异氟烷伴70%氮气和30%氧气诱导麻醉后,以1%~2%的浓度维持麻醉。取大鼠仰卧位,穴位定位参照《实验针灸学》[10]大鼠标准穴位图谱,选取实验大鼠的单侧足三里、天枢,次日选取对侧穴位。用0.25 mm×25 mm华佗牌毫针直刺,天枢直刺3 mm、足三里直刺5 mm后进行电针干预治疗,正极连天枢,负极连足三里,两毫针间隔超过0.5 mm 且不接触,避免短路。 电针参数为疏密波(疏波10 Hz/密波50 Hz),强度定于该治疗仪“1”档左右,频率2/100 Hz,电源电压9 V,电针时间15 min,1 次/d,连续治疗14 d。
2.3 大鼠内脏敏感性评估
腹壁回撤反射(abdominal wall retraction reflex,AWR)实验[11]:0 分为无行为反应,4 分为骨盆抬起、身体呈弓状,0~4 分随着大鼠结肠扩张时的行为表现增强而评分增加。具体过程如下:大鼠评分前18 h禁食不禁水,用乙醇棉片对大鼠肛门进行消毒,再将8 号导尿管前端用甘油进行润滑,然后将导尿管从大鼠肛门慢慢插入,直至球囊距肛门1 cm 左右时停止(应轻柔不可暴力),此时实验人员用手将导尿管与大鼠尾根部固定在一起。 待大鼠平静后用5 mL注射器连接好导尿管并向球囊内缓慢均匀注水使其扩张,观察并记录大鼠AWR 实验达到4分时所需的注水量。连续测量3 次,每次20 s,每次间隔5 min,最终结果取3 次测量结果的平均值。AWR 实验为相同施术者进行操作以减少实验误差。
2.4 样本采集与指标检测
2.4.1 动物取材 实验结束前1 天,各组大鼠禁食不禁水。 实验结束当天用20%乌来糖溶液进行麻醉,剂量按大鼠体质量1 mL/100 g 计算。 于大鼠颈动脉取血后,在离心机中以4 000 r/min 离心10 min(离心半径40 cm),分离血清。 再将标本放置-80 ℃冰箱保存,用于5-HT ELISA 试剂盒检测。解剖分离大鼠末端结肠,均剪取同一部位约1 cm 结肠末端组织,用生理盐水将结肠组织冲洗干净后;一半放置于浓度为10%的中性甲醛溶液中固定,用于结肠HE染色;另一半直接放置在1.5 mL 离心管并置于-80 ℃冰箱保存,用于Western blot 实验。
2.4.2 一般指标检测 (1)一般情况观察:观察每天各组大鼠外观、活动情况、情志等变化。(2)体质量增长率(%)=(2 周后的大鼠体质量-2 周前的大鼠体质量)/2 周前的大鼠体质量×100%。
2.4.3 粪便含水量 取小鼠的新鲜粪便,称取湿重(g),于烘箱烘干72 h 后再称取其干重(g)以计算粪便含水量。 粪便含水量(%)=(新鲜粪便-粪便干重)/新鲜粪便×100%。
2.4.4 HE 染色观察结肠组织形态 将4%多聚甲醛固定大鼠结肠组织经石蜡包埋、切片后,经过PBS、苏木精染液浸泡,清洗过后,再由酸性乙醇浸润,碳酸锂、伊红染液浸泡后由乙醇、二甲苯溶液浸泡封片后。 在光学显微镜下观察大鼠结肠组织形态病变情况。
2.4.5 血清中5-HT 浓度的测定 ELISA 法检测血浆中5-HT 含量。分别按照试剂盒操作步骤,检测血清中5-HT 含量的变化。
2.4.6 Western blot 验证目的蛋白含量的改变 (1)组织总蛋白的提取:用RIPA 裂解缓冲液提取大鼠结肠组织中的总蛋白。(2)蛋白含量测定:用BCA 蛋白定量试剂盒进行蛋白质定量。 (3)SDS-PAGE 电泳:电泳过后,将总蛋白转移至硝化纤维素膜上转膜过程90 min,转膜结束后将膜浸泡在含一抗(1∶1000)溶液中4 ℃孵育过夜,TBST 清洗后再与二抗(1∶1000)孵育2 h。最后,曝光后分析蛋白5-HT3AR 的相对表达量。
2.5 统计学方法
本研究使用GraphPad Prism 9.0 对实验数据进行统计。 数据差异比较采用单因素方差分析。 以P<0.05 表示差异具有统计学意义。
3 结果
3.1 各组大鼠一般情况观察
空白组实验期间活动正常,精神正常,毛发有光泽,反应敏捷,大便成型,肛门无粪染。 造模成功后的大鼠(模型组、阿洛司琼组、电针组)出现精神疲倦,活动减少,扎堆蜷缩于角落,易激惹,未见黏液血便,肛门可见不成形粪便黏附,粪染明显,垫料污染严重。 电针治疗期间及电针治疗后,模型组一般情况无明显改善;阿洛司琼组精神一般,较造模后好动,大便成形,为粪粒状;电针组精神良好,活动正常,毛色恢复光泽,大便干湿适中,为成形粪粒。
3.2 各组大鼠体质量增长率比较
与治疗前比较,治疗后空白组、模型组、阿洛司琼组及电针组体质量增长率显著降低(P<0.001);与空白组比较,模型组与阿洛司琼组体质量增长率降低(P<0.01,P<0.05);与模型组、阿洛司琼组大鼠比较,电针组大鼠的体质量增长率升高(P<0.05)。详见表1。
表1 各组大鼠体质量增长率变化(±s,%)

表1 各组大鼠体质量增长率变化(±s,%)
注:与治疗前比较,△△△P<0.001;与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05;与阿洛司琼组比较,&P<0.05。
组别空白组模型组阿洛司琼组电针组n6666治疗后0.090±0.004△△△-0.010±0.006△△△**0.010±0.014△△△*0.070±0.049△△△#&治疗前0.450±0.050 0.310±0.060 0.320±0.030 0.320±0.020
3.3 各组大鼠粪便含水量比较
与治疗前比较,电针组粪便含水量显著降低(P<0.01);与空白组比较,模型组及阿洛司琼组粪便含水量高(P<0.001,P<0.05);与模型组、阿洛司琼组比较,电针组的粪便含水量降低(P<0.001,P<0.05)。 详见表2。
表2 各组大鼠粪便含水量变化(±s,%)

表2 各组大鼠粪便含水量变化(±s,%)
注:与治疗前比较,△△P<0.01;与空白组比较,*P<0.05,***P<0.001;与模型组比较,##P<0.01;与阿洛司琼组比较,&P<0.05。
组别空白组模型组阿洛司琼组电针组n6666治疗前0.43±0.23 0.82±0.15 0.81±0.10 0.82±0.06治疗后0.37±0.12 0.82±0.06***0.66±0.10*0.42±0.09△△##&
3.4 各组大鼠肠道敏感性比较
与治疗前比较,治疗后空白组、模型组、阿洛司琼组及电针组大鼠肠道容量阈值差异无统计学意义(P>0.05);与空白组比较,模型组肠道容量阈值显著降低(P<0.001);与模型组比较,阿洛司琼组与电针组肠道容量阈值升高(P<0.05);与阿洛司琼组比较,电针组大鼠肠道容量阈值差异无统计学意义(P>0.05)。详见表3。
表3 各组大鼠肠道容量阈值变化(±s,mL)

表3 各组大鼠肠道容量阈值变化(±s,mL)
注:与空白组比较,***P<0.001;与模型组比较,#P<0.05。
组别空白组模型组阿洛司琼组电针组n6666治疗前2.63±0.15 1.67±0.42 1.47±0.42 1.60±0.35治疗后2.57±0.21 1.27±0.16***2.00±0.35#2.00±0.26#
3.5 各组大鼠结肠组织病理形态比较
空白组结肠黏膜上皮完整、吸收细胞呈柱状,上皮内混有少量杯状细胞,上皮下的隐窝排列规则、高度正常,隐窝内含大量杯状细胞,细胞密度适中。 模型组可见黏膜局部糜烂坏死,坏死灶疏松、毛细血管扩张、少量炎细胞浸润。阿洛司琼组可见隐窝局部坏死、间质疏松、毛细血管扩张充血、少量炎细胞浸润。电针组黏膜上皮完整,吸收细胞呈柱状,黏膜皱壁中可见炎细胞浸润,炎细胞主要是淋巴细胞和少量中性粒细胞。 与模型组比较,阿洛司琼组黏膜上皮完整,坏死范围明显减小。 与模型组比较,电针组上皮尚且完好,且无坏死灶。 与阿洛司琼组比较,电针组上皮完整,无坏死炎性损伤程度轻。 详见图1。

图1 各组大鼠结肠组织病理形态相比(HE,×200,标尺=50 μm)
3.6 各组大鼠血清中5-HT 含量比较
与空白组比较,模型组血清中5-HT 的含量上升(P<0.05);与模型组比较,电针组血清中5-HT 含量下降(P<0.05);与阿洛司琼组比较,电针组血清中5-HT 的含量差异无统计学意义(P>0.05)。详见表4。
表4 各组大鼠血清5-HT 含量(±s,ng/mL)

表4 各组大鼠血清5-HT 含量(±s,ng/mL)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组阿洛司琼组电针组n6666 5-HT 256.60±92.12 1 656.00±1 109.00*307.80±134.70 467.80±149.20#
3.7 各组大鼠结肠5-HT3AR 蛋白表达比较
与空白组比较,模型组结肠的5-HT3AR 蛋白表达升高(P<0.05);与模型组比较,阿洛司琼组和电针组结肠的5-HT3AR 蛋白表达均显著降低(P<0.001);与阿洛司琼组比较,电针组结肠5-HT3AR蛋白表达显著降低(P<0.001)。 详见图2、表5。
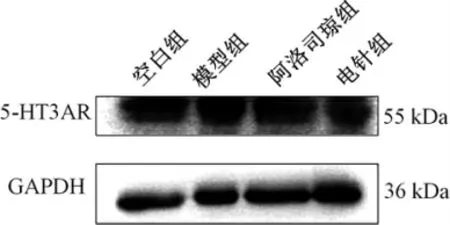
图2 各组大鼠结肠5-HT3AR 蛋白表达量结果
表5 各组大鼠结肠5-HT3AR 蛋白表达量(±s)

表5 各组大鼠结肠5-HT3AR 蛋白表达量(±s)
注:与空白组比较,*P<0.05;与模型组比较,###P<0.001;与阿洛司琼组比较,&&&P<0.001。
组别空白组模型组阿洛司琼组电针组n6666 5-HT3AR/GAPDH 2.04±0.16 2.32±0.11*1.76±0.07###1.29±0.04###&&&
4 讨论
IBS-D 病机复杂,内脏敏感性增高是其主要病理生理机制之一[12]。 慢性束缚应激可以导致大鼠神经内分泌和免疫系统紊乱,出现焦虑、抑郁等情绪障碍,进而影响内脏感觉传入神经的功能,导致内脏高敏感性[13]。结合课题组前期预实验,使用长期单一的慢性应激并不能稳定制备大鼠内脏高敏感模型。 避水应激作为一种急性应激源,可加重大鼠的心理压力,进一步加重内脏高敏感性[14]。以上两种手段结合造模结束后,各组大鼠结肠容量阈值较空白组显著降低,说明慢性束缚叠加避水应激成功诱导IBS-D大鼠的内脏高敏感性。番泻叶是一种天然的泻药,其主要成分为番泻苷,具有刺激肠道蠕动和分泌的作用。番泻叶灌胃后,番泻苷可以迅速吸收进入血液循环,作用于肠道平滑肌,增加肠道蠕动频率和力度,引发腹泻[15]。 用以上3 种方法相结合的造模方式造模结束后,与空白组大鼠相比各实验组大鼠的粪便含水量显著升高,说明本实验成功建立IBS-D 大鼠模型。研究表明,针刺对IBS-D 患者具有显著的治疗效果,但其机制并不明确[16]。5-HT 是一种重要的神经递质,与肠道运动和内脏感觉功能密切相关。在IBS-D患者中,5-HT 含量与受体5-HT3AR 蛋白表达异常升高,导致出现肠道动力学紊乱和腹泻症状[17]。 本研究发现,电针可以显著降低IBS-D模型大鼠血清中5-HT 含量,并下调IBS-D 模型大鼠结肠5-HT3AR蛋白表达。同时,提高IBS-D 模型大鼠的体质量,降低其粪便含水量及其内脏敏感性,改善IBS-D 模型大鼠的状态,为电针治疗IBS-D 提供实验依据。 阿洛司琼是一种选择性5-HT3 受体拮抗剂,通过阻断肠道神经元上的5-HT3 受体,减少5-HT 在肠道中的生物活性,从而达到缓解腹泻的作用[18]。这与本研究中电针治疗IBS-D 的机制相似,为电针治疗IBSD 提供了有效的参照。电针作为一种非药物疗法,具有副作用小、安全性高的特点,在各方面相较于阿洛司琼具有一定的优势。
中医学将IBS-D 归属于“腹痛”“腹胀”“泄泻”等中焦失养范畴,病位以脾胃、大小肠为主,五脏六腑气机失调是此病发病的关键[19]。 IBS-D 初期病机为肝失疏泄、气机紊乱引发肝气乘脾烦胃,继则脾胃失职,清扬不升,浊阴不降,肠腑失司,泄泻不止。 脾为气血生化之源,后期病机为脾虚日久,脾阳亏虚,肾阳失于温煦,疾病由虚转实,绵延难愈。 中医论治,先辨其脏腑,IBS-D 病在胃肠,胃肠属六腑,六腑泻而不藏,以通为用,其病多实。 所以,IBS-D 的中医治疗原则是通降腑气以治疗胃肠实证。 针灸在调虚实、通气机等方面,有重要作用。 而腧穴的选择是针灸处方的第一组成要素,与针灸的治疗效果直接相关。 腧穴的选择主要涵盖选穴原则和配穴方法两部分。 在选穴原则方面,可以从临证选穴的原因入手。天枢属足阳明胃经,为大肠的募穴。张景岳注释《素问·六微旨大论篇》写道“枢,枢机也。 居阴阳升降之中,是为天枢”,说明天枢有调节情志、和胃止痛、健脾止泻的功效,可用于治疗腹痛、便秘、腹泻等胃肠病[20]。 足三里为下合穴,属足阳明胃经,《素问·咳论篇》云:“治腑者,治其合。 ”说明下合穴是治疗腑病的关键, 故足三里可以作为调理胃肠的腧穴。此外《灵枢·五乱》提及:“气在于肠胃者……不下者,取之三里。”也解释了此穴可引腑气下行,调三焦腑气,治肚腑疾病[21]。
本研究从配穴方法的角度出发,对“同经异腑合募配穴”法进行深入的剖析和探索。 《灵枢·本输》记载“大肠小肠,皆属于胃,是足阳明也”,提示IBS-D可以通过足阳明胃经治疗[22]。古今多有医家记载“合募配穴”的协同作用,但此次选用的“同经异腑合募配穴”法也能体现相互配合、疏通经脉、提高疗效、易于操作等优势。 下合穴其位居于下,纵向作用于内腑,偏于通降。 足三里为胃经的下合穴,有降胃气之效。 《会元针灸学·足阳明胃经》曰:“天枢者………清气达胃府,上通肺金,转浊气通肠部,故名‘天枢’。”说明天枢具有转运胃气入肠腑的功效。足三里与天枢相配,调畅胃经上胃腑与下肠腑气机的通畅,一上一下,一远一近,升降气机,斡旋上下,气机通畅,阴阳相合,可有效改善IBS-D 患者腹痛、腹泻与情志不舒的症状,这与当代医学所提倡的舒缓情志的方式相契合[23]。在此之前,“合募配穴”法是治疗肠道疾病的常用方法之一。 合募配穴是指将本腑的下合穴与募穴相配。所以,单纯的胃腑疾病一般取胃的合募两穴:中脘和足三里。 但根据已有研究发现,此二穴在病理条件下,对胃的运动和内脏感觉基本是无异的[24],二者配伍也并未达到“1+1>1”的效果[25]。基于对IBS-D 的辨脏腑分析,该病并非是单纯的胃腑疾病,故本实验针对IBS-D 病位的不单一性提出一种新型的“合募配穴”,也就是用同经异腑的合募相配,比如用大肠经的募穴配伍胃经的下合穴或者用胃经的募穴和大肠经的下合穴相配。 此前也有大数据显示,天枢、足三里是治疗IBS 常用穴中的首要穴位[26]。 最终,本实验在“合募配穴”的指导思想下,秉承着针灸“辨证与辨经相结合”的诊治原则,提出了“同经异腑合募配穴”法,选择用电针刺激足阳明胃经的天枢、足三里,以期为电针提高IBS-D 的临床疗效奠定良好的基础与可供借鉴的思路。
本实验提出“同经异腑合募配穴”法治疗IBS-D,有效降低了IBS-D 模型大鼠的内脏高敏感,缓解其腹痛、腹泻症状。 在前人的临床研究中发现,针灸可以降低IBS-D 患者的血清5-HT 水平[27],与本实验结果相一致,证明针灸在调节5-HT 水平方面具有普遍性。通过研究发现,对于5-HT 这一通路的深入研究,大多数是探究针灸对于5-HT 上游合成通路的影响[28],而本研究则是首次探究电针对于IBS-D模型大鼠5-HT3AR 这一5-HT 受体的调控作用,这为今后进一步探讨针灸调节IBS-D 的机制提供了方向。随着人们对健康认识的深化,针灸的补泻手法走进大众的视野中, 目前通过补泻手法提高IBS-D的疗效的机制尚不明确,未来可以结合“同经异腑合募配穴”法进一步展开研究,希望本实验能为往后的学者提供相关领域的研究方向
综上,本实验结果显示,经过“同经异腑合募配穴”法进行电针干预治疗后,IBS-D 模型大鼠血清中5-HT 含量及结肠5-HT3AR 蛋白表达均显著降低,提示“同经异腑合募配穴”电针法对IBS-D 患者可能表现出更好的临床疗效,这为日后电针治疗IBS-D提供新的实验依据和实验思路。
