岩黄连总生物碱对四氯化碳诱导肝纤维化大鼠的改善作用研究
2024-01-10黄曙院黄华萍沈新辉孙东琪陆世银
覃 妮,黄曙院,周 柳,黄华萍,沈新辉,周 琳,孙东琪,陆世银*
柳州市中医医院(柳州市壮医医院),中药(壮瑶药)制剂研发重点实验室,中药(壮瑶药)制剂开发工程技术研究中心,广西 柳州 545026
肝纤维化(hepatic fibrosis, HF)是诸多慢性肝病病情发展的共同病理特征,是多种致病因素导致肝内结缔组织异常增长的肝内弥散性细胞外基质(extracellular matrix, ECM)过度淤积的病理过程,若未采取及时有效的治疗,将会导致肝硬化、肝癌的发生[1-3]。岩黄连Corydalis saxicola Bunting 为罂粟科紫堇属多年生草本植物,被收载于《广西中药材标准》,主要生长在广西、云南以及贵州的山区,其性凉、味苦,功效为清热解毒、消肿、利湿、止痛、止血等[4-5]。 现代药理学研究表明,岩黄连具有抗炎镇痛[6-8]、抗氧化[9-10]、保肝[11-13]等作用。 虽然,目前研究表明岩黄连总生物碱(total alkaloids from Corydalis saxicola Bunting,TACS)可以保肝护肝、改善肝脏功能,然而,有关其抗HF 的作用与机制鲜见报道。 为此,基于前期研究,本研究以联苯双酯为阳性对照药物,采用四氯化碳(carbon tetrachloride, CCl4)诱导建立大鼠HF 模型,进一步探讨TACS 在大鼠模型中的抗HF 作用及其可能机制,为岩黄连抗HF 药物的研究与开发提供科学依据。
1 实验材料
1.1 动物
SPF 级雄性SD 大鼠48 只,体质量100~140 g,购于湖南斯莱克景达实验动物有限公司。 动物饲养于通风条件良好,12 h 光照昼夜循环,温度20~25 ℃,相对湿度45%~60%的环境中。 动物生产许可证号:SCXK 湘2019-0004,动物使用许可证号:SYXK 桂2019-0001。动物实验伦理批号:GXMU2010032418。自由摄食标准饲料与蒸馏水。
1.2 药物与试剂
岩黄连药材(广西仙茱中药科技有限公司,批号20190701),经柳州市中医医院中药师张洪平主任鉴定为罂粟科紫堇属植物岩黄连Corydalis saxicola Bunting全草。 联苯双酯(北京协和药厂,批号:200606);橄榄油(山东鲁花集团商贸有限公司,批号:20190711);CCl4(天津博迪生化股份有限公司,批号:20210422);丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(super oxide dismutase, SOD)与谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)检测试剂盒(南京建成生物工程研究所,批号分别为20210419、20210420、20210417、20210418、20210420、20210420、20210418);4%多聚甲醛(广州赛国生物科技有限公司,批号21235935);HE 染色液(北京索莱宝科技有限公司,批号20210419);Masson 染色液(北京索莱宝科技有限公司,批号20210707);透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin, LN)、Ⅲ型前胶原(typeⅢprocollagen, PCⅢ)及Ⅳ型胶原(collagen Ⅳ, Ⅳ-C)酶联免疫分析试剂盒(武汉贝茵莱生物科技有限公司,批号均为20220310);转化生长因子β1(tran-s forming growth factor-β1, TGF-β1)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-8(interleukin-8, IL-8)及白细胞介素-6(interleukin-6, IL-6)酶联免疫分析试剂盒(武汉华联科生物技术有限公司,批号均为202104);其他试剂均为国产分析纯。
1.3 主要仪器
Bio-Rad iMark 酶标仪(上海伯乐生命医学产品有限公司,型号:Bio-Rad 680);电热恒温水浴锅(宁波新芝生物科技股份有限公司,型号:SC-20);高速低温离心机(长沙湘锐离心机有限公司,型号:TGD-20MC);电子天平(上海恒平科学仪器有限公司,型号:JY2002);制冰机(常熟雪科制冷设备有限公司,型号:IMS-130)。 旋转蒸发器(上海亚荣生化仪器公司,型号:RE-52);荧光成像系统[赛默飞世尔科技(中国)有限公司,型号:Invitrogen EVOS M5000];台式离心机(上海卢湘仪离心机仪器有限公司,型号:TD5);超纯水器(北京普析通用仪器有限责任公司,型号:GWB-1)。
2 方法
2.1 TACS 的制备
将岩黄连药材置于鼓风干燥箱中,50 ℃烘干2 h,粉碎至约1.5 cm,称取1 000 g,首次加入10 倍量75%乙醇,浸泡30 min,加热回流提取2 h,趁热过滤,重复提取1 次,合并两次滤液,旋转蒸发器真空浓缩所得醇提液至1 g/mL(真空度-0.085~-0.095 Mpa,温度65 ℃),加入4 000 mL 1%盐酸水溶液回流提取1 h,趁热过滤,取滤液加入40%NaOH 调节pH 值至中性,浓缩至相对密度为1.06~1.08,4 ℃静置48 h 后过滤,滤渣用16 倍量的1%盐酸水溶液回流1 h,趁热过滤,滤液加入40% NaOH 调节pH 值至中性,浓缩至相对密度为1.06~1.08,4 ℃静置48 h 后过滤,滤渣冷冻,真空干燥,即得TACS 粉末,提取完成后置于干燥器中备用。
2.2 分组、造模及给药
大鼠适应性饲养1 周后,随机分为正常组、模型组、TACS 低/中/高剂量(25、50、100 mg/kg)组[14]和联苯双酯(阳性对照,30 mg/kg,加适量生理盐水配制成浓度为30 mg/mL)组,每组8 只。除正常组大鼠腹腔注射橄榄油(0.1 mL/100 g)外,其余各组分别于大鼠腹腔注射30% CCl4橄榄油混合液(0.1 mL/100 g)以制备HF 模型[15],2 次/周,连续12 周。 各给药组在造模第11 周按设定剂量(1.0 mL/100 g) 给予大鼠灌胃相应药物,正常组和模型组灌胃等体积生理盐水,1 次/d,连续2 周。 实验期间大鼠自由摄食饮水,每天观察各组大鼠活动情况,每周称定质量1次。所有大鼠末次给药后,禁食同时自由饮水24 h。大鼠经3%苯巴比妥钠腹腔注射麻醉后, 腹主动脉采血,3 500 r/min 离心15 min 取血清,于-80 ℃超低温冰箱保存待检。采集血样后颈椎脱臼处死大鼠,取出肝脏和脾脏,并用预冷生理盐水清洗后,滤纸拭干,称重,计算肝(脾)脏指数,肝(脾)脏指数(%)=肝(脾)脏质量/体质量×100%[16]。 取适量肝组织进行组织病理学检查,其余肝脏置于-80 ℃超低温冰箱保存待用。
2.3 各组大鼠肝组织病理学观察
取肝脏组织右叶同一位置约1 cm3大小,以4%多聚甲醛液固定,常规脱水,石蜡包埋,切片(厚度约为3 μm),经二甲苯脱蜡、酒精常规逐级脱水,苏木精染液染色,洗掉多余的染液后用0.5%盐酸酒精分色,分别行伊红染液染色和Masson 丽春红复红液染色,再次酒精常规逐级脱水,二甲苯透明后采用中性树胶封片,于显微镜下观察肝组织病理学变化。
2.4 各组大鼠血清相关指标的检测
取分离好的大鼠血清,采用比色法检测血清中ALT、AST、TP、ALB、MDA、SOD 的含量;采用ELISA 检测血清中HA、LN、PCⅢ、Ⅳ-C、TGF-β1、IL-1β、IL-8及IL-6 的水平。上述指标均严格遵照检测试剂盒指南步骤操作,并于酶联免疫检测仪上测定。
2.5 统计学方法
采用SPSS 20.0 软件对数据进行统计分析,计量资料通过“±s”表示。所有资料均作正态性检验和方差齐性检验,满足正态分布,多组间比较当满足方差齐性时采用单因素方差分析检验,各组间均数多重比较采用Tukey 检验;当方差不齐时,采用Welch和Dunnett's T3 检验,P<0.05 为差异有统计学意义。
3 结果
3.1 TACS 对CCl4 诱导HF 大鼠体质量和脏器指数的作用
正常组大鼠毛色、精神状态、摄食、排便及体质量增长在实验期间均正常。 与正常组相比,模型组大鼠毛发有轻微脱落且明显变黄,精神衰弱,食欲不振,便稀,体质量增长显著缓慢。 而TACS 低、中、高剂量组和联苯双酯组大鼠毛色、精神状态、摄食和体质量增长等较模型组明显改善。 相比于正常组,模型组大鼠实验后体质量较小、肝脏指数和脾脏指数显著升高(P<0.01);增长幅度与联苯双酯组比较,TACS 高剂量组体质量升高(P<0.05)。 与模型组比较,TACS 中、高剂量组及联苯双酯组大鼠肝脏指数显著降低(P<0.05,P<0.01);且TACS 高剂量组优于联苯双酯的作用(P<0.01);TACS 低、中、高剂量组和联苯双酯组均能显著降低HF 大鼠的脾脏指数(P<0.05,P<0.01),TACS 高剂量组下调脾脏指数效果优于联苯双酯组(P<0.05)。TACS 对CCl4诱导HF 大鼠体质量和脏器指数的作用呈现良好的剂量依赖性。详见表1。
表1 TACS 对CCl4 诱导HF 大鼠肝脾指数的影响(±s,n=8)
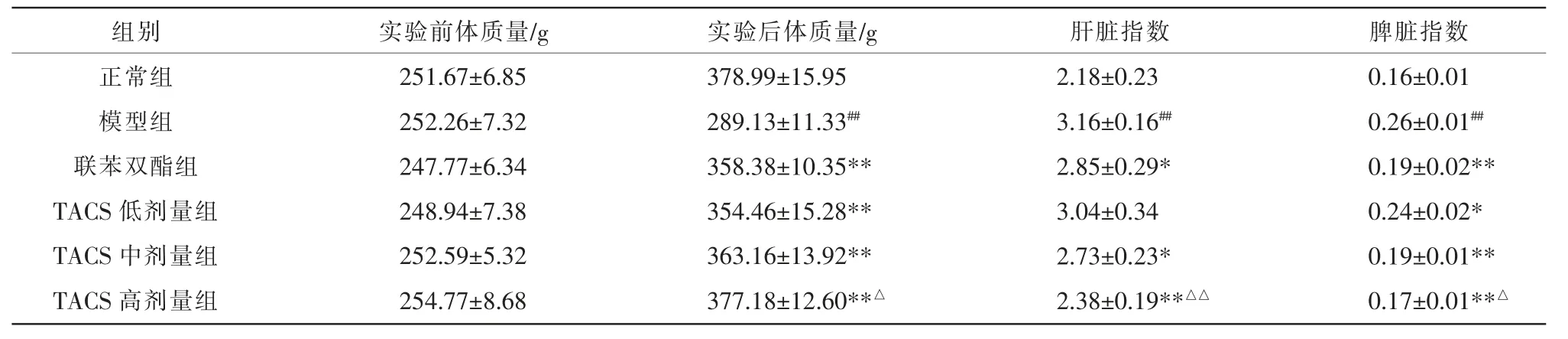
表1 TACS 对CCl4 诱导HF 大鼠肝脾指数的影响(±s,n=8)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与联苯双酯组比较,△P<0.05,△△P<0.01。
组别正常组模型组联苯双酯组TACS 低剂量组TACS 中剂量组TACS 高剂量组实验前体质量/g 251.67±6.85 252.26±7.32 247.77±6.34 248.94±7.38 252.59±5.32 254.77±8.68实验后体质量/g 378.99±15.95 289.13±11.33##358.38±10.35**354.46±15.28**363.16±13.92**377.18±12.60**△肝脏指数2.18±0.23 3.16±0.16##2.85±0.29*3.04±0.34 2.73±0.23*2.38±0.19**△△脾脏指数0.16±0.01 0.26±0.01##0.19±0.02**0.24±0.02*0.19±0.01**0.17±0.01**△
3.2 TACS 对CCl4 诱导HF 大鼠血清生化指标的影响
与正常组相比,模型组大鼠血清中ALT、AST 水平明显上升(P<0.01),TP 与ALB 水平显著下降(P<0.01),表明CCl4造成了大鼠肝损伤。相较于模型组,TACS 低、中、高剂量组和联苯双酯组均能明显下调大鼠血清中ALT 和AST 含量(P<0.01),并能显著提高血清TP、ALB 水平(P<0.05,P<0.01)。 此外,相较于联苯双酯组,TACS 中、 高剂量组对ALT、AST、TP与ALB 调控改善作用更强(P<0.05,P<0.01),且TACS各剂量组间呈良好的量效相关性。 结果表明TACS具有良好的保肝及改善肝功能作用。 详见表2。
表2 各组大鼠血清中ALT、AST、TP 和ALB 的水平(±s,n=8,U·L-1)

表2 各组大鼠血清中ALT、AST、TP 和ALB 的水平(±s,n=8,U·L-1)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与联苯双酯组比较,△P<0.05,△△P<0.01。
组别正常组模型组联苯双酯组TACS 低剂量组TACS 中剂量组TACS 高剂量组ALT 16.91±5.94 113.97±8.27##53.24±3.72**97.64±12.41**△△33.60±7.43**△△10.62±2.59**△△AST 14.58±4.97 53.07±9.58##36.60±9.26**36.16±3.70**23.36±3.32**△△15.86±4.08**△△TP 46.01±1.54 38.46±1.68##44.18±3.10**40.92±1.76*46.97±1.57**50.22±1.78**△△ALB 30.09±0.81 24.49±1.43##26.98±2.43*27.69±2.36*29.82±1.56**△32.34±1.01**△△
3.3 TACS 对CCl4 诱导的HF 大鼠血清中HA、LN、PCⅢ和Ⅳ-C 表达的调控作用
与正常组比较,模型组血清中HA、LN、PCⅢ和Ⅳ-C 水平显著升高(P<0.01);与模型组比较,经TACS干预后,各组血清中HA、LN、PCⅢ和Ⅳ-C 含量呈下降趋势或明显下降(P<0.05,P<0.01),且TACS 改善作用呈现良好的剂量依赖性,同时TACS 中、高剂量组抑制HA、LN、PCⅢ和Ⅳ-C 水平效果优于联苯双酯组(P<0.05,P<0.01)。 详见表3。
表3 各组大鼠血清中HA、LN、PCⅢ和Ⅳ-C 的水平(±s,n=8,ng·mL-1)

表3 各组大鼠血清中HA、LN、PCⅢ和Ⅳ-C 的水平(±s,n=8,ng·mL-1)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与联苯双酯组比较,△P<0.05,△△P<0.01。
组别正常组模型组联苯双酯组TACS 低剂量组TACS 中剂量组TACS 高剂量组HA 98.21±9.04 215.96±8.07##153.26±7.72**177.64±12.31**△△133.60±8.44**△△112.73±10.59**△△LN 104.68±14.97 253.09±9.78##206.60±9.17**208.16±13.24**173.36±9.42**△△145.83±14.12**△△PCⅢ66.23±6.56 178.65±11.96##144.18±13.15**140.94±15.06**106.84±11.57**△△93.24±14.78**△△Ⅳ-C 202.09±13.84 324.47±12.42##286.98±15.17*307.69±12.76 269.92±16.75**△236.62±18.07**△△
3.4 TACS 对CCl4 诱导HF 大鼠血清SOD、MDA 及GSH-Px 水平的影响
模型组大鼠血清MDA 水平明显高于正常组(P<0.01),而SOD 与GSH-Px 水平明显低于正常组(P<0.01)。相较于模型组,TACS 中、高剂量组和联苯双酯组MDA 水平明显降低(P<0.05,P<0.01),同时大鼠血清SOD 水平明显上调(P<0.01),TACS 各剂量组大鼠血清中GSH-Px 表达水平升高(P<0.01)。 此外,TACS 中、高剂量组对SOD、MDA 及GSH-Px 调控效果优于联苯双酯组(P<0.01)。 结果显示TACS可通过抗氧化活性发挥保肝、护肝的作用。 详见表4。
表4 TACS 对CCl4 诱导HF 大鼠血清SOD、MDA 及GSH-Px 水平的影响(±s,n=8,U·L-1)
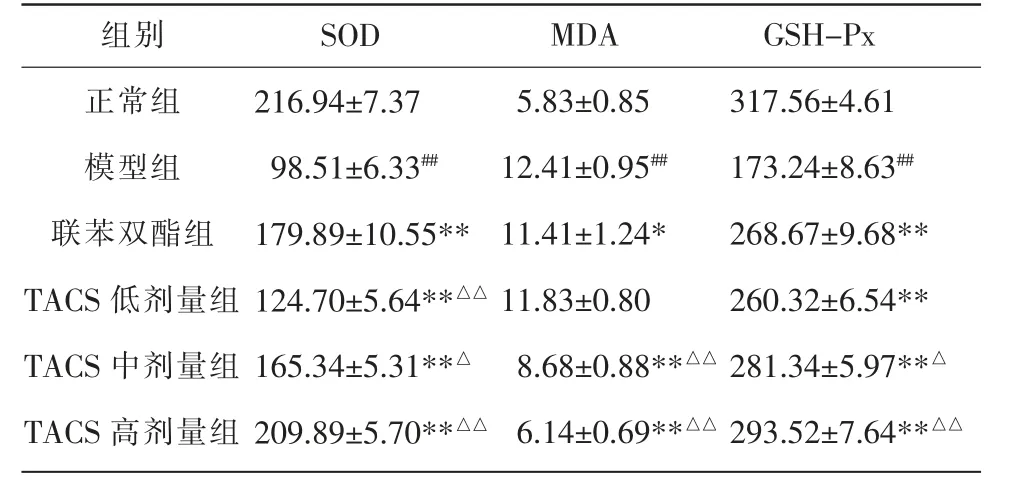
表4 TACS 对CCl4 诱导HF 大鼠血清SOD、MDA 及GSH-Px 水平的影响(±s,n=8,U·L-1)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与联苯双酯组比较,△P<0.05,△△P<0.01。
组别正常组模型组联苯双酯组TACS 低剂量组TACS 中剂量组TACS 高剂量组SOD 216.94±7.37 98.51±6.33##179.89±10.55**124.70±5.64**△△165.34±5.31**△209.89±5.70**△△MDA 5.83±0.85 12.41±0.95##11.41±1.24*11.83±0.80 8.68±0.88**△△6.14±0.69**△△GSH-Px 317.56±4.61 173.24±8.63##268.67±9.68**260.32±6.54**281.34±5.97**△293.52±7.64**△△
3.5 TACS 对CCl4 诱导HF 大鼠血清促炎因子与促纤维因子的调节作用
相比于正常组,模型组大鼠血清促纤维因子TGF-β1,促炎因子IL-1β、IL-8 和IL-6 水平显著提高(P<0.01)。 与模型组相比较,经TACS 低、中、高剂量干预均能显著抑制TGF-β1、IL-1β、IL-8 和IL-6的表达(P<0.05、0.01)。 此外,与联苯双酯组比较,TACS 中、高剂量组的TGF-β1、IL-1β、IL-8 和IL-6的表达水平下降更明显(P<0.01),且TACS 各组呈现剂量依赖性。结果提示TACS 可通过调节免疫,下调促炎细胞因子的水平及抑制促纤维因子表达从而发挥抗HF 的作用。 详见表5。
表5 MCAE 对CCl4 诱导HF 大鼠血清中TGF-β1、IL-1β、IL-8 及IL-6 的调控作用(±s,n=8,pg·mL-1)

表5 MCAE 对CCl4 诱导HF 大鼠血清中TGF-β1、IL-1β、IL-8 及IL-6 的调控作用(±s,n=8,pg·mL-1)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与联苯双酯组比较,△P<0.05,△△P<0.01。
组别正常组模型组联苯双酯组TACS 低剂量组TACS 中剂量组TACS 高剂量组TGF-β1 131.39±13.75 218.78±19.32##185.40±16.77**179.79±10.35**137.21±7.03**△△119.16±10.05**△△IL-1β 76.56±5.41 109.15±8.51##94.25±8.07**100.35±5.72*73.24±8.96**△△60.78±4.03**△△IL-8 67.34±3.12 89.07±5.75##81.14±8.36*76.11±5.49**65.27±5.01**△△57.61±4.22**△△IL-6 76.40±6.48 105.71±7.46##88.52±7.85**98.07±3.62*△74.20±7.32**△△59.61±7.71**△△
3.6 TACS 对CCl4 诱导HF 大鼠肝组织病理变化的影响
HE 染色显示,正常组大鼠肝小叶结构均匀完整,肝细胞排列清晰整齐且未见小胆管及纤维组织增生。相比于正常组,模型组大鼠肝小叶出现明显的结构模糊,细胞排列紊乱,局灶肝细胞点状坏死增加、炎症细胞浸润及充血病变,纤维化明显。 TACS 低、中、高剂量组及联苯双酯组对CCl4所致大鼠肝组织中肝小叶结构完整性、炎症坏死及纤维化病变均有所改善,且TACS 干预作用效果呈剂量依赖性,其中TACS 高剂量组较于联苯双酯组改善效果更为明显。 详见图1。

图1 TACS 对CCl4 致HF 大鼠肝组织病理变化的改善作用(HE,×100,标尺=50 μm)
Masson 染色显示,正常组大鼠肝组织无被染成蓝色的纤维,未见病理性改变,而模型组明显可见广泛致密蓝色胶原沉积,肝脏汇管区和中央静脉周围纤维组织增生明显,且纤维间隔增厚,部分已出现假小叶及胶原纤维束。 与模型组比较,TACS 各剂量组有不同程度的改善与逆转,胶原纤维增生范围显著减少,其中以TACS 高剂量组治疗效果最佳。 详见图2。

图2 TACS 对CCl4 致HF 大鼠肝组织病理形态学的影响(Masson,×100,标尺=100 μm)
4 讨论
HF 是由遗传、代谢、病毒、损伤等原因引起慢性肝病的关键特征,若未采取有效干预手段,其进一步发展可导致肝硬化甚至肝衰竭、肝癌等致命性肝脏疾病,HF 也是影响慢性肝病预后的重要环节,严重影响患者健康及生存质量[17]。 HF 的病理学基础为ECM 的合成异常增多而降解减少,导致胶原在肝脏中过度沉积。 目前,普遍认为肝星状细胞(hepatic stellate cell, HSC)是肝脏合成ECM 的主要细胞[18]。 HSC 的激活和增殖是HF 的最终共同途径,在HF的病理生理过程的作用尤为关键,是HF 发生、发展的中心环节[19-20]。 然而,目前现代医学尚未找到良好的治疗HF 的方法。 中医中药以其对HF 的良好预防和治疗效果、低毒性反应等特点,目前已引起越来越多学者的关注与重视。 岩黄连为岭南地区治疗肝病的特色植物药,有研究发现岩黄连具有抗氧化、保肝及改善肝功能的作用,然而,有关其抗HF 的作用与机制尚未明确。 基于此,本实验将MCAE 对CCl4诱导的HF 大鼠进行药效评价及可能作用机制开展初步研究。
CCl4是一种典型的实验动物HF 模型诱导剂,CCl4在体内以肝脏为靶向,破坏肝细胞,其引起毒性三氯甲基自由基激发炎症反应,激活HSC 后生成大量ECM,最终导致严重肝损伤[21]。 ALT、AST 是评价肝损伤的标志,目前极为广泛地应用于肝损伤判断[22]。在机体中,当自由基参与脂质过氧化反应时,其最终产物为MDA,而MDA 异常升高可致细胞膜结构遭受严重损坏,进而发生细胞肿胀与坏死[23]。 一般而言,机体通过减少自由基水平并将其清除、重塑损伤及上调抗氧化酶表达这一系列抗氧化防御系统来发挥自身保护作用。其中SOD 作为关键的抗氧化酶之一,对自由基具有良好的清除作用,从而抑制脂质过氧化反应物的生成[24]。 GSH-Px 具有抗氧化活性,在体内发挥维持机体氧化与抗氧化的稳态,起到抵御自由基的作用,具有保护肝组织的功能[25]。本研究造模12 周后,病理组织学显示,模型组大鼠肝脏出现显著的损伤与纤维化,血清ALT、AST 含量明显升高,ALB、TP 水平显著下降。 经不同剂量的TACS、联苯双酯干预治疗后,上述血清生化指标、肝组织病理损伤及纤维化病变均具有较大程度的改善。 同时,TACS 可修正CCl4导致的大鼠血清脂质过氧化产物MDA 水平增加和SOD 水平降低。 提示调节脂质代谢、改善肝脂质过氧化损伤以及提高抗氧化酶活性是TACS 保肝作用的机制之一。
HA 作为由HSC 合成的ECM 的主要成分,机体血清中HA 浓度异常升高可反映其过度分泌;LN 为HSC 合成的一种糖蛋白,在HF 病理进展中,血清LN含量与纤维化严重程度高度相关;体内合成胶原蛋白时,PCⅢ经酶诱导释放到血清中,常作为判断ECM沉积程度;IV-C 是肝组织ECM 的重要组成部分,其血清水平与HF 严重度呈正相关[26-27]。因此,血清HA、LN、PCⅢ和IV-C 的含量可作为HF 的诊疗指标。本实验结果显示,与模型组比较,TACS 干预可有效降低HF 大鼠血清中HA、LN、PCⅢ和Ⅳ-C 水平,提示TACS对CCl4诱导的大鼠HF 具有良好的抑制作用。
据文献报道,绝大多数肝病的发展进程中均涉及程度各异的氧化应激反应[28]。 氧化应激反应所生成的产物可用于肝细胞,引起大分子如脂质、蛋白质等物质的变性,使其细胞膜、亚细胞器的结构被破坏后造成延续性氧化损伤;同时激活枯否细胞,活化的枯否细胞引起炎症因子(如IL-1β、IL-8 和IL-6等)的大量释放,这些炎症因子可直接刺激HSC 的活化与增殖[29-30];而活化后的HSC 导致ECM 过度形成与沉积,并会产生促HF 因子,该因子以反馈性调节自身或周围HSC 细胞群体的形式,稳定并增强肝脏纤维化状态。 因此,炎症因子的释放水平能够体现肝内氧化应激反应水平[31]。本研究表明,模型组大鼠相较于正常组,其肝组织中IL-1β、IL-8 和IL-6 的表达水平均明显增加,差异均有统计学意义,证实了HF 与炎症反应密切相关。 与模型组比较,TACS 各剂量组和联苯双酯组大鼠肝组织中IL-1β、IL-8 和IL-6的水平均显著下降,差异均有统计学意义。 说明TACS 可通过抑制促炎细胞因子IL-1β、IL-8 和IL-6 的表达而发挥抗HF 的作用。 此外,TGF-β1 作为极具代表性的促HF 因子,在HSC 的激活和HF进展过程中担当重要作用;高水平的TGF-β1 可调节相关基因转录引起ECM 过度表达并沉积,诱导或加速HF 发展,故有效抑制TGF-β1 表达是逆转HF 形成的重要手段之一[32-33]。
综上所述,TACS 对CCl4诱导的HF 模型大鼠具有一定的保护作用,其作用机制可能与调节脂质代谢、改善脂质过氧化损伤、抗氧化应激反应、抑制炎症因子及促纤维因子TGF-β1 表达等相关。 岩黄连主要分布于我国南方地区,在壮族民间,其已成为用于治疗肝炎、肝硬化和肝癌等疾病的常用药材。目前已研制有注射液和片剂等中成药制剂,是临床治疗肝炎特别是乙型肝炎、肝硬化、肝癌的有效药。近年研究发现,TACS 作为岩黄连主要有效成分,具有保肝及改善肝功能之功效,但是其抗HF 的作用研究尚不充分。 本研究采用多项指标探讨了TACS对HF 模型大鼠的改善调节作用,同时还对其机制进行了较为全面的考察,为TACS 抗HF 的开发利用奠定了科学依据,但其具体作用机制仍有待后续深入研究。
