不同缺氧干预对低压低氧模型鼠血气及红细胞相关指标的影响
2024-01-09钱庆元潘锦超杨军王仁杰罗凯马增春李茂星高月
钱庆元,潘锦超,杨军,3,王仁杰,3,罗凯,3,马增春,李茂星,3,高月
1.兰州大学药学院,甘肃 兰州 730000
2.军事科学院军事医学研究院辐射医学研究所,北京 100850
3.甘肃中医药大学药学院,甘肃 兰州 730000
我国具有世界上海拔最高、面积最大和居住人口最多的高原[1],低压低氧导致的各种高原病制约着我国高原地区经济、社会和国防建设的发展,高原缺氧损伤机制及防治药物研究逐步成为国内外科研热点[2-3]。不同于缺血缺氧等生理性缺氧研究,高原缺氧损伤研究不仅需要低氧,而且涉及低压实验环境。然而,一方面限于地理、交通限制,我国4000 m 以上的高原实地实验室有限,另一方面常用啮齿类动物缺氧耐受性优于哺乳动物,急慢性缺氧损伤模型往往需要将动物置于6000 m 以上实验环境[4]。因此基于模拟高原低压低氧实验舱的“高原问题平原研究”成为当前高原医学研究的普遍范式[5-8]。
急性高原病的主要诱因是缺氧,动脉血血气分析可以快速准确地检测动脉血中酸碱度、血氧、电解质及代谢物等变化,有利于指导缺氧早期的诊断、治疗及远期的预后[9-10]。然而人体血气指标非常敏感,极易受到体内外众多因素的影响,临床血气测定具有严格的操作规范。缺氧大鼠进行动脉血气测定时需要降低海拔,或者脱离缺氧环境,再进行麻醉采集动脉血。由于氧气和二氧化碳的扩散速度极快,仅需0.3 s左右即可完成肺部气体交换[11],故从出舱到采血测定间复氧时间的长短对PO2、PCO2、酸碱度等血气指标可能会造成影响。本研究通过模拟高原低压低氧大鼠模型,比较不同缺氧时间、不同缺氧模式、缺氧后常氧恢复、缺氧预适应等干预对模型大鼠血气指标检测值的影响,以期为正确测定及解读模拟高原缺氧大鼠血气指标提供参考。
1 材料与方法
1.1 实验动物、主要试剂与仪器
雄性SD 大鼠,体重为(200±10)g,购自北京维通利华实验动物技术有限公司。所有大鼠均在标准环境条件下饲养:温度(22±2)℃,相对湿度(55±5)%,光照与黑暗各12 h 循环。动物许可证号:SCXK(京)2021-0011。研究方案通过军事科学院动物伦理委员会审查(IACUC-DWZX-2023-P595),动物实验和操作按照《实验动物护理和使用指南》进行。
戊巴比妥(57-33-0)为美国Sigma 公司产品;肝素钠(20220527)为国药集团化学试剂有限公司产品;乙酰唑胺(RH102875)为上海易恩化学技术有限公司产品;DGDR-10Ⅱ型干式电化学法血气生化测试卡(W36417401H)和血气测试包(W45117127H)为广州万孚生物技术有限公司产品。
模拟高原低压低氧大型实验舱、模拟高原低压低氧小型动物舱均为贵州风雷军州风雷航空军械有限责任公司产品;BGA-102 便携式血气生化分析仪为广州万孚生物技术有限公司产品;血细胞分析仪为希森美康医用电子上海有限公司产品;ME-204 分析天平为梅托勒-托利多仪器上海有限公司产品。
1.2 干预措施及实验方案
预实验筛选缺氧条件。在课题组前期实验的基础上,分别选择7000、6500、6000 m 进行3 d缺氧试验,并测定大鼠血气指标。综合实验数据,在兼顾存活率和缺氧损伤效果的基础上,最终采用6500 m海拔高度进行实验。
1.2.1 不同缺氧时间干预 将40 只SD 雄性大鼠按体重随机分为四组,分别为对照组和缺氧1、3、4 d组,每组10只,分笼饲养并标记。对照组置于动物饲养室(海拔50 m)正常饲养,缺氧各组分别置于模拟高原低压低氧小型动物舱中,设定模拟高原缺氧海拔为6500 m,在缺氧相应时间后降低海拔、打开舱门,按2.8 mL/kg腹腔注射2%戊巴比妥,立即采集大鼠动脉血进行红细胞、血红蛋白及血气测定。
1.2.2 不同缺氧模式干预 将50 只SD 雄性大鼠按体重随机分为五组,每组10 只,分笼饲养并标记。其中对照组置于动物饲养室(海拔50 m)正常饲养。
小舱给药组提前每天灌胃给予乙酰唑胺100 mg/kg,连续3 d;小舱不给药组灌胃给予同体积等渗氯化钠溶液。3 d 后,上述两组置于模拟6500 m 海拔高原低压低氧小型动物舱中,缺氧72 h 后降低海拔、打开舱门,按2.8 mL/kg 腹腔注射2%戊巴比妥,立即采集大鼠动脉血进行红细胞、血红蛋白及血气测定。
大舱给药组提前每天灌胃给予乙酰唑胺100 mg/kg,连续3 d;大舱不给药组灌胃给予同体积等渗氯化钠溶液。3 d 后,两组大鼠置于模拟6500 m 海拔高原低压低氧大型实验舱中,缺氧72 h 后,实验人员进入缓冲舱,缓冲舱海拔以5 m/s 速度升高到3500 m,动物舱海拔下降到3500 m 时两者打通。实验人员进入动物舱,在舱内采集动脉血通过传递窗运出氧舱,并在舱外进行红细胞、血红蛋白及血气测定。
1.2.3 不同复氧时间干预 将40 只SD 雄性大鼠按体重随机分为四组,每组10 只,分笼饲养并标记。其中对照组置于动物饲养室(海拔50 m)正常饲养。另三组大鼠置于模拟高原低压低氧小型动物舱中,在模拟6500 m 海拔高度缺氧72 h后降低海拔、打开舱门。其中0 h 复氧组立即按2.8 mL/kg 腹腔注射2%戊巴比妥,采集动脉血;6 h 复氧组复氧恢复6 h 后同法麻醉,采集动脉血;72 h 复氧组复氧恢复72 h 后同法麻醉,采集动脉血。各组动脉血进行红细胞、血红蛋白及血气测定。
1.2.4 缺氧预适应干预 将30 只SD 雄性大鼠按体重随机分为三组,每组10 只,分笼饲养并标记。其中对照组置于动物饲养室(海拔50 m)正常饲养。另两组置于模拟高原低压低氧小型动物舱中,在模拟6500 m 海拔高度缺氧72 h后降低海拔、打开舱门。其中非预适应组立即按2.8 mL/kg腹腔注射2%戊巴比妥,采集动脉血;预适应组复氧恢复72 h 后,再次模拟6500 m 缺氧72 h,大鼠取出后,立即麻醉,采集动脉血。各组动脉血进行红细胞、血红蛋白及血气测定。
1.3 血气生化分析仪测定血气分析指标
缺氧完成后,从氧舱中取出大鼠,用2%戊巴比妥按2.8 mL/kg剂量腹腔注射麻醉后,将动物固定于手术台,剪开腹腔,采用1 mL 肝素化注射器采集腹主动脉血0.5~0.8 mL,采集完成后立即用橡皮封闭,5 min 内接入DGDR-10Ⅱ型干式电化学法血气生化测试卡,在BGA-102 便携式血气生化分析仪上检测酸碱度、PCO2、乳酸、PO2、氢离子浓度、实际碳酸氢根、标准碳酸氢根、标准碱剩余、实际碱剩余、缓冲碱、SO2和PO2/FIO2等指标。
1.4 血细胞分析仪测定红细胞数和血红蛋白含量
各组经腹主动脉采血1 mL于肝素抗凝管,上下轻倒,使其充分抗凝,用血细胞分析仪进行分析,测定红细胞数和血红蛋白含量。
1.5 统计学方法
采用Graphpad Prism 8软件对数据进行处理,数据以均数±标准差()表示,用单因素或双因素方差进行统计分析,P<0.05为有统计学意义。
2 结果
2.1 不同缺氧时间对低压低氧模型鼠血气和红细胞相关指标的影响
与对照组比较,缺氧大鼠PO2和PO2/FIO2值升高(均P<0.01),且缺氧1 d 与缺氧4 d 差异具有统计学意义(均P<0.01),见表1。结果提示,大鼠缺氧时间长者损伤更大,出舱后复氧更严重。
表1 不同缺氧时间各组血气分析和红细胞相关指标检测结果比较Table 1 Effects of different hypoxia time on blood gas and erythrocyte-related indicators in rats(,n=10)

表1 不同缺氧时间各组血气分析和红细胞相关指标检测结果比较Table 1 Effects of different hypoxia time on blood gas and erythrocyte-related indicators in rats(,n=10)
与对照组比较,*P<0.05,**P<0.01;与缺氧1 d 组比较,##P<0.01.PO2:血氧分压;SO2:血氧饱和度;FiO2:吸入气中的氧浓度分数;PCO2:二氧化碳分压;:碳酸氢根.1 mmHg=0.133 kPa.
与对照组比较,缺氧大鼠酸碱度、PCO2、实际碳酸氢根、标准碳酸氢根、标准碱剩余、实际碱剩余、缓冲碱值随缺氧时间延长而减少(均P<0.01),氢离子浓度随缺氧时间延长而增加(P<0.01),部分指标缺氧1 d与4 d差异也具有统计学意义(均P<0.05),见表1。结果提示,缺氧会造成大鼠酸碱平衡紊乱,且缺氧时间长者酸碱平衡紊乱更严重。
与对照组比较,缺氧大鼠红细胞数和血红蛋白含量随缺氧时间延长而增加,第3 天差异有统计学意义(P<0.01),且缺氧4 d 与缺氧1 d 差异也有统计学意义(P<0.01),见表1。结果提示,缺氧会导致大鼠红细胞数和血红蛋白含量增加,且缺氧时间长者增加更多。
2.2 不同缺氧模式对低压低氧模型鼠血气和红细胞相关指标的影响
与小舱不给药组比较,大舱不给药组PO2和SO2显著降低(均P<0.01)。与不给药组比较,给药组PO2、SO2和PO2/FIO2值有所降低,其中大舱组SO2尤为显著(均P<0.01),见表2。结果提示,小型动物舱缺氧大鼠出舱后的复氧情况更严重,而乙酰唑胺能缓解出舱后的复氧情况。
表2 不同缺氧模式各组血气分析和红细胞相关指标检测结果比较Table 2 Effects of different hypoxia models on blood gas and erythrocyte-related indicators in rats(,n=10)

表2 不同缺氧模式各组血气分析和红细胞相关指标检测结果比较Table 2 Effects of different hypoxia models on blood gas and erythrocyte-related indicators in rats(,n=10)
与对照组比较,**P<0.01;与小舱给药组比较,#P<0.05,##P<0.01;与小舱不给药组比较,△P<0.05,△△P<0.01;与大舱不给药组比较,▲P<0.05,▲▲P<0.01.PO2:血氧分压;SO2:血氧饱和度;FiO2:吸入气中的氧浓度分数;PCO2:二氧化碳分压;:碳酸氢根.1 mmHg=0.133 kPa.
与小舱不给药组比较,大舱不给药组酸碱度、乳酸值增加(P<0.05或P<0.01),氢离子浓度减少(P<0.05)。与不给药组比较,给药组部分指标恢复(P<0.05或P<0.01),见表2。结果提示,与大型实验舱比较,小型动物舱导致的酸碱平衡紊乱可能更严重,而乙酰唑胺能缓解缺氧大鼠酸碱平衡紊乱。
小舱给药组与不给药组、大舱给药组与不给药组红细胞数和血红蛋白含量差异均无统计学意义(均P>0.05),且均明显多于对照组(均P<0.05),见表2,提示不同的缺氧模式及给予乙酰唑胺对红细胞数及血红蛋白含量影响不大。
2.3 常氧恢复时间对低压低氧模型鼠血气分析和红细胞相关指标的影响
与对照组比较,0 h 复氧组和6 h 复氧组大鼠PO2、SO2和PO2/FIO2值均有所增加(P<0.05或P<0.01),随复氧时间延长而减少,72 h复氧组仅SO2与对照组差异有统计学意义(P<0.05),见表3。结果提示,常氧恢复能缓解缺氧大鼠出舱后的复氧情况。
表3 不同常氧恢复时间各组血气分析和红细胞相关指标检测结果比较Table 3 Effects of normoxic recovery on blood gas and erythrocyte-related indicators in rats(,n=10)
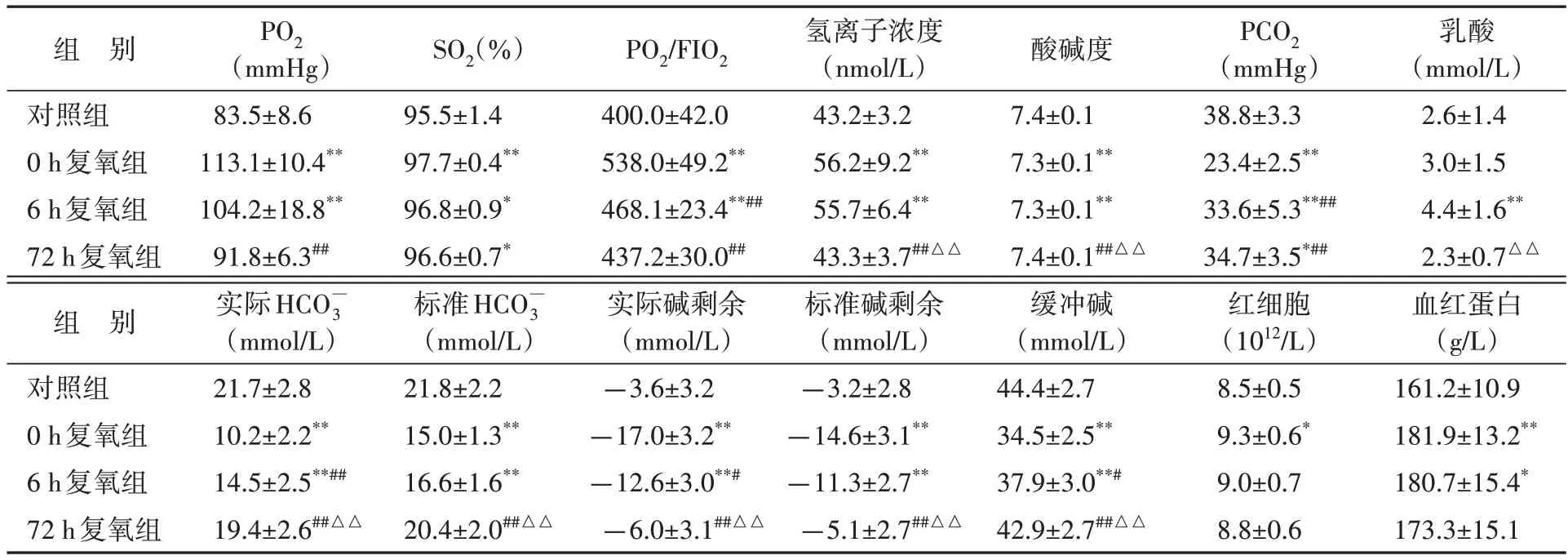
表3 不同常氧恢复时间各组血气分析和红细胞相关指标检测结果比较Table 3 Effects of normoxic recovery on blood gas and erythrocyte-related indicators in rats(,n=10)
与对照组比较,*P<0.05,**P<0.01;与0 h复氧组比较,#P<0.05,##P<0.01;与6 h复氧组比较,△△P<0.01.PO2:血氧分压;SO2:血氧饱和度;FiO2:吸入气中的氧浓度分数;PCO2:二氧化碳分压:碳酸氢根.1 mmHg=0.133 kPa.
与对照组比较,0 h 复氧组和6 h 复氧组大鼠酸碱度、PCO2、实际碳酸氢根、实际碱剩余、缓冲碱、标准碳酸氢根、标准碱剩余降低(均P<0.01),氢离子浓度显著增加(均P<0.01),与0 h 复氧组比较,72 h复氧组酸碱度、PCO2、实际碳酸氢根、实际碱剩余、缓冲碱、标准碳酸氢根、标准碱剩余均显著增加(均P<0.01),氢离子浓度显著减少(P<0.01)。与6 h复氧组比较,72 h复氧组氢离子浓度、乳酸显著降低(均P<0.01),酸碱度、实际碳酸氢根、实际碱剩余、缓冲碱、标准碳酸氢根、标准碱剩余显著增加(均P<0.01),见表3。结果提示,常氧恢复能缓解缺氧导致的大鼠酸碱平衡紊乱。
与对照组比较,复氧组红细胞数和血红蛋白含量均有所增加,但随着复氧时间延长各指标有所恢复,其中72 h 复氧组与对照组差异均无统计学意义(均P>0.05),见表3。结果提示,常氧恢复能改善缺氧引起的红细胞和血红蛋白含量增加。
2.4 缺氧预适应对低压低氧模型鼠血气和红细胞相关指标的影响
预适应组与非预适应组PO2、SO2和PO2/FIO2差异均无统计学意义(均P>0.05),且均较对照组增加,见表4,提示缺氧预适应对缺氧后复氧情况的改善效果不明显。
表4 是否缺氧预适应各组血气分析和红细胞相关指标检测结果比较Table 4 Effects of hypoxia preconditioning on blood gas and erythrocyte-related indicators in rats(,n=10)
与对照组比较,*P<0.05,**P<0.01;与非预适应组比较,#P<0.05,##P<0.01.PO2:血氧分压;SO2:血氧饱和度;FiO2:吸入气中的氧浓度分数;PCO2:二氧化碳分压;:碳酸氢根.1 mmHg=0.133 kPa.
与非预适应组比较,预适应组酸碱度、实际碳酸氢根、实际碱剩余、标准碱剩余、缓冲碱、标准碳酸氢根均增加(均P<0.05),氢离子浓度减少(P<0.01),见表4,提示缺氧预适应能缓解缺氧导致的酸碱平衡紊乱。
与非预适应组比较,预适应组红细胞数和血红蛋白含量减少,其中红细胞数与对照组差异无统计学意义(P>0.05),见表4,提示缺氧预适应能在一定程度改善缺氧引起的大鼠红细胞数及血红蛋白含量增加。
3 讨论
动脉血血气分析是判断机体缺氧状况和抗缺氧治疗、药物有效性的核心指标。一般根据PO2及SO2判断缺氧及通气情况,根据酸碱度、PCO2、碱剩余判断酸碱失衡[12-13]。在医学教学和科研中,经常采用大鼠作为实验动物,其具有生长快、生命周期短、生理学和行为学特征与人类相似等特征[14]。建立高原低压低氧大鼠模型并通过血气分析判断缺氧损伤情况应用较为广泛。低压低氧模型鼠血气分析的正确测定及合理解读,对于高原缺氧模型的建立及评价至关重要。但当前大鼠的动脉血气分析仍存在很多困难,且目前也尚未有研究系统阐释不同缺氧干预对血气分析结果的影响。
由于大鼠无创血气分析还不成熟,现在几乎都需要麻醉后采集动脉血进行测定。戊巴比妥麻醉会对呼吸造成一定影响,导致常氧大鼠血气PO2低于生理正常值。较常氧大鼠,缺氧大鼠血液PO2、SO2和PO2/FIO2值随缺 氧时间 延长而 增加,这种异常与血气采集需要在复氧环境中进行有关:缺氧后复氧大鼠存在过度换气现象,在心肺组织无结构性损伤的前提下,过度换气会吸入更多的空气,增加肺泡换气效率。同时缺氧导致血液红细胞和血红蛋白增多,复氧后能够快速捕捉更多的氧气,增加SO2。红细胞和血红蛋白的这一变化可能是缺氧预适应的理论基础。过高的红细胞和血红蛋白有利于急性缺氧适应,但长期会导致红细胞增多症等慢性高原病[15]。
在缺氧环境中,氧分压下降刺激呼吸中枢,触发低氧通气的驱动,导致呼吸加深加快,从而使PCO2减少,可能会引起低碳酸血症和呼吸性碱中毒。在缺氧状态下,二氧化碳的生成量超过了耗氧量,导致二氧化碳排出量/摄氧量上升,细胞由有氧代谢转变为无氧代谢产生乳酸[16],促使动物血液酸碱度值减小[17]。酸碱度值超出正常范围提示存在失衡,但酸碱度值正常仍可能有酸碱失衡。碱剩余可以代表体内碱储备的增加与减少,超出正常提示有代谢酸失衡[18-19]。本文资料显示,相比常氧大鼠,缺氧大鼠血液酸碱度、PCO2、实际碳酸氢根、标准碳酸氢根、实际碱剩余、标准碱剩余、缓冲碱值随缺氧时间延长而减少,氢离子浓度和乳酸含量随缺氧时间延长而增加,动物体内处于代谢性酸中毒状态[20]。
大鼠6500 m 缺氧后,在3500 m 海拔采集血样,仍然存在复氧和过度换气的问题。但由于3500 m 海拔的氧分压和氧浓度只有平原地区的65%。所以即使复氧,PO2也不会超过对照组。而体内乳酸经肝脏代谢后由肾分泌排泄,短期过度换气不能改变体内的乳酸情况。缺氧恢复组大鼠氧合状态指标较缺氧3 d 组低但仍大于对照组,说明氧分压下降,过度换气的应激反应有所缓解,但并没有完全恢复。从相关血气指标的变化可以看出,3 d 的恢复期基本纠正了缺氧3 d 对酸碱平衡的破坏。缺氧预适应后再缺氧大鼠的氧合状态血气指标值与缺氧大鼠相差不大,说明应激性过度换气仍然存在,但预适应能在一定程度上减轻缺氧造成的酸碱平衡紊乱。
随着高原缺氧研究的不断推进,现有的模拟低压低氧范式大量使用,但大鼠的血气分析结果不尽相同。理论上大鼠缺氧后氧分压等氧合指标应下降,但因复氧后过度换气和红细胞、血红蛋白增加等问题会导致与理论相反的结果出现。由于体内酸碱平衡主要通过肾脏进行调节,受复氧环境中短时间内的过度换气影响不大,所以更能反映模拟高原缺氧大鼠血气真实情况,可能更适用于大鼠缺氧损伤程度和相关药效评价。
综上所述,高原缺氧会引起一系列复杂的病变,涉及呼吸系统、循环系统和血液系统等的变化,其中血液学变化与肺、心和大脑等重要器官均有关联。本研究采用血气分析指标探究不同缺氧条件对大鼠生理功能的影响,并重点关注了动物脱离氧舱后的复氧问题,试图在血液学指标方面对其缺氧损伤机制提供基础数据,以期有助于促进高原缺氧损伤诊断和治疗的研究进程。但本研究存在样品数量少和分析比较的血气指标较少等问题,在今后的研究中需要通过扩大样本量,并辅助血常规、血生化等技术手段进一步验证缺氧对大鼠血气的影响,为稳定的大鼠缺氧损伤模型建立以及客观评价提供参考。
志谢研究得到军队中医药服务能力培育与提升专项计划(2021ZY009)支持
AcknowledgementsThis work was supported by the Special Plan for Cultivating and Improving the Service Capability of Traditional Chinese Medicine in the Army(2021ZY009)
利益冲突所有作者均声明不存在利益冲突
Conflict of InterestsThe authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)
