肝细胞脂肪变性影响巨噬细胞炎症反应加速动脉粥样硬化形成
2024-01-09李越吴希泽潘嘉祥宫丽鸿闵冬雨
李越,吴希泽,潘嘉祥,宫丽鸿,闵冬雨
1.辽宁中医药大学附属医院心内科,辽宁 沈阳 110032
2.南通市中医院重症医学科,江苏 南通 226000
3.辽宁中医药大学研究生院,辽宁 沈阳 110847
4.辽宁中医药大学附属医院中医药实验中心,辽宁 沈阳 110032
慢性病是慢性非传染性疾病,通常起病隐匿、病程长、迁延不愈、病因复杂。慢性病之间存在复杂联系,有些常相伴发生。数据显示,2014年美国约有59.6%的成年人同时患有两种及以上的慢性病[1];2015 年英国慢性病共病率为54%,预计到2035 年将增长至67.8%[2];我国2014 年共病率为58.1%[3]。与非共病患者比较,共病患者的死亡风险增加(HR:1.73,95%CI:1.41~2.13)[4]。动脉粥样硬化是老年人最常见的疾病之一,在我国60岁以上的人群中发病率高达79.9%[5]。最新临床研究表明,NAFLD 与亚临床动脉粥样硬化的多种标志物之间有很强的相关性[6]。一项包括33 例NAFLD 患者和52 名对照的研究显示,在16.6 年的随访中,NAFLD 患者主要心血管不良事件的发生率明显高于对照组[7]。因此,依照单病种指南制订的针对特定疾病的诊断和治疗方案,可能并不适用于共病的老年人。
探索共病的发病机制有助于明确慢性病共病的特点,指导临床治疗和共病管理。NAFLD 是由于肝细胞内脂肪过度沉积所致,而脂代谢异常同时也是动脉粥样硬化的危险因素,提示脂代谢在动脉粥样硬化和NAFLD 共病的发病机制中可能起着重要的作用[8]。同时,脂质积聚使肝脏长期处于炎症浸润状态,肝脏会通过分泌促炎性细胞因子和趋化因子引起主动脉内皮细胞的炎症反应,导致血管内皮功能障碍和血管壁的增厚和硬化,从而增加动脉粥样硬化和心血管疾病的风险[9-10]。本研究运用代谢组学和网络药理学的技术和方法,拟从动脉粥样硬化和NAFLD 共病模型小鼠与正常小鼠的差异代谢产物中挖掘动脉粥样硬化和NAFLD 共病相关基因,并通过体外实验进一步验证,探讨共病模式下NAFLD 影响动脉粥样硬化发生发展的生物学机制。
1 材料与方法
1.1 材料、试剂及仪器
无特定病原级野生型C57BL/6J 小鼠6 只,ApoE-/-小鼠6只,均为雄性,5~6 周 龄,体重(18±2)g,购于辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2020-0001。在12 h 光照/12 h 黑暗循环下将小鼠圈养在标准温度(20±2)℃和湿度(50%±10%)条件下。研究方案通过辽宁中医药大学附属医院动物伦理委员会审查[2022CS(DW)-015-01]。
小鼠RAW264.7巨噬细胞(Cat.CL-0190)购自赛百慷(上海)生物技术股份有限公司;小鼠NCTC1469 正常肝细胞(Cat.CL-0407)购自武汉普诺赛生命科技有限公司。
HE 染色液(Cat.G1004)和油红O 染色液(Cat.G1262)为武汉赛维尔生物科技有限公司产品;Bodipy 493/503(Cat.1912X200515)为上海懋康生物科技有限公司产品;抗CD11b(Cat.PTM-6088)为杭州景杰生物科技股份有限公司产品;Alexa Fluor 594-山羊抗兔IgG(H+L)(Cat.AS039)为武汉爱博泰克生物科技有限公司产品;总胆固醇测定试剂盒(Cat.A111-1-1)、三酰甘油测定试剂盒(Cat.A110-1-1)、HDL-C测定试剂盒(Cat.A112-1-1)、LDL-C 测定试剂盒(Cat.A113-1-1)、ox-LDL 试剂盒(Cat.H248-1-2)、ALT 测试盒(Cat.C009-2-1)和AST 测试盒(Cat.C010-2-1)为南京建成生物工程研究所有限公司产品;CCK-8 试剂盒(Cat.K10185133EF5E)为美国APE×BIO 公司产品;抗荧光衰减封片剂(含DAPI)(Cat.S2110)和4%组织细胞固定液(Cat.P1110)为北京索莱宝科技有限公司产品;ox-LDL(Cat.YB-002)为广州奕源生物科技有限公司产品;胎牛血清(Cat.10099141)和DMEM(1×)(Cat.30044333)为美国Thermo Fisher Scientific 公司产品;青霉素-链霉素溶液(100×)(Cat.C0222)、活性氧检测试剂盒(DCFH-DA)(Cat.S0033s)和线粒体膜电位检测试剂盒(Rhodamine 123)(Cat.C2008S)为上海碧云天生物技术有限公司产品;游离胆固醇检测试剂盒(Cat.ATTOC3001)和总胆固醇检测试剂盒(细胞)(Cat.ATTOC3001)为亚科因生物技术有限公司产品。
酶标仪(Epoch)为美国BioTek Instruments 公司产品;全自动生化分析仪(TBA-120FR)为东芝医疗系统(中国)有限公司产品;组织包埋机(EG 1150H)为德国Leica 公司产品;倒置荧光显微镜(Eclipse Ci)为尼康精机(上海)有限公司产品;高速冷冻微量离心机(D3024R)为大龙兴创实验仪器(北京)股份公司(DragonLab)产品;荧光定量PCR仪(CFX Connect)为伯乐生命医学产品(上海)有限公司产品;PCR 仪器(ETC811)为苏州东胜兴业科学仪器有限公司(Eastwin)产品;超高效液相色谱-高分辨质谱联用仪(Orbitrap Exploris 120)为美国Thermo Fisher Scientific 公司产品。
1.2 代谢组学检测共病模型小鼠差异代谢产物
1.2.1 实验动物分组及造模 6 只野生型C57BL/6J小鼠为正常组,6只ApoE-/-小鼠进行造模为模型组。小鼠适应性喂养1 周后,正常组给予正常饮食,自由饮水;模型组给予喂饲高脂饮食(60%脂肪、20%蛋白质、20%碳水化合物)16周,构建肝脏脂肪变性模型和动脉粥样硬化模型[9]。
小鼠喂饲16周高脂饮食后,剖取胸主动脉组织进行HE 染色、油红O 染色、Bodipy 和CD11b 共定位染色,取小鼠血清进行血脂水平检测,出现脂质斑块和血脂异常即动脉粥样硬化模型构建成功;剖取肝脏,观察外观及进行HE 染色、油红O染色,取小鼠血清进行肝功能检测,若肝脏脂肪变性和肝功能异常即肝脏脂肪变性模型构建成功。
1.2.2 HE 染色观察主动脉和肝脏病理组织学改变 将主动脉、肝脏进行石蜡切片,逐步脱蜡,苏木素中浸染8~15 min,洗去苏木素和浮色1~2 min,分化,流水中洗涤30~60 min,伊红液中浸染2~5 min,脱水,透明,封固后烤干,显微镜下观察拍照。
1.2.3 油红O 染色观察主动脉和肝脏脂质积蓄情况 将主动脉、肝脏进行冰冻切片,滴加油红O染液,10 min 后去掉染液,70%乙醇分化,蒸馏水洗,显微镜下观察并拍照。
1.2.4 Bodipy 和CD11b 荧光检测巨噬细胞内胆固醇水平 主动脉石蜡切片,采用CD11b 一抗孵育,4 ℃过夜,Bodipy 493/503 在室温下避光孵育1 h。磷酸盐缓冲液浸洗三次,孵育荧光二抗,含DAPI 的抗荧光淬灭封片剂封片,荧光显微镜拍照[11]。
1.2.5 血生化分析仪检测小鼠血脂及肝功能指标 取小鼠血清,按照各试剂盒检测操作步骤处理标本并加样,采用酶标仪进行测定。
1.2.6 液相色谱-质谱检测共病模型小鼠代谢组学指标 小鼠高脂饮食饲养16周后,腹主动脉取血,获得小鼠血清,845×g离心15 min,取上清液,-80 ℃冻存备用。4 ℃ 解冻,标本涡旋1 min,混合均匀;移取适量标本于2 mL 离心管中;加入400 μL 甲醇溶液(-20 ℃保存),涡旋1 min;4 ℃下13 523×g离心10 min,取全部上清液转移至新的2 mL 离心管中,浓缩干燥;准确加入150 μL 80%甲醇水配制的2-氯-L-苯丙氨酸(4 mg/L)溶液(4 ℃保存)复溶,取上清液于0.22 μm 膜过滤,过滤液加入检测瓶中,送上海派森诺生物科技有限公司进行液相色谱-质谱检测。
1.2.7 处理代谢组学指标数据 利用内标归一化对代谢组学检测数据进行处理,在样品中加入一个或多个内标物,然后用样品中所有代谢物对应的峰面积除以该样品中对应的内标物峰面积得到一个相对值,即代谢组学基础数据。对代谢组学代谢组学基础数据归一化处理后的结果进行Student’st检验、PCA、PLS-DA 和OPLS-DA 的多元变量统计分析,以P<0.05且符合变量投影重要度值>1为标准筛选有差异的代谢物。
1.3 网络药理学分析共病模型小鼠差异代谢产物作用机制
1.3.1 筛选差异代谢产物靶点 在PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取差异代谢产物中前二十种化合物的SDF 和SMILES结 构,并导入SwissTargetPrediction(http://www.swisstargetprediction.ch/),物种选 择“Homo sapiens”,筛选出“Probability”≥10%的作用靶点,合并删除重复后获得差异代谢产物的靶点。
1.3.2 筛选动脉粥样硬化和NAFLD 共病靶点以“atherosclerosis”、“non-alcoholic fatty liver disease”为关键词,分别在Gencards(https://www.genecards.org/)、OMIM(https://omim.org/)、DisGeNET(https://www.disgenet.org/)数据库进行检索,Gencards 选取“Relevance score”≥1.0,DisGeNET 选取“Score_gda”≥0.1 的靶点。于Uniprot 数据库(https://www.uniprot.org)将靶点蛋白信息转化为“Uniprot ID”,分别合并且删除重复靶点后,取动脉粥样硬化和NAFLD交集靶点。
1.3.3 构建PPI 网络和筛选核心靶点 将获取的差异代谢产物的前二十种化合物的作用靶点与疾病靶点取交集,即差异代谢产物可能作用于动脉粥样硬化和NAFLD 的潜在作用靶点。将交集靶点导入STRING 数据库(https://www.stringdb.org/),物种选择“Home sapiens”,“score”≥0.7,下载tsv 格式导入CytoscapeV3.8.2 软件(https://www.string-db.org/),获取PPI 网络。运用CytoNCA插件(https://apps.cytoscape.org/apps/cytonca)对网络进行拓扑学分析,筛选出计算点度中心性、介度中心性和接近中心性均大于平均值的靶点为核心靶点。
1.3.4 KEGG 富集分析 将交集靶点导入David数据库(https://david.abcc.ncifcrf.gov/),物种选择“Home sapiens”,选择“official gene symbol”进行KEGG 分析,并运用微生信在线绘图网站(http://www.bioinformatics.com.cn/)实现可视化。
1.4 体外实验验证共病模型病理机制
1.4.1 分组和处理 模型组造模条件的筛选:运用不同浓度梯度的游离脂肪酸[油酸与棕榈酸浓度比分别为0.00/0.00、0.16/0.08、0.32/0.16、0.62/0.31、1.25/0.63、2.50/1.25、5.00/2.50、10.00/5.00(mmol/L)/(mmol/L)]干预NCTC1469 细胞24 h,进行油红O 染色和CCK-8 检验,根据半数致死率和油红O 染色面积确认造模浓度。用不同浓度梯度的ox-LDL(0.0、12.5、25.0、50.0、100.0、200.0 μg/mL)干预RAW264.7 细胞24 h,进行油红O染色和胆固醇酯含量的检测,根据泡沫细胞、胆固醇酯水平和油红O染色面积确定造模浓度。
体外实验共分为八组:①RAW264.7 对照组(CR 组):予10%胎牛血清+DMEM 高糖培养基培养,不予其他处理;②RAW264.7模型组(MR 组):予10%胎牛血清+DMEM 高糖培养基培养,采用50.0 μg/mL ox-LDL 进行泡 沫细胞诱导24 h;③NCTC1469 对照组(CN 组):予10%胎牛血清+DMEM 高糖培养基培养,不予其他处理;④NCTC1469 模型组(MN 组):予10%胎牛血清+DMEM 高糖培养基培养,采用游离脂肪酸[油酸/棕榈酸=1.25/0.63(mmol/L)/(mmol/L)]进行肝细胞脂肪变性诱导24 h;⑤对照NCTC1469 细胞与对照RAW264.7 细胞共培养组(CN+CR 组):NCTC1469 接种在六孔板下层,并在其上嵌入已经贴壁生长的RAW264.7 细胞小室,共同培养;⑥NCTC1469 模型组细胞与RAW264.7 对照细胞共培养组(MN+CR 组):NCTC1469接种在六孔板下层,待游离脂肪酸诱导其脂肪变性后,换液,并在其上嵌入已经贴壁生长的RAW264.7 细胞小室,共同培养;⑦对照NCTC1469 细胞与模型RAW264.7 细胞共培养组(CN+MR 组):予10%胎牛血清+DMEM 高糖培养基培养NCTC1469 细胞,予10%胎牛血清+DMEM 高糖培养基培养,采用50 μg/mL ox-LDL 进行泡沫细胞诱导24 h后,两种细胞共同培养;⑧模型NCTC1469 细胞与模型RAW264.7 细胞共培养组(MN+MR 组):予10% 胎牛血清+DMEM 高糖培养基培养NCTC1469 细胞后,采用游离脂肪酸[油酸/棕榈酸=1.25/0.63(mmol/L)/(mmol/L)]进行肝细胞脂肪变性诱导24 h,同时予10%胎牛血清+DMEM高糖培养基培养,采用50.0 μg/mL ox-LDL 对RAW264.7 细胞进行泡沫细胞诱导24 h 后,两种细胞共同培养。共培养体系采用六孔板Transwell,肝细胞和巨噬细胞在实验前均用磷酸盐缓冲液清洗。
1.4.2 油红O 染色观察肝细胞和巨噬细胞脂质沉积情况 将NCTC1469、RAW264.7 细胞培养于六孔板细胞爬片,磷酸盐缓冲液冲洗三次,4%多聚甲醛固定20 min,室温下采用油红O 试剂盒对细胞进行染色,按说明书操作。显微镜观察,采用Image J软件进行统计。
1.4.3 CCK-8 法检测细胞活性 细胞以2×105个/孔为密度接种在96 孔板中,用不同浓度的游离脂肪酸及ox-LDL处理NCTC1469、RAW264.7细胞24 h,换液,每孔重新加入100 μL 培养液和10 μL CCK-8 试剂,37 ℃孵育2 h,按试剂说明书设置空白孔,酶标仪450 nm 波长下测量吸光度值。
1.4.4 试剂盒检测胆固醇酯含量 采用游离胆固醇含量检测试剂盒和总胆固醇检测试剂盒测量细胞脂质水平,胆固醇酯(%)=(总胆固醇-游离胆固醇)/总胆固醇×100%。
1.4.5 荧光探针检测活性氧含量 采用活性氧试剂盒对细胞染色,按试剂盒说明书操作,荧光显微镜拍照,并采用Image J软件进行统计分析。
1.4.6 JC-1 染色检测线粒体水平 JC-1 染色按试剂盒说明书进行操作,处理细胞后,荧光显微镜拍照,并采用Image J软件进行统计分析。
1.4.7 透射电镜观察肝脏及细胞内线粒体形态变化 电镜固定液固定,漂洗,1%锇酸溶液固定样品1~2 h,磷酸盐缓冲液漂洗三次,50%、70%、80%、90%、95%乙醇梯度脱水,每个浓度15 min,100%乙醇及纯丙酮分别处理20 min,包埋、加热聚合,切片,染色,观察并拍照。
1.4.8 RT-PCR 法检测基因表达 于NCBI 基因数据库(https://www.ncbi.nlm.nih.gov/)中获取网络药理学得到的核心基因(PPARA、PPARG、STAT3、NFKB1、PTGS2、SCD、PTPN1、GAPDH)的身份识别号,于Primer 软件中得出引物双向序列,进行引物设计和合成(表1)。TRIzol 试剂一步法提取NCTC1469 细胞和RAW264.7 细胞标本中的总RNA,按照逆转录试剂盒的说明书将RNA逆转录成cDNA,使用扩增试剂盒进行cDNA 的扩增。扩增条件如下:95 °C 2 min,95 °C 30 s,60 °C 30 s,72 °C 30 s,共39 个循环。结果采用2-ΔΔCT方法分析,用GAPDH的相对量表示。

表1 RT-PCR中使用的引物序列Table 1 Primers used in the RT-PCR
1.5 统计学方法
采用GraphPad Prism 5.0软件进行数据处理,正态分布的计量资料以均数±标准差()描述,多组间比较采用单因素方差分析,组间两两比较采用LSDt检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠动脉粥样硬化和NAFLD 共病模型构建成功
HE 染色结果显示,正常组动脉内膜光滑,细胞未见明显增殖,弹力板连续,未见明显斑块及脂质沉积;模型组可见主动脉内膜增生,细胞排列不规则,空泡状,可见明显的斑块形成及脂质沉积。油红O 染色结果显示,正常组管腔内未见明显红染;模型组动脉内膜下及管腔内均可见明显红染。染色结果见图1。

图1 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠主动脉组织病理学改变Figure 1 Pathologic staining pictures of the aorta in the atherosclerosis and nonalcoholic fatty liver disease comorbid model mice and in the normal mice
Bodipy 与CD11b 共定位染色结果显示,正常组巨噬细胞表达量少,且其内未见明显脂质沉积;模型组巨噬细胞表达量增多,其内脂质沉积明显,发生明显共定位情况(图2)。

图2 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠主动脉巨噬细胞内脂滴沉积情况Figure 2 Lipid droplet deposition in aortic macrophages of the atherosclerosis and nonalcoholic fatty liver disease comorbid model mice and the normal mice
正常组小鼠肝脏颜色呈暗红色,肝小叶结构清晰;模型组小鼠肝脏颜色呈黄色,肝体积增大,肿胀。HE 染色结果显示,正常组肝细胞间未见明显单核细胞浸润,细胞形态正常;模型组肝细胞间见大量单核细胞浸润,细胞肿胀。油红O 染色结果显示,正常组未见明显红色脂滴;模型组可见明显红染,细胞质内可见明显着色脂滴。见图3。血脂水平检测结果显示,与正常组比较,模型组总胆固醇、三酰甘油、LDL-C 和ox-LDL明显升高(t=-5.2、-4.7、-3.6 和-5.7,均P<0.01),HDL-C 水平明显下降(t=5.5,P<0.01)。肝功能指标检测结果显示,与正常组比较,模型组ALT 和AST 均明显升高(t=-10.2和-8.0,均P<0.01),见表2。以上结果提示,小鼠动脉粥样硬化和NAFLD共病模型构建成功。

图3 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠肝组织病理学改变Figure 3 Pathologic staining pictures of the liver tissue in the atherosclerosis and nonalcoholic fatty liver disease comorbid model mice and in the normal mice
表2 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠与正常小鼠血脂和肝功能检测结果比较Table 2 Lipid and liver function levels in the atherosclerosis and nonalcoholic fatty liver disease comorbid model mice and in the normal mice(,n=6)

表2 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠与正常小鼠血脂和肝功能检测结果比较Table 2 Lipid and liver function levels in the atherosclerosis and nonalcoholic fatty liver disease comorbid model mice and in the normal mice(,n=6)
—:无相关数据;NAFLD:;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;ox-LDL:氧化型低密度脂蛋白;ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶.
2.2 动脉粥样硬化和NAFLD 共病模型差异代谢产物
非靶向代谢组学分析结果显示,多元统计中正离子的PCA、PLS-DA、OPLS-DA 图显示每组标本的组内具有良好的一致性,组间具有良好的差异性(图4)。85 种代谢产物表达存在差异(附图1),其中差异显著性前二十位的代谢产物见表3。结果提示,动脉粥样硬化和NAFLD 共病模型小鼠的代谢产物发生改变。
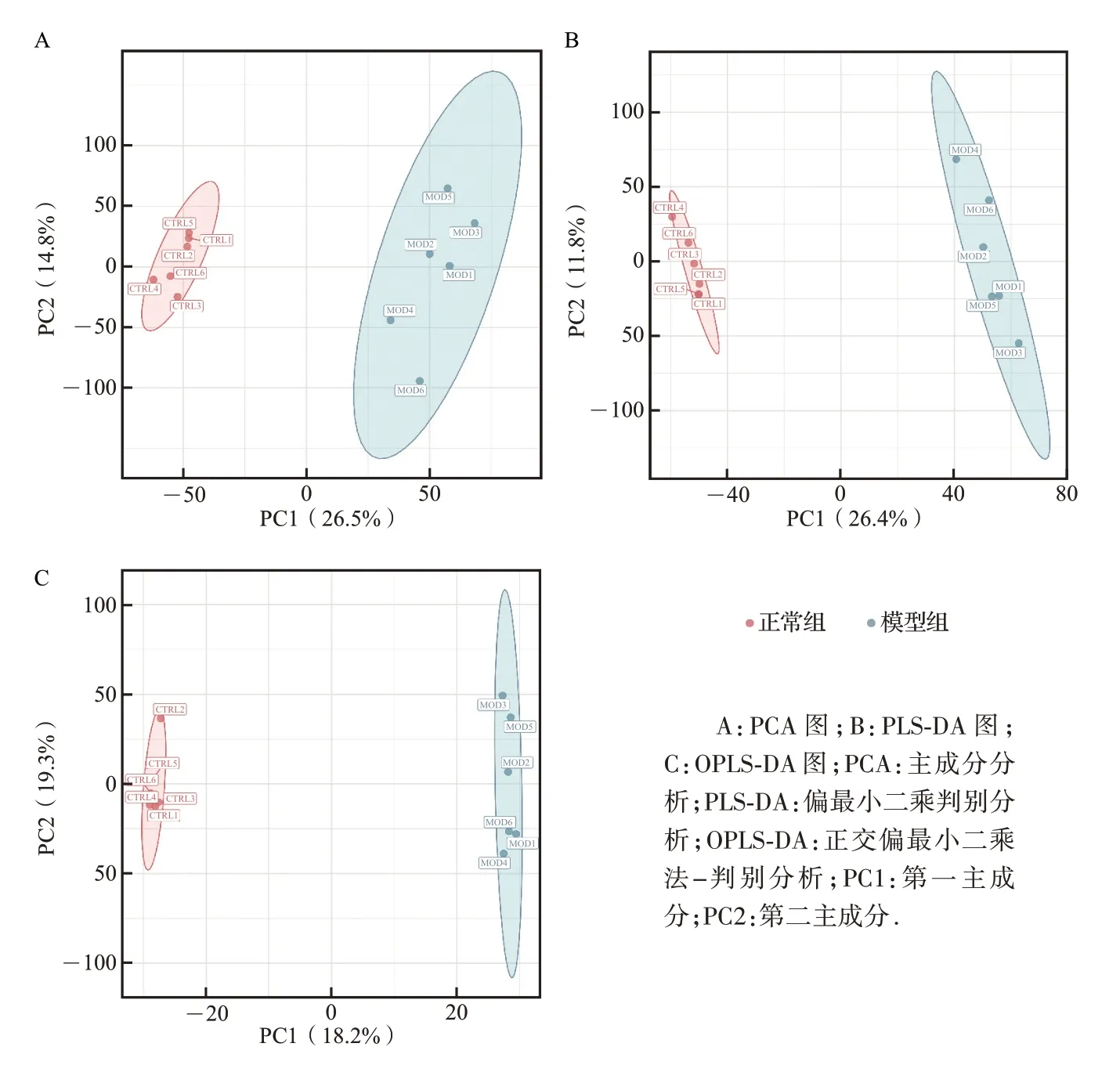
图4 动脉粥样硬化和非酒精性脂肪性肝病小鼠与正常小鼠代谢组学分析结果Figure 4 Metabonomic analysis between atherosclerosis and nonalcoholic fatty liver disease mice and normal mice

表3 动脉粥样硬化和非酒精性脂肪性肝病共病模型小鼠与正常小鼠前二十种差异代谢产物Table 3 Top 20 differential metabolites between the atherosclerosis and nonalcoholic fatty liver disease comorbidity model mice and the normal mice
2.3 差异代谢产物作用于动脉粥样硬化和NAFLD的核心靶点及可能的作用机制
将差异代谢产物显著的前二十种化合物于Swiss TargetPrediction 预测,合并删除重复后获得256 个潜在靶点。同时,从数据库获取动脉粥样硬化和NAFLD的疾病靶点,合并删除重复后获得动脉粥样硬化靶点2819个,NAFLD 靶点3640个,取交集获得动脉粥样硬化和NAFLD 相关靶点1491 个。1491 个疾病靶点与20种差异代谢产物靶点取交集获得60 个差异代谢产物作用于动脉粥样硬化和NAFLD 的潜在靶点。将交集靶点导入STRING 数据库,获得PPI网络,有60个节点,104条边(图5),运用CytoNCA 插件对网络进行拓扑分析,得到核心靶点11个(表4)。

图5 差异代谢产物调节动脉粥样硬化和非酒精性脂肪性肝病的交集靶点的PPI网络图Figure 5 The PPI network of intersecting targets of differential metabolite regulation of atherosclerosis and nonalcoholic fatty liver disease
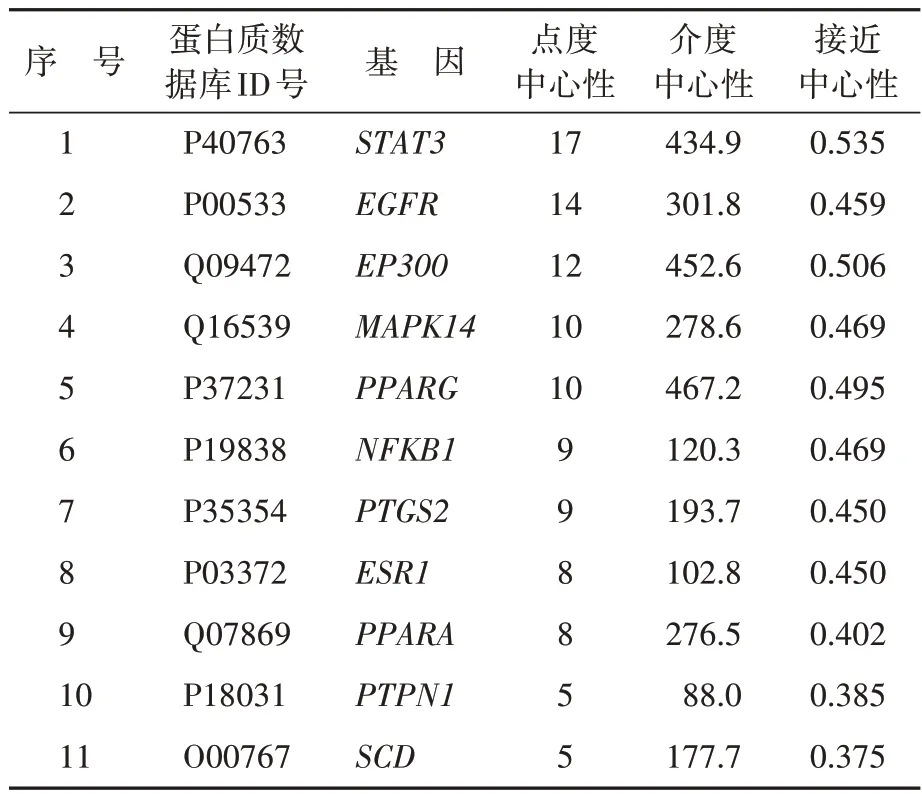
表4 基于拓扑学筛选动脉粥样硬化和非酒精性脂肪性肝病共病发病机制的核心靶点Table 4 Topology-based screening of core targets for pathogenesis in atherosclerosis and nonalcoholic fatty liver disease comorbidity models
对60 个交集靶点进行KEGG通路富集分析结果显示,共涉及68 条信号通路(P<0.05),前十位信号通路为PPAR 信号通路、糖尿病并发症中的AGE-RAGE 信号通路、酒精性肝病、催乳素信号通路、胰岛素抵抗、TNF信号通路、乙型肝炎、松弛素信号通路、IL-17信号通路、非酒精性脂肪肝,提示共病模型的差异代谢产物调节动脉粥样硬化和NAFLD 的作用靶点主要在糖脂代谢和炎症相关通路(附图2),其中PPARG、PPARA、PTPN1、SCD靶点与脂代谢密切相关,STAT3、NFKB1、PTGS2靶点与炎症密切相关。
2.4 体外实验验证病理机制
2.4.1 细胞共病模型构建 采用不同浓度的游离脂肪酸干预NCTC1469细胞24 h,结果显示,各浓度游离脂肪酸[油酸与棕榈酸浓度比分别为0.00/0.00、0.16/0.08、0.32/0.16、0.62/0.31、1.25/0.63、2.50/1.25、5.00/2.50、10.00/5.00(mmol/L)/(mmol/L)]干预后细胞油红O染色面积分别为0.20、0.77、2.65、3.33、5.93、8.34、11.61、11.94 像素,与不加游离脂肪酸相比均增加(附图3);细胞活性检测结果显示,随着游离脂肪酸浓度逐步增加,细胞活性逐步减弱,分别为1.13%、1.00%、0.95%、0.78%、0.54%、0.27%、0.04%、0.03%。根据半数致死率和油红O 染色结果,确定后续实验中游离脂肪酸浓度采用油酸与棕榈酸浓度比为1.25/0.63(mmol/L)/(mmol/L)。
采用不同浓度ox-LDL 干预RAW264.7 细胞24 h,细胞油红O染色结果见附图4。与0.0 μg/mL组(1.47 像素)比较,50.0、100.0、200.0 μg/mL 时细胞油红O 染色面积分别为8.59、9.84、10.77 像素,均明显增加(P<0.01);根据胆固醇酯含量测定结果,50.0、100.0、200.0 μg/mL 时细胞内胆固醇酯含量为50.77%、54.70%、58.70%,均大于50%。因此,后续实验选择50.0 μg/mL ox-LDL进行造模。
2.4.2 共病模型脂代谢和炎症相关基因表达水平改变 脂代谢相关核心基因选择PPARG、PPARA、PTPN1、SCD于肝细胞中进行RT-PCR验证,结果表明,与CN 组比较,MN组PPARG和PTPN1mRNA 表达水平均增加(t=-8.9 和-10.1,均P<0.01),PPARA和SCDmRNA表达水平均减少(t=8.9 和 9.2,均P<0.01);MN+CR组PPARG和PTPN1mRNA 表达水平均增加(t=-6.4 和-4.7,均P<0.01),PPARA和SCDmRNA 表达水平均减少(t=26.0 和16.3,均P<0.01);MN+MR组PPARG和PTPN1mRNA表达水平均增加(t=-5.5 和-8.4,均P<0.01),PPARA和SCDmRNA 表达水平均减少(t=5.7 和18.1,均P<0.01);与MN 组比较,MN+MR组SCDmRNA表达水平减少(t=4.2,P<0.05),见表5。结果提示,脂代谢相关基因在肝细胞模型中变化明显,与泡沫细胞共培养后影响脂代谢基因的表达。
表5 小鼠肝细胞脂代谢相关基因mRNA相对表达水平Table 5 RT-PCR to verify the relative mRNA expression levels of lipid metabolism-related genes in mouse hepatocytes()

表5 小鼠肝细胞脂代谢相关基因mRNA相对表达水平Table 5 RT-PCR to verify the relative mRNA expression levels of lipid metabolism-related genes in mouse hepatocytes()
与CN 组比较,*P<0.05,**P<0.01;与MN 组比较,#P<0.05,##P<0.01.PPARA:过氧化物酶体增殖物激活受体α;PPARG:过氧化物酶体增殖物激活受体γ;PTPN:非受体型蛋白酪氨酸磷激酶;SCD:细胞硬脂酰辅酶A去饱和酶.
炎症相关核心基因选择STAT3、NFKB1、PTGS2于巨噬细胞中进行RT-PCR验证,结果显示,与CR组比较,MR 组巨噬细胞STAT3、NFKB1和PTGS2mRNA表达水平均增加(t=-7.6、-13.5和-5.4,均P<0.01),CN+CR 组差异无统计学意义(P>0.05),MN+CR组STAT3、NFKB1和PTGS2mRNA表达水平均增加(t=-11.4、-6.0 和-6.7,均P<0.01),CN+MR组STAT3、NFKB1和PTGS2mRNA表达水平均增加(t=-7.6、-10.2 和-3.4,均P<0.05),MN+MR组STAT3、NFKB1和PTGS2mRNA 表 达水平均增加(t=-9.5、-23.8和-5.3,均P<0.01);与MR 组比较,MN+MR组STAT3和NFKB1mRNA表达水平均增加(t=-3.5 和-5.0,均P<0.05),见表6。结果提示脂肪变性的肝细胞影响巨噬细胞炎症相关基因的表达。
表6 小鼠巨噬细胞炎症相关基因mRNA相对表达水平Table 6 RT-PCR to verify the relative mRNA expression levels of inflammation-related genes in mouse macrophages()
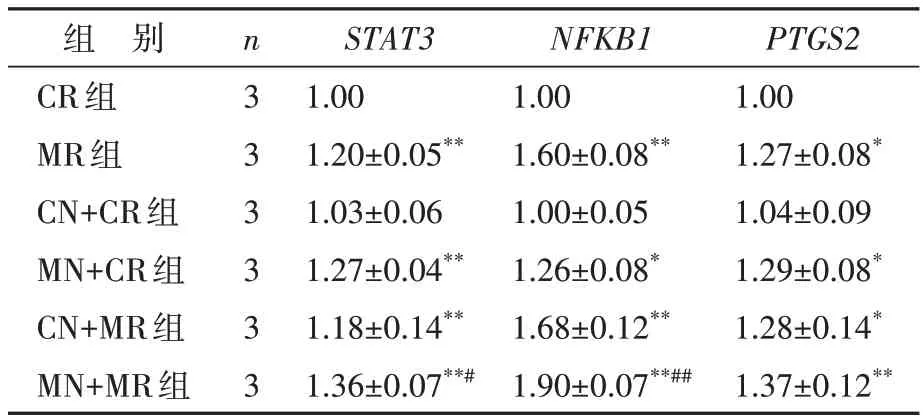
表6 小鼠巨噬细胞炎症相关基因mRNA相对表达水平Table 6 RT-PCR to verify the relative mRNA expression levels of inflammation-related genes in mouse macrophages()
与CR 组比较,*P<0.05,**P<0.01;与MR 组比较,#P<0.05,##P<0.01.STAT:信号传导与转录激活因子;NFKB1:核因子-κB p105亚基;PTGS:前列腺素G/H合酶.
2.4.3 共病模型肝细胞脂肪变性促进巨噬细胞泡沫化 RAW264.7 细胞油红O 染色结果显示,单独培养巨噬细胞,未用ox-LDL 诱导时,CR 组胞内未见明显红染(1.34像素);与CR组比较,经ox-LDL 诱导后,MR组(10.26 像素)和CN+MR组(10.61 像素)单个巨噬细胞油红O 染色面积明显增加(均P<0.01);共培养时,CN+CR组(1.31 像素)未见明显红染,而MN+CR组(9.44 像素)油红O 染色面积明显增加;与MR 组比较,MN+MR组(13.43 像素)油红O 面积明显增加。见图6。结果提示,脂肪变性的肝细胞促进泡沫细胞的形成,且加重泡沫细胞的脂质积蓄。

图6 各组巨噬细胞油红O染色结果Figure 6 Results of oil red O staining of macrophages in each group
2.4.4 肝细胞脂肪变性影响线粒体功能和形态 活性氧探针检测结果显示,与CN 组比较,MN组、MN+CR组和MN+MR 组活性氧平均荧光强度明显增强(t=-9.2、-16.7 和-7.9,均P<0.01);与MN 组比较,MN+MR 组活性氧荧光强度明显增强(t=-3.7,P<0.05),见图7、表7。

图7 各组肝细胞活性氧荧光图Figure 7 Fluorescence map of reactive oxygen species in hepatocytes of each group
表7 小鼠肝细胞线各组粒体功能Table 7 Mitochondrial function in each group of the mice hepatocyte cell line()

表7 小鼠肝细胞线各组粒体功能Table 7 Mitochondrial function in each group of the mice hepatocyte cell line()
与CN组比较,**P<0.01;与MN组比较,##P<0.01.
透射电镜观察线粒体形态发现,CN 组和CN+CR 组肝细胞线粒体形态正常,呈长形或椭圆形,线粒体脊清晰,排列致密,未见线粒体肿胀;与CN组比较,MN 组、MN+CR 组及MN+MR 组线粒体形态明显改变,呈圆形,肿胀,线粒体脊模糊不清,甚至消失,断裂,细胞内见大量脂滴,CN+MR 组线粒体改变不明显,细胞内可见少量脂滴,见图8。

图8 各组肝细胞线粒体形态电镜图Figure 8 Detection of mitochondrial morphology
线粒体JC-1染色结果显示,与CN组比较,MN组、MN+CR组和MN+MR组红色荧光强度/绿色荧光强度值明显减小(t=6.5、7.4和10.9,均P<0.01);与MN 组比较,MN+MR 组红色荧光强度/绿色荧光强度值明显减小(t=4.1,P<0.05),见图9、表7。以上结果提示,脂肪变性后的肝细胞线粒体受损、形态破坏、功能受损,活性氧产生增加,而泡沫细胞形成加重线粒体损伤。
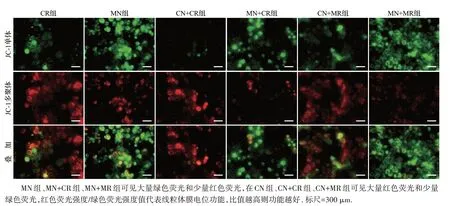
图9 各组肝细胞线粒体膜电位功能荧光图Figure 9 Detection of mitochondrial membrane potential
3 讨论
本研究基于代谢组学探讨动脉粥样硬化和NAFLD 共病模型小鼠的差异代谢产物,结合网络药理学挖掘其潜在机制,并验证了共病发病机制与炎症和脂代谢密切相关,同时肝细胞脂肪变性促进巨噬细胞泡沫化,也表明NAFLD 会促进动脉粥样硬化的发生及发展。这是由于肝脏是脂代谢的主要器官,脂代谢障碍使肝糖原转化在脂肪,储存在肝脏中,也使肝细胞和脂肪细胞脂质积蓄,引起肝细胞脂质过氧化导致线粒体损伤。肝细胞线粒体功能受损后又会进一步产生过多活性氧,氧化修饰低密度脂蛋白后,ox-LDL 被巨噬细胞吞噬成泡沫细胞,激活炎症反应,形成动脉粥样硬化,可见脂代谢障碍促进炎症反应可能是NAFLD促进动脉粥样硬化形成的重要因素。
本研究代谢组学分析结果显示,模型组的尿酸、高瓜氨酸显著升高,苯乙酸、磷脂酰胆碱和5-羟基-L-色氨酸显著降低。尿酸是体内嘌呤代谢的最终产物,尿酸升高与NAFLD 的发病率增加有关,是NAFLD 的独立危险因素,其可通过刺激果糖激酶促进果糖代谢和肝细胞中的脂肪沉积[12-13];而且尿酸还具有显著的促炎作用,通过激活NOD 样受体蛋白1 炎症小体触发IL-3β 介导的炎症[14]。苯乙酸代谢物的升高反映了苯丙氨酸和酪氨酸降解的增强,而有研究发现苯丙氨酸和酪氨酸会通过影响脂质代谢相关途径促进NAFLD的进展[15];苯乙酸还能通过刺激血管内皮细胞中活性氧的产生和TNF-α 的分泌,调节炎症,影响动脉粥样硬化的发展[16]。磷脂酰胆碱具有调节血清胆固醇的作用[17-18],还能抑制泡沫细胞的形成,具有抗动脉粥样硬化作用[19]。高瓜氨酸是通过氨基甲酰化衍生而来的,以往研究发现,高瓜氨酸分别在动脉粥样硬化和NAFLD 患者中显著上调,而且其浓度与冠状动脉疾病严重程度呈正相关,本研究与其一致[20-21];高瓜氨酸可能通过诱导内皮功能障碍,增加活性氧产生,导致内皮一氧化氮合酶解偶联,从而促进动脉粥样硬化的发生[22]。5-羟基-L-色氨酸是一种血清素前体,可通过抑制食欲减少脂肪的摄取[23-24]。为了明确以上差异代谢产物如何影响共病的进展,研究者基于代谢组学得到的显著差异代谢产物进行了网络药理学分析。
网络药理学分析结果得到差异代谢产物影响动脉粥样硬化和NAFLD 共病的11 个关键基因,其中PPARG、PPARA、PTPN1、SCD与脂代谢密切相关,STAT3、NFKB1、PTGS2与炎症密切相关。PPARG和PPARA是过氧化物酶体增殖物激活受体的一员,作为脂肪酸传感器,是多种人类脂质代谢疾病的治疗靶点,可通过与类视黄醇X受体结合形成PPAR-RXR 异二聚体,调节脂肪酸氧化基因的转录,抑制炎症因子的表达,影响巨噬细胞胆固醇的转运,影响动脉粥样硬化[25]。PTPN1是PTP 超家族的成员,研究发现用高脂肪饮食喂养的PTP8B敲除小鼠对体重增加具有抵抗力,并且三酰甘油水平显著降低,因此,PTP1B是治疗脂代谢异常相关疾病的潜在靶点[26-27]。PTPN1还参与巨噬细胞极化,敲除PTPN1将巨噬细胞向抗炎M2 表型转移,从而促进肠屏障完整性并抑制巨噬细胞的炎症反应[28]。SCD影响脂肪酸合成途径,在调节参与脂肪生成的基因的表达和调节线粒体脂肪酸氧化方面发挥重要作用,在NAFLD 患者中可见SCD基因表达上调[29]。巨噬细胞是炎症细胞的重要组成部分,包括促炎M1型和抗炎M2型,M1型巨噬细胞的促炎反应依赖于NFKB1的激活;M2 型巨噬细胞会通过募集STAT3抑制炎症[30]。PTGS2基因的重要功能之一是参与炎症反应的调节,其翻译的环氧合酶通过催化花生四烯酸代谢和前列腺素合成的初始步骤,是炎症的主要介质,可作为治疗炎症性疾病的治疗靶点[31]。KEGG通路富集分析结果得到的信号通路有PPAR 信号通路、糖尿病并发症中的AGE-RAGE 信号通路、酒精性肝病、胰岛素抵抗、TNF 信号通路等,因此推测差异代谢物影响了共病模型中的脂代谢及炎症表型。
为了验证假说,本研究采用细胞共培养技术,验证了脂肪变性的肝细胞发生线粒体形态和功能的改变,与巨噬细胞共培养后,加重了巨噬细胞泡沫化及炎症改变,证实了前文的假说。
综上,本研究通过分析动脉粥样硬化与NAFLD 共病模型的差异代谢产物,结合网络药理学分析发现动脉粥样硬化与NAFLD 共病的发生与脂代谢异常和炎症相关。肝脏是糖脂代谢最重要的器官,肝脏脂肪变性导致肝功能异常,游离脂肪酸增多,损伤线粒体,活性氧累积并从细胞器中释放时,导致炎症的激活,构成动脉粥样硬化发生及发展的重要因素。但本研究在动物模型上采用普通饮食喂饲野生型C57BL/6J 小鼠作为对照组,采用高脂喂饲ApoE-/-小鼠的经典造模方法,由于两种小鼠存在不同的基因背景,可能会对差异代谢物存在一定的影响,这也是本研究的不足之一。后续将以普通饮食喂养的ApoE-/-小鼠作为对照组,在相同的基因背景下进一步研究和分析。
本文附图见电子版。

志谢本研究得到辽宁省教育厅科学研究经费项目(L202048)、辽宁省教育厅基本科研项目(青年项目)(LJKQZ2021064)的支持.感谢辽宁中医药大学附属医院中医药实验中心提供的科研平台,感谢审稿专家及编辑的帮助
AcknowledgementsThis work was supported by Scientific Research Funding Project of Liaoning Provincial Department of Education (L202048),Basic Research Projects of Liaoning Provincial Department of Education (LJKQZ2021064).We would like to thank the Experimental Center of Traditional Chinese Medicine,the First Affiliated Hospital of Liaoning University of Traditional Chinese Medicine for providing a research platform,and thank the reviewers and editors for the help
利益冲突所有作者均声明不存在利益冲突
Conflict of InterestsThe authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)
