4 株金黄色葡萄球菌噬菌体的分离鉴定、生物学特性及其基因组分析
2024-01-09李旋叶军航赵尹蕾吉婷婷李雅洁周文渊
李旋,叶军航,赵尹蕾,吉婷婷,李雅洁,周文渊,2*
(1.扬州大学食品科学与工程学院,江苏扬州 225127)(2.扬州大学兽医学院,江苏扬州 225009)
金黄色葡萄球菌(Staphylococcusaureus,SA)是一种常见的食源性致病菌,广泛存在于水、空气、人和动物的皮肤等环境中[1]。它可以引起伤口感染,诱发各种炎症,甚至污染食品和食用农产品,导致食物中毒事件的发生[2]。使用抗生素(如氨苄西林、卡那霉素和万古霉素等)来预防和控制SA是最直接有效的方法,但是过度使用抗生素会使金葡菌产生耐药菌株,对人类和动物健康造成危害,甚至对生态环境安全构成威胁[3]。因此,寻找可代替抗生素治疗的生物制剂非常重要。
噬菌体是细菌的病毒,能够专一性地裂解宿主细菌,作用机理明确[4]。噬菌体对宿主细菌具有专一性能够直接攻击并杀害相应致病菌[5],并且具有易于筛选、数量庞大[6]、成本低廉的优点。最重要的是用于人体和动物较为安全,不会导致菌群出现耐药性,甚至可以杀死耐药菌[7],适合用于食品中多重耐药SA的控制。目前,一些基于噬菌体的产品已经在市场上上市,如ListexTMP100 和ListShieldTM[8],它们的安全性得到美国食品和药物管理局(FDA)的认可,并被美国农业部(USDA)批准可以作为抗菌加工助剂,用于食品抗菌。噬菌体根据是否能进行溶原途径的生活史分为烈性噬菌体和温和噬菌体,研究表明烈性噬菌体和温和噬菌体均具有控制SA生长的潜力。Ngassam-Tchamba 等[9]分离的三株烈性噬菌体(Romulus、Remus 和ISP)在体外对与牛乳腺炎相关的SA具有良好裂解活性。Zhang 等[10]分离的温和噬菌体JS02 对SA表现出较强的清除能力,并且能抑制SA生物膜的形成。Chang 等[11]将温和噬菌体SA13 随机缺失突变后的突变噬菌体SA13m 应用于牛奶中抑制SA,结果显示金葡菌在冰箱温度(4 ℃)和室温(25 ℃)下均降低至不可检测的水平。Al-Anany 等[12]研究发现温和噬菌体HK97 与亚抑菌浓度的抗生素环丙沙星联合使用,对SA具有良好清除效果。然而,尚未有研究系统性比较温和噬菌体和烈性噬菌体在形态、生物学特性以及基因组组成上的差异。
本研究分离出4 株SA的噬菌体(包括2 株烈性噬菌体和2 株温和噬菌体),利用透射电镜观察其形态特征差异,随后对所分离噬菌体的效价、宿主谱、耐酸碱能力、热稳定性、一步生长曲线、最佳感染复数(Multiplicity of Infection,MOI)值等生物学特性进行比较研究,最后通过全基因组测序比较分析烈性噬菌体和温和噬菌体基因组特征。本文通过比较温和噬菌体和烈性噬菌体在形态、生物学特性以及基因组组成的差异,为筛选更加高效的噬菌体作为生物抑菌剂,用于控制食品加工过程中金葡菌污染奠定理论基础和数据支持。
1 材料与方法
1.1 菌株及样品来源
47 株SA菌株YZUsa1-YZUsa47 分离自江苏省内养猪场;ATCC 29213 购自北京百欧博伟生物技术有限公司;3株SA菌株MRSA 85/2082、MRSA JCSC4744和MRSA WZ153 来自扬州大学生物危害因素防控重点实验室;霍氏肠杆菌(Enterobacterhormaechei)Eh-YZU05 分离自猪粪便,单核增生性李斯特菌(Listeriamonocytogenes)ATCC 1911、肠炎沙门氏菌(Salmonellaenteritidis)CICC 21513、大肠杆菌(Escherichiacoli)CICC 10664 及最小弧菌(Vibrio mimicus)CICC 21613 购自CICC 菌种保藏中心。
1.2 主要试剂和仪器
卢里亚-贝尔塔尼(Luria-Bertani,LB)培养基,购自青岛高科技工业园海博生物技术有限公司;Baird-Parker 琼脂基础,购自青岛高科技工业园海博生物技术有限公司;脑心浸出液肉汤(Brain Heart Infusion,BHI),购自青岛高科技工业园海博生物技术有限公司;7.5%氯化钠肉汤,购自广东环凯微生物科技有限公司;丝裂霉素C购自上海麦克林生物公司。
SW-CJ-1F 型无菌操作台,苏州净化设备制造有限公司;JEM-1200EX 型透射电镜,日本电子株式会社;HC-2066 型高速离心机,安徽中科中佳科学仪器有限公司;H/T16MM 型冷冻离心机,北京博劢仪器有限公司;BDY-2012 型恒温摇床,上海百典仪器设备有限公司。
1.3 噬菌体分离
1.3.1 烈性噬菌体分离
利用SA菌株ATCC 29213 作为宿主进行SA噬菌体分离。采集扬州市内污水样品500 mL,污水样品的前处理过程以及噬菌体分离纯化过程参照Chang 等[11]的方法进行。用8 000 r/min 的高速离心机离心10 min以除去杂质,之后使用0.45 μm 和0.22 μm 滤器过滤除菌后,得到噬菌体原液。将3 mL 2×的LB 培养基培养液和100 µL 培养至对数生长期的SA菌株ATCC29213加入处理后的污水中,在37 ℃的温度下摇床培养8 h以上。将培养后的培养物经过离心、过滤得到原液,并保存在4 ℃的冰箱。
1.3.2 温和噬菌体分离
挑取纯化后的金葡菌YZUsa13 和YZUsa14 单菌落于LB 液体培养基中[13],于37 ℃下摇床培养12 h,调整菌液浓度为2×107CFU/mL。分别在LB 培养基中加入167 μL 浓度为0.3 mmol/L 的丝裂霉素C 和菌液,置于37 ℃下摇床培养6 h,每隔1 h 取1 mL 通过0.22 μm 滤膜后,与菌液各100 μL 加入10 mL 离心管中,利用层平板法测定噬菌体滴度。
1.4 透射电镜观察
噬菌体的形态学观察参考文献[11]进行,并略作修改。先将噬菌体液进行浓缩,然后在200 目碳涂层铜网上滴加20 µL 的浓缩后的噬菌体(1010PFU/mL)悬浮液,充分吸附约15 min 后取出铜网使其自然干燥2~3 min。然后用2%(m/V)的磷钨酸钠(pH 值为7.6)溶液染色2 min 后,使用透射电镜(TEM,Hitachi H600A)观察噬菌体形态。
1.5 噬菌体宿主谱的测定
噬菌体的宿主谱采用空斑法[11]进行测定,通过双层平板法将100 µL 菌液(108CFU/mL)和5 mL 的LB 半固体培养基混匀后倒在LB 固体培养基上,自然干燥后取10 µL 噬菌体培养液(MOI=100)滴在表面,倒放在37 ℃恒温箱中培养。每组实验平行重复3 次。
1.6 生物学特性测定
1.6.1 最佳感染复数的测定
最佳MOI 的测定方法参照文献[13]的测定方法,略有改动。将菌液浓度调整至1×106CFU/mL,按照噬菌体和宿主菌的不同比例(0.000 1、0.001、0.01、0.1、1、10 和100)将噬菌体和宿主菌混匀后37 ℃摇床培养8 h 后,于8 000 r/min 条件下离心10 min,过滤并测定效价,效价最高的比例即为最佳MOI。每组做三次平行实验。
1.6.2 一步生长曲线(One-stepGrowth)的测定
一步生长曲线的测定方法参照文献[10]进行测定,略有改动。将噬菌体和108CFU/mL 宿主菌按照最佳MOI 混合,37 ℃静置培养7 min 后8 000 r/min 离心10 min,弃上清后加入5 mL 的LB 培养基重悬沉淀,放在37 ℃培养箱中培养。分别于不同时间点(0、5、10、15、30、45、60、75 和90 min)或(0、10、20、30、40、50、60、75、90、105、120、135、150、165、180、200、220 和240 min)取100 µL 梯度稀释后与宿主菌各100 µL 倒双层平板。每组实验平行重复3 次。
1.6.3 耐酸碱性实验
噬菌体的耐酸碱性实验参照文献[11]进行测定,分别取1 mL 噬菌体于若干10 mL 的离心管中,分别加入1 mL pH 值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0 的SM 缓冲液中,37 ℃下作用2 h 后测定效价。
1.6.4 热稳定性实验
噬菌体热稳定性实验参照文献[10]进行测定,取1 mL 效价约为108PFU/mL 的噬菌体于试管中并放在40、50、60、70 ℃的恒温金属浴中依次作用20、40和60 min 后测定效价。
1.7 基因组测序及分析
对噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14的全基因组序列进行测定和分析。噬菌体基因组DNA提取参照文献[14]中所述方法。分别采用琼脂糖凝胶电泳和Qubit ®dsDNA HS 分析试剂盒(Life Technologies,Carlsbad,CA,USA)对噬菌体基因组DNA 进行定性定量。
通过Illumina HiSeq 平台(Illumina,SanDiego,CA,USA)对噬菌体基因组序列进行测定,插入片段大小为500 bp。使用FGENESB(http://www.softberry.com)、GeneMarkS[15]和Glimmer v3.02[16]软件对开放阅读框(Open Reading Frames,ORFs)进行预测。通过InterProScan(http://www.ebi.ac.uk/Tools/pfa/iprscan/)和BLASTp[17]对ORFs 进行注释。将基因组信息上传至 NCBI 网站(https://www.ncbi.nlm.nih.gov/),SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14的GenBank 编号分别为OP432864、MW864252、ON229621 和ON220160。
1.8 噬菌体系统进化树构建
截至2021 年4 月,GenBank 数据库中记录192个金黄色葡萄球菌噬菌体基因组序列。本研究通过软件kSNP3 v3.0 对噬菌体SAPYZU-04、SAPYZU-15、SAPYZU-SapM13、SAPYZU-SapM14和上述192 个SA噬菌体基因组序列的单核苷酸多态性(Single-Nucleotide Polymorphisms,SNPs)进行解析并构建系统进化树[18]。以噬菌体ErwiniaphagephiEa2809 作为外组噬菌体,并使用iTOL 进行注释[19]。
1.9 数据分析
实验数据表示为平均值±标准差(Mean±SD,n=3),每组实验重复3 次,取平均值。实验数据中点线图、柱状图由Origin 2023 软件绘制完成。
2 结果与讨论
如图1,本研究以金葡菌ATCC 29213 为宿主菌,通过双层平板法,从扬州市内污水样品中分离得2 株SA烈性噬菌体,分别命名为 SAPYZU-04 和SAPYZU-15。利用丝裂霉素C 从已分离纯化的金葡菌YZUsa13 和YZUsa14 中诱导出2 株温和噬菌体,分别命名为SAPYZU-SapM13和SAPYZU-SapM14。4 株噬菌体的噬菌斑均呈圆形透亮、边界清晰,直径为0.8~1.5 mm。
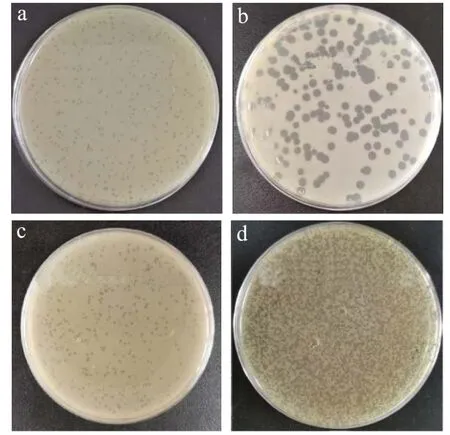
图1 噬菌斑形态图Fig.1 Morphology of phage plaque
2.1 噬菌体的电镜形态
通过透射电镜观察噬菌体微观形态,结果如图2所示。烈性噬菌体SAPYZU-04 和SAPYZU-15 均有一个呈正多面体结构头部和一个可伸缩的尾巴,头部长度分别约为64.96 nm 和88.68 nm,尾部长度约为165.03 nm 和 176.89 nm 。而温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14均有一个呈椭球形头部和一个不可伸缩的长尾,头部长度分别约为长直径:84.26、71.82 nm 和短直径:44.73、47.71 nm,尾部长度约为254.43 nm 和266.17 nm。结果显示烈性噬菌体SAPYZU-04和SAPYZU-15的显微形态与党瑞莹等[20]、张志宏等[21]和涂尊方等[22]的研究一致;而温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14的电镜形态与Zhang 等[10]、Yang 等[23]和Feng 等[24]的研究结果一致。

图2 噬菌体的形态Fig.2 Morphology of phage
2.2 裂解谱
应用空斑法测试噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14对51 株金葡菌菌株YZUsa1-YZUsa47、ATCC 29213、MRSA 85/2082、MRSA JCSC4744、MRSA WZ153 和5 株其他菌属菌株的裂解特性,结果如表1 所示。烈性噬菌体SAPYZU-04 和SAPYZU-15 均能裂解51 株金葡菌,裂解率为100%,并且噬菌斑较透亮,+++数量均达到56%;而噬菌体SAPYZU-SapM13能裂解48 株SA菌株,裂解率为94%,噬菌体SAPYZU-SapM14能裂解44 株SA菌株,裂解率为86%。然而,这4 株噬菌体对于单核增生性李斯特菌ATCC 1911、肠炎沙门氏菌CICC 21513、大肠杆菌CICC 10664、最小弧菌CICC21613以及霍氏肠杆菌Eh-YZU05均没有裂解能力。4 株噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14均比王一帆等[25](1/11,9%)、Yang 等[23](13/30,43%)、党瑞莹等[20](23/63,36%)、Feng 等[24](61/138,44%)和张志宏等[21](10/37,27%)分离的噬菌体的裂解谱更宽。噬菌体较宽的宿主谱是其用于生物防治的重要特性[26],因此,噬菌体裂解谱的测定对于选择应用于食品中的生物抑菌剂至关重要。此外,温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14在进行宿主谱测定实验时,对他们的溶原菌仍有裂解作用,该结果与Zhang 等[10]和Feng 等[24]的研究一致。研究表明一些噬菌体裂解宿主菌是一种“从外裂解”的过程,这个过程是高浓度噬菌体吸附宿主菌后快速破坏宿主细菌细胞[27]。因此,本研究的温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14进行宿主谱测定时浓度远大于宿主细菌细胞是其显示裂解特性的原因之一。
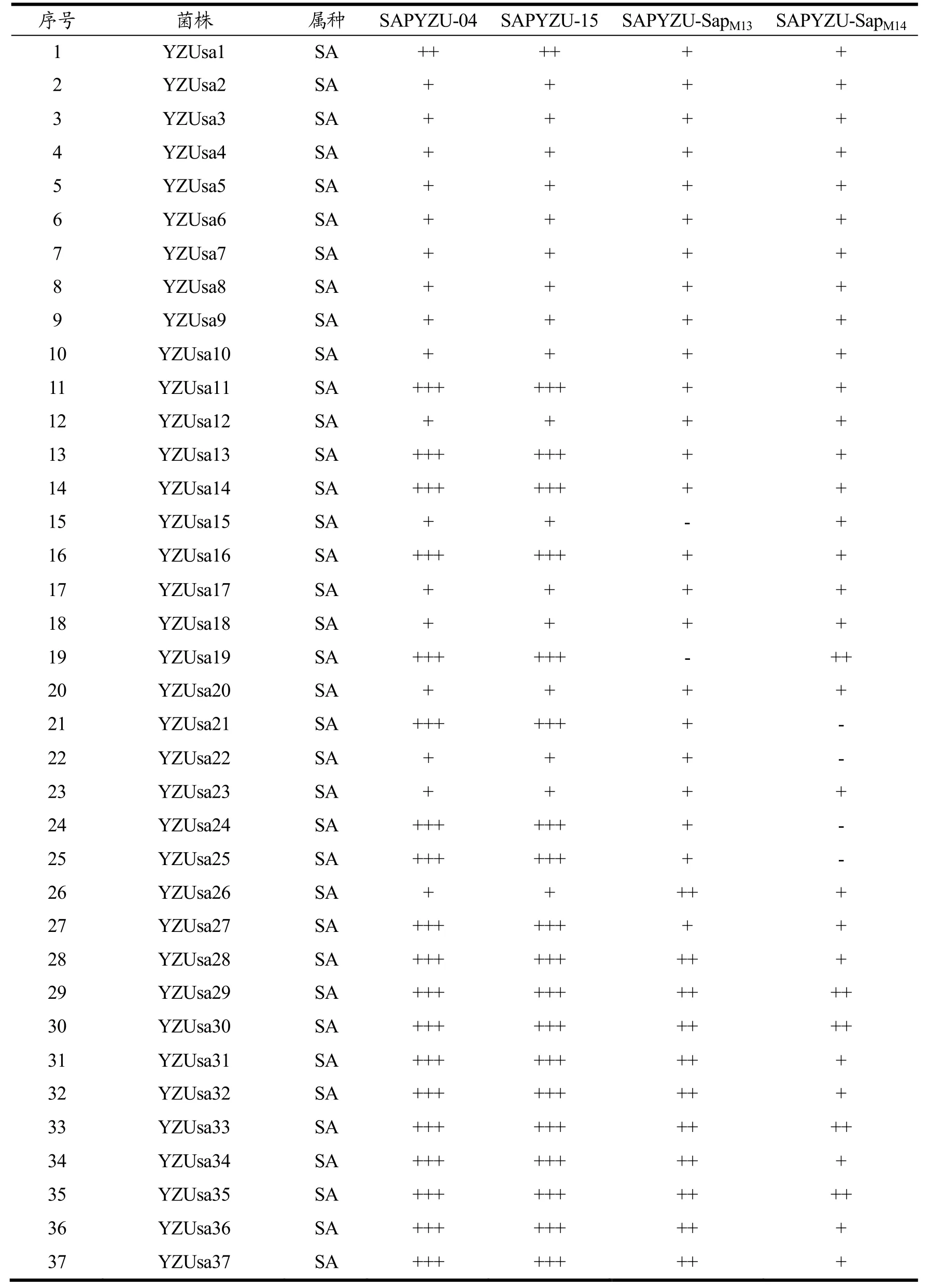
表1 噬菌体的宿主谱Table 1 Host spectrum of phage
2.3 最佳MOI
用不同 MOI 比例的噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14感染宿主菌,培养8 h 后测定噬菌体效价。如图3 所示,噬菌体SAPYZU-04 在MOI 为0.01(P<0.05)时,效价最高(约为109PFU/mL);噬菌体SAPYZU-15在MOI 为0.000 1 时,效价最高(约为1010PFU/mL);噬菌体SAPYZU-SapM13在MOI 为0.1 时,效价最高(约为1010PFU/mL);噬菌体SAPYZU-SapM14在MOI为0.01(P<0.01)时,效价最高(约为109PFU/mL)。因此,噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14的最佳MOI 分别为0.01、0.000 1、0.1 和0.01。
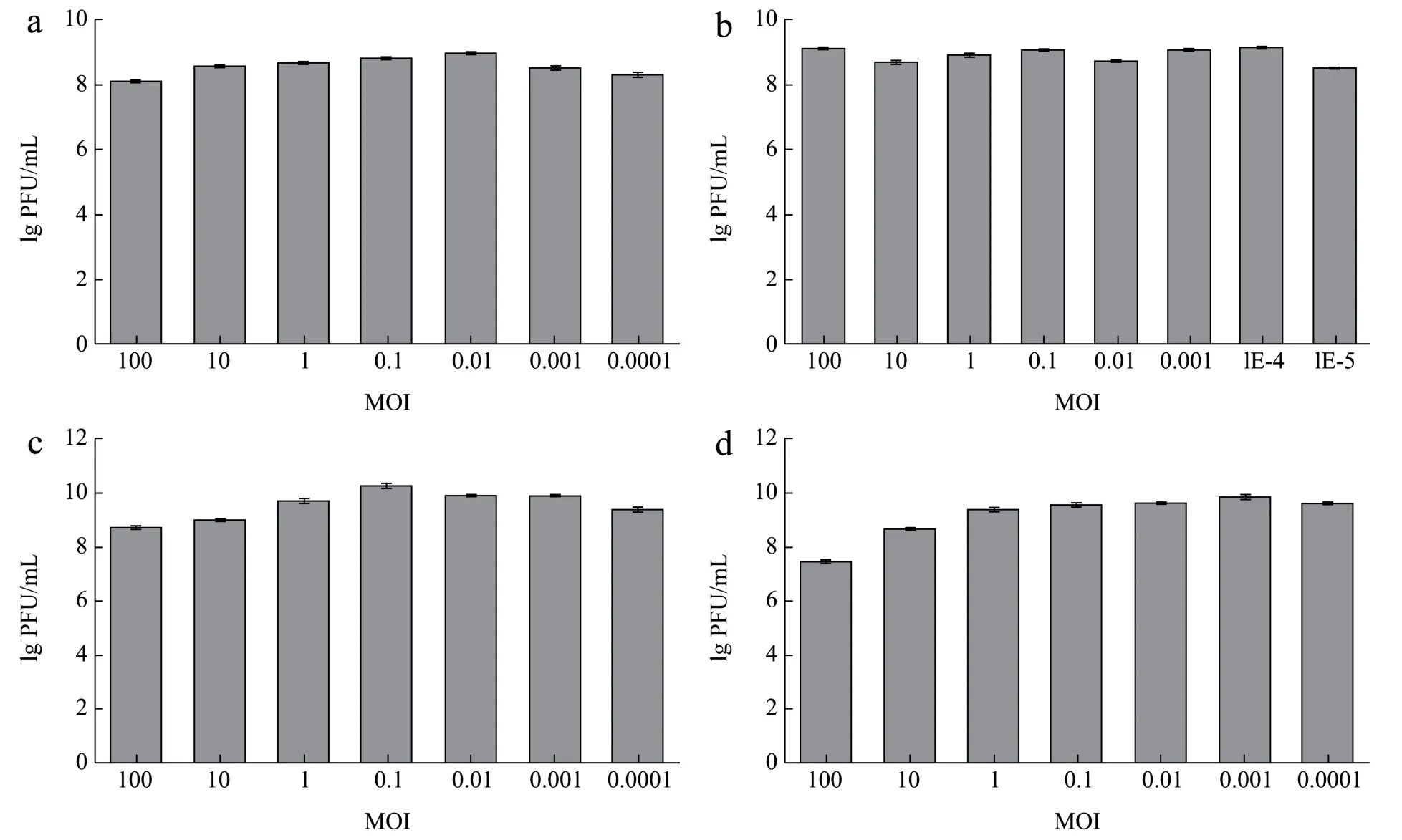
图3 噬菌体最佳MOI 测定结果Fig.3 Results of determination of the optimal complex number of phage infection
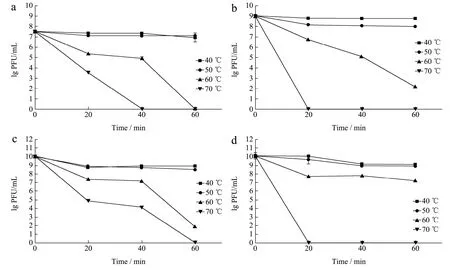
图4 噬菌体的热稳定性Fig.4 Thermal stability of phages
2.4 噬菌体的热稳定性
如图 4 所示,金黄色葡萄球菌噬菌体SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14在40 ℃和50 ℃条件下作用1 h效价基本不变,效价分别为5.63×107、1.34×109、1.12×109和1.27×1010PFU/mL;在60 ℃条件下随着作用时间越长,噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14效价越低。分别在70 ℃孵育40、20和20 min时,噬菌体SAPYZU-04、SAPYZU-15 和SAPYZU-SapM14完全失活,而噬菌体SAPYZU-SapM13在70 ℃孵育60 min 时完全失活。结果表明4 株噬菌体SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14对高温的耐受能力均强于Kraushaar 等[28]报道的金葡菌噬菌体。
2.5 噬菌体的耐酸碱能力
如图5 所示,噬菌体SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14在酸度较高的环境(pH 值为2)中会完全失活;在pH 值为3~12 时活性较稳定。在pH 值为5 时,噬菌体SAPYZU-04 的效价最高为1.31×107PFU/mL(P<0.05);pH 值为9时,噬菌体 SAPYZU-15 的效价最高为8.94×106PFU/mL;而噬菌体 SAPYZU-SapM13和SAPYZU-SapM14在pH 值为8 时效价最高,分别为9.18×107PFU/mL 和9.52×107PFU/mL。结果表明噬菌体SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14在pH值为3~12范围内均保持良好活性,其对酸碱的耐受能力均强于卢玮等[29]分离的金葡菌噬菌体(pH 值为6~11 范围内稳定)。

图5 噬菌体的耐酸碱能力Fig.5 Resistance of phages to acidity and alkalinity
2.6 一步生长曲线
将噬菌体 SAPYZU-04、SAPYZU-15、SAPYZU-SapM13和SAPYZU-SapM14分别与宿主菌混合后培养,得到噬菌体的一步生长曲线。如图6 所示,烈性噬菌体SAPYZU-04 和SAPYZU-15 侵染宿主的10 min 内效价无明显变化,表明它们的潜伏期均为10 min。在10~150 min 内,噬菌体SAPYZU-04 和SAPYZU-15 的效价一直保持升高趋势,随后趋于稳定,表明它们的裂解期均约为140 min,裂解量分别约为每个细胞210 和322 PFU。而温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14的潜伏期较长,分别约为15 和30 min;裂解期较短,分别约为30 和45 min,裂解量分别为每个细胞52 和49 PFU。上述结果显示,烈性噬菌体SAPYZU-04 和SAPYZU-15的裂解量均高于Gutierrez 等[30]分离的金葡菌烈性噬菌体(每个细胞15 和25 PFU)。温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14的裂解量比Feng等[24]分离的温和噬菌体JD419 裂解量(每个细胞33 PFU)更高。潜伏期和爆发量是表示噬菌体裂解能力的重要生物学特性,具有较短潜伏期和较大爆发量的噬菌体更适合作为生物防治剂[31]。

图6 噬菌体的一步生长曲线Fig.6 one step growth curve of phages
2.7 系统发育树
全基因组序列分析结果显示烈性噬菌体SAPYZU-04 和 SAPYZU-15 基因组全长分别为140 584 bp 和 135 178 bp,而温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14的基因组全长分别为44 922 bp 和44 232 bp。其中噬菌体SAPYZU-04的GC 含量为31.48%,预测到188 个ORFs;噬菌体SAPYZU-15 的GC 含量为29.90%,预测到187 个ORFs;噬菌体SAPYZU-SapM13的GC 含量为33.98%,包含71 个ORFs;噬菌体SAPYZU-SapM14的GC 含量为33.89%,包括73 个ORFs。
截至2021 年4 月,GenBank 数据库中记录192个金黄色葡萄球菌噬菌体基因组序列。本研究通过这些金黄色葡萄球菌噬菌体基因组序列进行系统发育分析,解析4 株噬菌体和其他金黄色葡萄球菌噬菌体之间的关系。此树形图(图7)划分了3 个主要的遗传谱系(I-Ⅲ)。聚类分析结果表明,烈性噬菌体SAPYZU-04 和SAPYZU-15 与Hellelleviridae 科的噬菌体聚在一个谱系中(谱系Ⅱ),且SAPYZU-04 和SAPYZU-15与噬菌体qdsa001基因组核苷酸序列最相似,相似性>99.0%;温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14与Azeredovirinae 亚科Dubowvirus属的噬菌体聚在一个谱系中(谱系Ⅲ),且SAPYZU-SapM13和SAPYZU-SapM14与TEM126 和SAP26 的基因组核苷酸序列一致性>95%。因此,根据 ICTV2022 年最新的分类标准[32],噬菌体SAPYZU-04 和SAPYZU-15 属于Hellelleviridae 科;而 SAPYZU-SapM13和 SAPYZU-SapM14属 于Azeredovirinae 亚科Dubowvirus属。
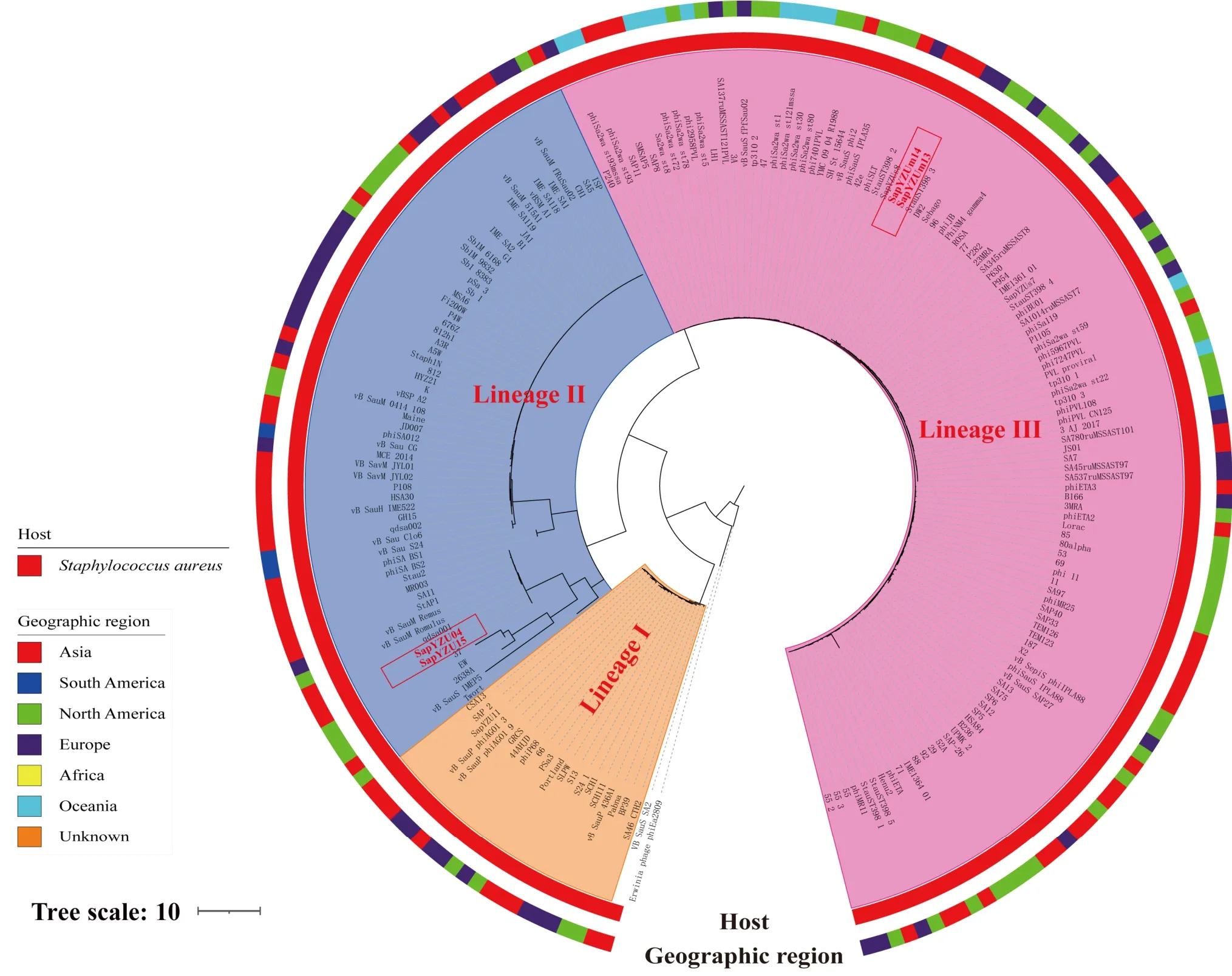
图7 系统发育分析Fig.7 Phylogenetic analysis
2.8 全基因组序列分析
对4 株噬菌体基因组携带基因的蛋白功能进行注释,结果如图8 所示。噬菌体SAPYZU-04 的基因组编码32 个DNA 代谢相关基因,包括核酸内切酶基因(orf38)、DNA 解旋酶基因(orf115)和DNA 聚合酶Ⅰ基因(orf144)等;噬菌体SAPYZU-15 的基因组包含多个DNA 代谢基因,其中包括3 个DNA 合成相关基因(orf1、orf3和orf5)、2 个DNA 聚合酶Ⅰ(orf10、orf11)和 DNA 绑定蛋白(orf82);噬菌体SAPYZU-SapM13的基因组编码13 个与噬菌体DNA复制、调节和转录相关的基因,包括核酸外切酶基因(orf7)、转录因子(orf9)、DNA 复制基因(orf25)和DNA 解旋酶(orf45)等;而噬菌体SAPYZU-SapM14编码11 个与噬菌体DNA 代谢相关的基因,包括转录因子(orf11)、DNA 绑定蛋白(orf24)、DNA 解旋酶(orf28)和核酸内切酶(orf51)等。其中SAPYZU-15基因组编码丰富的DNA 合成基因加速了噬菌体大分子的合成。SAPYZU-04 的基因组编码3 个DNA 组装基因(orf66、orf68和orf69),SAPYZU-15 的基因组编码1 个DNA 组装基因(orf117),SAPYZU-SapM13和SAPYZU-SapM14均包含2 个DNA 包装基因(分别为orf48、orf49、orf52和orf53)。其中SAPYZU-15编码的DNA 包装基因与噬菌体LSA2308[33]的氨基酸序列具有95.9%的相似性;LSA2308 的爆发量约为407 PFU/cell。DNA 包装蛋白可以有效地将DNA 泵入尾部噬菌体原衣壳中,加速噬菌体的组装[34]。噬菌体SAPYZU-04 和SAPYZU-15 的基因组中分别包含3 个和1 个尾部蛋白基因(分别为orf108、orf110、orf158和orf142),噬菌体SAPYZU-SapM13编码5 个尾部相关蛋白基因,包括尾管蛋白基因(orf57)和主要尾部蛋白基因(orf58和orf62)等;而SAPYZU-SapM14编码6 个尾部相关蛋白基因,包括尾部蛋白基因(orf57、orf61、orf62)等。这些独特的尾部蛋白基因可能是此4 株噬菌体具有广泛的裂解谱的原因。其中SapYZU-15含有的尾蛋白基因与噬菌体KSAP11[35]的基因组氨基酸序列有95.90%的相似性。KSAP11 具有广泛的裂解谱,对30 株SA菌株(包括MSSA 和MRSA 菌株)具有裂解活性。噬菌体SAPYZU-04 包含1 个穿孔素基因(orf53)和3 个裂解酶基因(orf52、orf100和orf102),SAPYZU-15 包含1 个穿孔素基因(orf107)、5 个裂解酶基因(orf103、orf105、orf149、orf153和orf155);而SAPYZU-SapM13和SAPYZU-SapM14的基因组均只包含1 个穿孔素基因(分别为orf70和orf2)和1 个裂解酶基因(分别为orf71和orf3)。穿孔素基因在裂解过程中诱导宿主细胞膜去极化,调节裂解时间[36]。其中SAPYZU-15 基因组中有2 个裂解酶基因(orf103和orf155)与MR003 具有较高的氨基酸序列相似性(97.90%和99.00%),MR003[37]是高效的SA烈性噬菌体。因此,在这些基因的协同作用下,噬菌体SAPYZU-04 和SAPYZU-15 潜伏期更短,裂解量更高。此外,温和噬菌体基因组中的整合酶基因和CI阻遏蛋白是决定其生命周期的重要因素,整合酶基因通过催化两个DNA 分子之间重组使得噬菌体在宿主染色体中进行基因的整合和切除[38],并且温和噬菌体通过CI 阻遏蛋白阻断裂解基因的转录和翻译,从而进入溶原周期;而抗阻遏蛋白控制噬菌体在侵染时进入裂解周期[39]。本文的温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14基因组编码特异性整合酶证明它们具有溶原性,均预测到抗阻遏蛋白,但是未预测到CI阻遏蛋白和噬菌体抗性基因,可能导致温和噬菌体SAPYZU-SapM13和SAPYZU-SapM14在宿主谱测定时易进入裂解周期,上述结果与Tian 等[13]的研究结果一致。

图8 全基因组分析Fig.8 Whole genome analysis
3 结论
金黄色葡萄球菌严重威胁食品安全,同时也是全球关注的重大公共卫生问题之一。因此,迫切需要开发安全可靠的生物防治方法,以提高公共卫生水平,确保消费者安全。本研究分离的烈性噬菌体SAPYZU-04 和SAPYZU-15 效价均达到109PFU/mL,而且具有较宽的裂解谱,两株噬菌体对51 株SA 菌株的裂解率均高达100%;在40~60 ℃温度范围内、pH值在3~12 范围内均保持良好活性;潜伏期较短、裂解能力强,裂解量分别高达每个细胞210 和322 PFU。全基因组序列分析结果显示 SAPYZU-04 和SAPYZU-15 均包含多种DNA 代谢基因、多个裂解酶基因、独特的DNA 包装基因及尾部蛋白基因。因此,烈性噬菌体SAPYZU-04 和SAPYZU-15 是一种更合适、更有前景的生物防治选择,有望应用于控制食品中金葡菌的污染。
